预切开内镜下黏膜切除术在治疗结直肠侧向发育性肿瘤中的临床效果
李小娜, 常宇峰, 赵江维, 刘 莉,杨占领, 宋 捷, 金 鹏, 盛剑秋
1.中国人民解放军联勤保障部队第九八四医院消化呼吸科,北京 100094; 2.中国人民解放军总医院第七医学中心消化内科
结直肠侧向发育性肿瘤(laterally spreading tumors,LSTs)是指一类直径>10 mm的结直肠平坦型病变,其沿肠壁横向生长而非垂直性生长[1]。LSTs是结直肠癌的重要癌前病变。对于肿瘤浸润深度不超过黏膜下浅层(<1 000 μm)的LSTs,内镜下黏膜切除术(endoscopic mucosal resection,EMR)是首选治疗方法之一。但传统EMR治疗的病灶在大小方面有所限制,对直径>20 mm的LSTs,内镜下分片黏膜切除术(endoscopic piecemeal mucosal resection,EPMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是目前主要的内镜下治疗方法。EPMR技术上相对较简单,但分片切除影响精确的术后病理评估,且局部残留/复发风险较高;而ESD的整块切除率和完全切除率更高,但技术难度大,穿孔等并发症发生率较高,目前我国只有少数大的医疗中心能常规开展[2]。因此国外有文献[3]提出,对于直径<30 mm的病灶,预切开内镜下黏膜切除术(precutting endoscopic mucosal resection,Precutting-EMR),即预先环周切开病灶周边黏膜,然后行EMR也是一个比较好的选择,既可以整块切除病变,技术难度又比ESD低。Precutting-EMR技术在国内报道较少。本研究对32例直径为15~30 mm的结直肠LSTs进行了Precutting-EMR治疗,现将结果报道如下。
1 资料与方法
1.1一般资料纳入2014年11月至2016年6月中国人民解放军联勤保障部队第九八四医院消化呼吸科及解放军总医院第七医学中心消化内科收治的32例患者,男19例,女13例,年龄33~78岁。这些患者均在之前的结肠镜检查中发现有直径15~30 mm的LSTs,共32个病灶,且第一次结肠镜均未取活检。所有患者术前至少1周未使用阿司匹林或氯吡格雷等抗血小板药物,术前24 h内查出凝血时间均正常。
1.2内镜下治疗所有患者均于结肠镜下治疗的当天清晨使用聚乙二醇电解质散进行肠道准备,待排泄物完全为清水样后进行结肠镜治疗。结肠镜发现目标病灶后,先行质量浓度为2 g/L的靛胭脂染色以确定病灶大小和边界,然后于病灶下方行黏膜下注射至病灶完全抬举,接着以Dual刀(KD-650Q/U,Olympus公司)或圈套器头端环周切开病灶周边黏膜。环周切开黏膜后,以圈套器(ASJ-1,COOK公司)沿切开部位完整套住病灶,最后行电切除(见图1)。切除病灶后,以氩离子凝固术(argon plasma coagulation,APC)或圈套器头端电凝处理创面裸露血管。如有肌层损伤,则以金属夹缝合创面。切除的病灶取出后,展平并黏膜面朝上以不锈钢针固定于平板上,测量并记录标本大小后,将标本全部浸没于质量浓度为40 g/L的中性甲醛溶液中固定送检。
1.3内镜治疗的护理配合黏膜下注射液均为甘油果糖注射液+靛胭脂,所用电外科仪均为Olympus公司ESG-100型,切割功率为pulse-cut-slow模式30 W,电凝功率为forced-coagulation-1模式30 W,APC装置为DEVEL APC 9000。使用圈套器头端环周切开病灶周边黏膜时,将圈套器头端金属丝小心伸出1~2 mm,压在黏膜下注射抬举后的黏膜上,以电切割模式配合医师进行电切。使用圈套器头端电凝处理创面裸露血管时,将圈套器头端伸出1 mm左右,稍接触创面裸露血管,以电凝模式短暂电凝至创面血管白化、消失。
1.4术后标本病理学评估对切除的病灶进行详细病理学评估,包括:是否整块切除(病灶在内镜下被整块切除并获得单块标本)、是否完全切除(整块切除标本的水平和垂直切缘均为阴性为完全切除)及组织学类型(腺瘤/锯齿状病变/腺癌)。对发生黏膜下浸润的腺癌,要求判断浸润深度和有无血管、淋巴管侵犯。
1.5术后处理和随访所有患者术后住院观察48~72 h,无出血或感染迹象即出院,如有并发症则给予相应处理。术后3~6个月进行第一次结肠镜随访,以后每隔1年进行一次结肠镜随访。随访时,镜下仔细观察原病灶切除部位,并进行靛胭脂染色,看有无局部复发或残留。
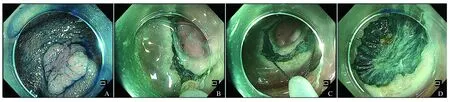
图1Precutting-EMRA:靛胭脂染色以确定病灶大小和边界;B:黏膜下注射至病灶完全抬举后,以圈套器头端环周切开病灶周边黏膜;C:环周切开黏膜后,以圈套器沿切开部位完整套住病灶;D:以圈套器切除病灶后创面
Fig1Precutting-EMRA: Indigo carmine spraying in order to determine the lateral margin and size of the lesion; B: submucosal injection to lift the lesion, then a full circumferential mucosal incision was done with the tip of snare; C: ensnaring the whole lesion from the gap made by circumferential mucosal incision; D: removing the lesion with the snare
2 结果
共对32个病灶行Precutting-EMR治疗,根据切除后标本上病灶实测大小,32个病灶中直径15~20 mm者9个,21~25 mm者13个,26~30 mm者10个。病灶直径(22.5±4.5)mm。32个病灶中,整块切除者29个(90.6%),病理证实为完全切除者28例(87.5%)。未整块切除或完全切除的病灶主要为26~30 mm的病灶。对于21~30 mm的病灶,整块切除率和完全切除率分别为87.0%(20/23)、82.6%(19/23)(见表1)。
并发症方面,仅有1例(3.1%)病灶在术后24 h发生迟发性出血,经内镜下金属夹止血术成功止血。所有治疗均未发生术中穿孔,但有3例(9.4%)发生术中肌层损伤,其中2例发生在环周切开时,1例发生在切除后处理创面血管时,在给予金属夹缝合创面后,均未出现腹痛和腹腔感染等并发症(见图2)。3例发生术中肌层损伤的病灶,大小均>20 mm。
术后病理证实,32个病灶中,腺瘤伴低级别瘤变(轻-中度异型增生)者19例,腺瘤伴高级别瘤变(重度异型增生或黏膜内癌)者7例,广基锯齿状腺瘤/息肉(sessile serrated adenoma/polyps,SSA/P)5例,黏膜下癌者1例(浸润深度<1 000 μm,且无血管及淋巴管浸润)。未完全切除的4例中,腺瘤伴低级别瘤变者2例,伴高级别瘤变者1例,SSA/P 1例。这4例患者均于术后3个月第一次结肠镜复查时,以APC追加烧灼EMR瘢痕旁0.5 cm范围以内的黏膜。截至本研究统计时,共有25例患者随访时间≥1年,均未见肿瘤残余或复发。
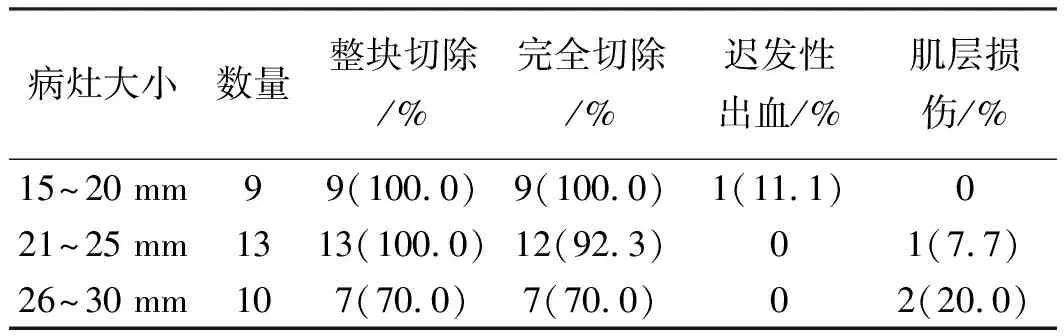
表1 病灶大小与Precutting-EMR结果Tab 1 Clinical outcomes of Precutting-EMR stratified bythe size of lesions
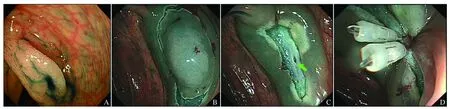
图2Precutting-EMR术中并发症的处理A:靛胭脂染色显示病灶形态和边界;B:环周切开病灶周边黏膜;C:以圈套器切除病灶后,处理创面裸露血管时,导致创面肌层损伤(绿色箭头所示);D:给予金属夹缝合创面
Fig2TreatmentofcomplicationsduringPrecutting-EMRA: Indigo carmine spraying in order to determine the lateral margin of the lesion; B: full circumferential mucosal incision after submucosal injection; C: a small perforation of the bowel wall was seen after resection(shown as the green arrow); D: closure of the perforation with clips
3 讨论
内镜下切除治疗主要用于淋巴结转移风险低且可能完整切除的结直肠肿瘤。目前国内尚无统一规范的内镜切除适应证,多以参考日本指南[2]为主。EMR治疗早期结直肠肿瘤的整块切除率约为85%,治愈性切除率为68.6%~86%[4-5],但当病变≥20 mm时,整块切除率则为19.9%~30.7%[6-7]。EPMR用于传统EMR不能一次完整切除的较大病灶,将病灶分几部分多次切除,适用于>2 cm的巨大平坦病变,但分片切除的组织标本体外拼接困难,影响精确的病理学评估,局部残留/复发风险高,分片较多者应密切随访[8]。ESD可以整块切除>2 cm的结直肠肿瘤,整块切除率为88.0%~98.3%,完全切除率为89.0%~92.0%[9],相对于常规内镜切除和EMR,完整切除的优势非常明显。但ESD技术难度高,并发症发生率远高于EMR,如穿孔率为2.9%~14.5%[2]。目前ESD在我国还仅限于在大的医疗中心开展。
Precutting-EMR技术借鉴了ESD技术中的环周黏膜切开,然后以常规的EMR技术切除病灶。由于预先环周切开黏膜,所以保证了<3 cm病灶的整块切除率[3]。本组病例中,整块切除率为90.6%,完全切除率为87.5%,对于>20 mm的病灶,整块切除率和完全切除率也分别达到87.0%、82.6%。整块切除的效果优于传统EMR技术,几乎达到了与ESD技术相同的水平。而Precutting-EMR技术由于不需要行黏膜下剥离,所以技术难度和操作时间均低于ESD技术。本组病例中,并发症发生率很低,仅1例(3.1%)出现术后迟发性出血,未出现穿孔并发症。因此,Precutting-EMR技术降低了结直肠LSTs内镜下切除的技术难度,同时保证了内镜下治疗的效果,值得在中小型医院推广。
本研究Precutting-EMR治疗中,病灶未整块切除、环周切开或处理创面血管时发生肌层损伤,均与圈套器的未正确使用有关。因为所使用的圈套器最大直径约为30 mm,所以对较大病灶(21~30 mm),在环周切开后,使用圈套器套扎病灶时,应使圈套器沿切开部位伸开至最大后再完整套住病灶,应该仔细观察病灶是否完全套住,再行电切。使用圈套器头端进行环周切开或处理创面血管时,圈套器头端金属丝伸出长度不能超过2 mm,另外与黏膜面或创面的接触不易过深,这样可能尽量减少并发症的发生。此外,本研究中环周切开时发生的肌层损伤均为圈套器操作导致,因此,以Dual刀代替圈套器头端进行环周切开,可能降低肌层损伤发生率。
当然,本研究仅为小样本研究,Precutting-EMR技术与ESD技术的临床效果尚需进一步大样本前瞻对照研究来进行对比。另外,由于临床使用的圈套器最大内径一般为30 mm左右,也限制了Precutting-EMR技术治疗结直肠LSTs的直径不能超过30 mm。新近报道的杂交ESD技术[10],即预先环周切开并初步黏膜下剥离,然后再行EMR切除病灶,与Precutting-EMR技术一样结合了EMR和ESD技术的优势,并将能切除的病灶最大直径扩大至40 mm。这些新的内镜下切除技术,尚待国内进一步研究和推广。

