肝细胞癌肝移植受者选择标准的变迁
林祖源,吴逸超,徐骁(浙江大学医学院附属第一医院肝胆胰外科,浙江大学器官移植研究所,浙江 杭州 310003)
肝细胞癌(以下简称肝癌)是中国60岁以下成年男性中发病率与病死率最高的癌症。1963年Starzl施行了全球首例肝移植手术,伴随移植外科技术的发展,现今肝移植已成为肝癌最有效的根治性手段[1-4],也是目前唯一能够同时治疗肝癌及其基础肝脏疾病的方法。但由于肝移植发展早期未对受者进行严格筛选,导致肝癌复发转移率高,术后5年生存率仅30%~40%[5-7]。自1996年米兰(Milan)标准提出以来,受者预后得到明显改善,但米兰标准的局限性也日益突出。20余年来,世界多家移植中心不断探索和拓展肝癌肝移植受者选择标准,并逐渐突破了肿瘤形态学的束缚。
1 Milan标准
1996年,意大利国立癌症中心的Mazzaferro等[8]提出了Milan标准,具体为:① 单个肿瘤结节直径≤5 cm,或多发肿瘤数目≤3个且最大直径≤3 cm;② 无大血管浸润,无淋巴结或肝外转移。该研究中符合该标准的35例受者4年总生存率与无复发生存率分别达到85%和95%。自此,Milan标准成为国际上应用最为广泛的受者选择标准。2011年,Mazzaferro等[9]报告了一项荟萃分析,纳入15年内不同移植中心发表的19篇肝移植相关研究,结果显示符合Milan标准的受者5年生存率为65%~78%,预后已接近良性肝病患者,显著高于超越标准者。
由于Milan标准对受者的筛选过于严格,仅有6%的肝癌患者符合肝移植条件[10],而符合Milan标准的受者仍有可能出现复发转移。同时,临床上不乏超越Milan标准但获得长期生存的案例,若仅依赖Milan标准,许多肝癌患者会失去从移植手术中获益的机会。因此,如何在保障移植疗效的同时,安全有效扩大获益人群成为肝移植领域的关键问题。近年来,国际上各中心提出的受者选择标准详见图1。
2 基于肿瘤形态学特征的受者选择标准
2011年Germani等[11]进行的一项肝移植荟萃分析显示,当患者肿瘤总直径≥10 cm时,患者死亡风险较肿瘤总直径<10 cm增加了4.59倍,肿瘤总直径≥9 cm的复发风险较<9 cm增加了1.98倍,多发肿瘤相比单发肿瘤的死亡风险提高了1.23倍。因此,在早期提出的肝癌肝移植受者选择标准中,肿瘤的大小和数目一直是核心指标。审慎而科学地放宽形态学指标成为肝癌肝移植受者选择标准的重要拓展方向。
其中最具代表性的是加州大学旧金山分校(University of California, San Francisco,UCSF)Yao等[12]于2001年提出的 UCSF标准,具体为:① 单个肿瘤直径≤6.5 cm;② 或肿瘤数目≤3个,且最大肿瘤直径≤4.5 cm,累积肿瘤直径≤8 cm;③无肝内大血管浸润,无肝外转移。符合UCSF标准与符合Milan标准的受者5年生存率分别为75.2%与72.4%,两者差异无统计学意义,而超越UCSF标准的受者1年生存率仅为50%。可见,UCSF标准对肝癌肝移植选择范围进行了扩大,而术后生存率未明显下降。
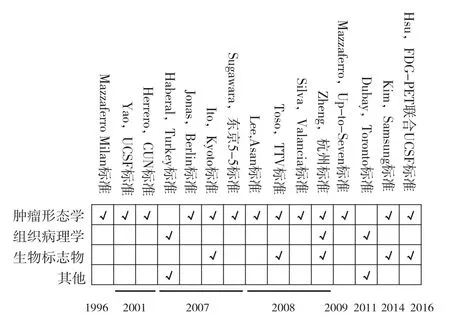
图1 肝癌肝移植受者选择标准
国际上多家移植中心[13-17]同样对肝移植标准进行拓展,结果显示符合其提出标准的受者长期生存率均显著高于超越标准者(表1)。其中德国柏林大学的Jonas等[14]提出的柏林(Berlin)标准取消了对肿瘤数目和单发肿瘤直径的限制,而将多发肿瘤直径之和扩大到15 cm(最大肿瘤直径≤6 cm)。但上述标准中多为单中心或较少中心研究,临床应用价值较为局限。
2009年Mazzaferro等[18]进行了一项回顾性研究,纳入来自36家移植中心共计1556例肝癌肝移植病例,据此提出up-to-seven标准。具体为:① 肿瘤数目及最大直径之和≤7 cm(即单个肿瘤时,最大直径为6 cm;② 2个肿瘤时,最大直径为5 cm,以此类推);③ 无微血管侵犯。其中符合Milan标准的受者5年生存率为76.1%,超越Milan标准但符合up-to-seven标准的受者5年生存率为71.2%,两者差异无统计学意义。Up-to-seven标准综合评估肿瘤特征,扩大了肝移植获益人群范围。
3 突破肿瘤形态学特征的受者选择标准
伴随对肝癌复发转移机制的深入研究,部分移植中心提出,比肿瘤的大小和数目更重要的是其生物学特征,由此建立的选择标准可使受者达到与Milan标准相近的预后。
3.1 土耳其(Turkey)标准:2007年土耳其的Moray等[19]研究26例肝癌肝移植,其中13例超越Milan,术中均未发现肝外转移和大血管侵犯,腹水细胞学检查未发现癌细胞,仅1例肿瘤复发。故据此提出Turkey标准:① 不依赖于肿瘤大小和数目;② 无肝外转移;③ 无大血管侵犯;④ 腹水中无癌细胞;⑤ 剖腹探查和组织病理学检查是最终决定移植的重要因素。2017年,Haberal等[20]回顾性分析了符合Turkey标准的36例肝癌肝移植,发现受者5年与10年总生存率分别达到71.7%与62.7%,肿瘤复发率为25.0%。但该研究样本量较少,有待进一步验证。
3.2 多伦多(Toronto)标准:加拿大多伦多大学的Dubay等[21]于2011年提出了Toronto标准,该标准以肿瘤术前影像学与组织病理学为基础,提出只要满足以下条件即可忽略肿瘤大小及数量:① 影像学排除血管侵犯;② 肝癌局限于肝脏;③ 无肝癌引起的全身症状;④ 排除低分化肿瘤。该标准相比Milan标准的获益人群扩大55%,超越Milan标准但符合Toronto标准的受者5年生存率达到70%。2016年Sapisochin等[22]选取243例受者对该标准进行验证,结果显示符合Milan标准的受者5年生存率为78%,超越Milan标准但符合Toronto标准的受者5年生存率为69%,两者差异无统计学意义。
4 纳入肿瘤生物标志物的受者选择标准
上述移植标准的临床应用,在一定程度上改善了肝癌肝移植受者的总体预后,但即便符合标准,受者术后复发率仍高达8%~20%[23]。综合考虑术后肿瘤复发的危险因素可以更科学地选择受者。肿瘤生物标志物作为一种检测便捷、结果客观的预测指标,逐渐被纳入肝癌肝移植受者选择标准,实现移植受者的精准评估。
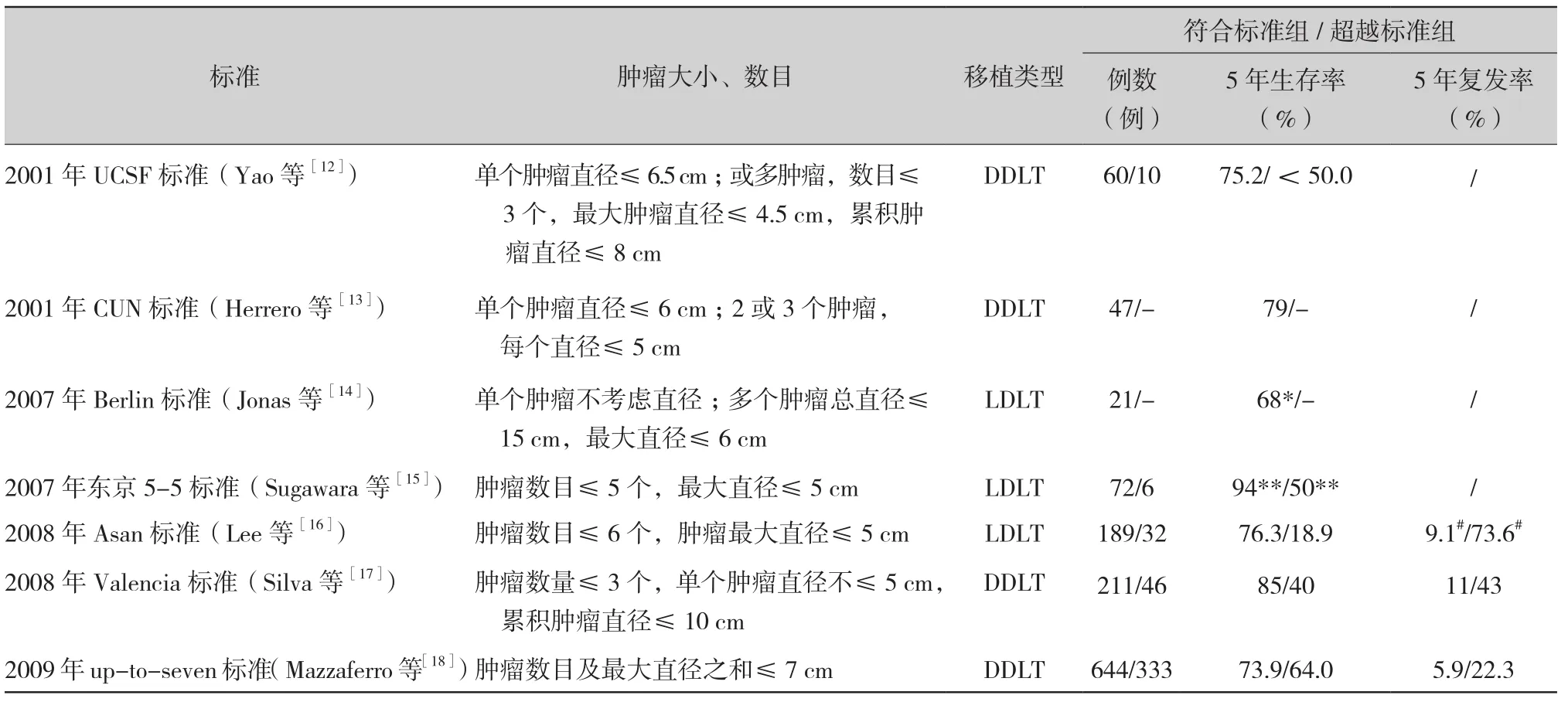
表1 基于肿瘤形态学特征的受者选择标准
4.1 京都(Kyoto)标准:2007年,日本京都大学的Ito等[24]开展单中心125例肝癌肝移植研究,多因素分析提示肿瘤数目≥11个、肿瘤最大直径>5 cm和维生素K缺乏或拮抗剂诱导的蛋白-Ⅱ(protein induced by vitamin K absence or antagonist-Ⅱ,PIVKA-Ⅱ)>400 mAU/ml是移植术后肿瘤复发的独立危险因素。据此提出Kyoto标准:肿瘤数目≤10个,肿瘤最大直径≤5 cm,PIVKA- Ⅱ≤ 400 mAU/ml。2013 年,Kaido等[25]基于198例活体肝移植开展验证,其中符合Kyoto标准的受者5年生存率显著高于超越标准者(82%比42%, P<0.001),5年复发率显著低于超越标准者(4.4%比51.0%, P<0.001)。
4.2 肿瘤总体积 (total tumor volume, TTV) 标准:2008年加拿大阿尔伯塔大学的Toso等[26]回顾性分析移植受者科学登记系统(scientific registry of transplant recipients, SRTR)数据库 6 487 例肝癌肝移植,发现TTV及甲胎蛋白(alpha fetoprotein,AFP)对肝癌患者术后生存率具有预测作用。据此提出了TTV标准,即TTV≤115 cm3且AFP≤400 μg/L。结果显示符合该标准的受者生存率显著高于超越标准者。TTV标准的优势在于剔除了肿瘤数目对肝移植的限制,结合肿瘤总体积和分子标志物AFP,实现对Milan标准的拓展。
4.3 Samsung标准:韩国成均馆大学的Kim等[27]基于180例移植受者提出Samsung标准,具体为:最大肿瘤直径≤6 cm,肿瘤数量≤7个,且AFP≤1 000 ng/ml。结果显示符合该标准的受者5年无瘤生存率显著高于超越标准者(90%比47.6%, P<0.001)。
4.4 FDG-PET联合UCSF标准:氟代脱氧葡萄糖-正电子发射计算机断层显像(F-18 fluorodeoxyglucose positron emission tomography, FDG-PET)通过监测机体糖摄取情况应用于肿瘤的诊断和评估。糖摄取量一定程度上反映了肝癌的活性及侵袭特性,对肝移植术后肿瘤复发有预测价值[28]。2016年中国台湾长庚大学的Hsu等[29]提出以FDG-PET对UCSF标准进行补充,该研究以FDG和肿瘤/正常组织信号比(tumor to nontumor ratio, TNR)为依据,将受者分为低危组(符合UCSF标准且FDG阴性)、中危组(超越UCSF标准且FDG阴性;FDG阳性且TNR<2)和高危组(FDG阳性且TNR≥2),其5年无复发生存率分别为85.5%、83.9%和29.6%。该联合标准以UCSF标准为基础,结合代谢相关生物标志物对受者选择标准进行了拓展。
4.5 Metroticket 2.0模型:2018年Mazzaferro等[30]回顾性分析1018例肝癌肝移植患者的临床资料,建立Metroticket 2.0模型,并基于该模型提出标准:① AFP≤200 ng/ml,肿瘤数目及最大直径之和≤7 cm;② 200 ng/ml≤AFP≤400 ng/ml,肿瘤数目及最大直径之和≤5 cm;③ 400 ng/ml≤AFP≤1000 ng/ml,肿瘤数目及最大直径之和≤4 cm。随后验证结果显示符合该标准的受者5年生存率及无瘤生存率分别为80.8%及86.4%,均显著高于超越标准者。Metroticket 2.0模型动态结合术前AFP和肿瘤形态学参数,旨在建立更为精确的移植受者选择体系。
5 杭州标准及肝癌肝移植新型分子分层体系
中国每年肝癌新发例数及死亡例数约占全世界的50%。近年来,随着肝移植技术发展和器官捐献意识提高,我国已成为肝移植第2大国。因此,建立科学合理的受者选择标准对中国的移植受者尤为重要。
2008年郑树森院士团队提出了肝癌肝移植杭州标准[31],具体为:① 无大血管侵犯和肝外转移; ② 肿瘤直径之和≤8 cm,或肿瘤直径之和>8 cm,但满足术前AFP≤400 μg/L,且组织学分级为高、中分化。杭州标准较Milan标准获益人群扩大了37.5%,且受者术后生存率和无瘤生存率均与Milan标准相近。2016年,一项基于中国多中心共计6 012例肝移植受者的研究进一步提出[32],基于杭州标准可将受者分层为A型(肿瘤直径之和≤8 cm,或肿瘤直径之和>8 cm但AFP≤100 ng/ml)和B型(肿瘤直径之和> 8 cm,AFP为 100 ~400 ng/ml) 。结果显示A型受者5年无瘤生存率显著高于B型。这一分层体系为肝癌肝移植受者预后精准评判提供了重要手段。
杭州标准弥补了Milan和UCSF标准局限于肿瘤形态学的不足,同时引入肿瘤病理学特征和分子标志物对选择标准进行拓展。此标准得到了国际移植界的认同,其价值获得全球多个移植中心的有效临床验证[33-36]。例如德国汉诺威医学院基于159例肝癌肝移植对杭州标准开展研究[35],结果显示符合杭州标准的受者5年生存率与Milan标准间的差异无统计学意义,且相比Milan标准,杭州标准能够提供更为准确的预后预测。2018年8月,国际肝癌肝移植联合研究组(International Joint Group of Liver Transplantation for Hepato-cellular Carcinoma, IJGLH)正式成立,旨在开展国际多中心肝癌肝移植临床研究,并推广以杭州标准为代表的科研成果。
6 受者选择标准相关特殊问题
6.1 活体肝移植:活体肝移植(living donor liver transplantation, LDLT)是肝移植的重要组成部分。活体供肝与尸体供肝不同,不属于公共资源,不受供肝分配网络的调控,具有明确的指向性,故往往有超标准的LDLT案例报道。因此,现有受者选择标准能否适用于LDLT仍有待商榷。有研究结果显示LDLT与尸体肝移植(deceased donor liver transplantation, DDLT)相比,同一选择标准内的受者预后相对更差[37-38]。LDLT术后复发转移的特殊性有待深入研究,特别是在小肝再生与缺血/再灌注损伤等领域开展机制探究尤为重要[39-40]。目前许多移植中心已围绕LDLT开展选择标准相关研究[14-16,24-25,27],临床验证显示标准内受者均能获得与Milan标准相近的预后。一项同时纳入LDLT及DDLT的研究显示,符合杭州标准的不同供肝类型受者具有相近的预后[41]。然而,建立适合LDLT的受者选择标准,仍需基于临床大样本的多中心研究。
6.2 供肝分配:在全球供肝短缺的严峻形势下,肝癌肝移植受者选择无疑将影响供肝分配政策的制定。2002年美国器官分配网络(United Network for Organ Sharing, UNOS)提出基于终末期肝病模型(model for end-stage liver disease, MELD)评分系统指导供肝分配[42-43]。鉴于肝癌患者预后较差且复发率高,UNOS在早期仅提出将肿瘤进展或转移的患者从等候列表中移除,肝癌患者无供肝分配的优先权。现今UNOS提出基于Milan标准、TNM分期及MELD评分对肝癌患者综合评估,即符合Milan标准的T2期肝癌可在MELD基础上得到22分额外评分,并且随等待供肝时间延长每3个月给予再评估[44]。可以预期的是,随着肝移植标准的不断发展,供肝分配体系将逐渐实现对肝病患者的客观评估及分级,以期达到供器官的最佳利用。
7 展 望
展望未来,肝癌肝移植前景广阔也面临诸多挑战:① 治疗导向的肝癌肝移植分子分型体系有待建立,这依赖于多组学、监督式的大数据分析;② 移植后肝癌复发转移机制具有特殊性和复杂性,缺血/再灌注损伤、炎症与感染、代谢稳态失衡、免疫微环境及肠道菌群变化将是重要研究方向;③ 积极开展新技术、新方案的多中心临床研究,推进肝癌肝移植精准诊疗体系建设,实现移植治疗效果质的飞跃。

