肝癌肝移植术后10年复发病例报道并文献复习
贺轶锋,黄晓武,周俭,樊嘉(复旦大学附属中山医院肝外科,复旦大学肝癌研究所,癌变与侵袭原理教育部重点实验室,上海市器官移植研究所,上海 200032)
肝癌居全球肿瘤发病率第6位,致死率排名第4位[1]。肝移植在理论上彻底清除了肿瘤,消除了肝癌产生的肝病背景,随着手术技术和免疫抑制药物的发展,已成为肝癌治疗的一个重要手段。肝癌肝移植患者复发转移多在术后2年内[2],造成复发最主要原因是残存的肿瘤细胞在移植前或者术中通过血液及淋巴液播散,停留在某一部位生长增殖[3],但移植术后远期复发的患者较为少见。本文通过分析复旦大学肝癌研究所17年肝癌肝移植病例的随访情况,探讨术后远期复发的诊治经验。
1 资料与方法
1.1 病例资料:回顾性分析我所2001年4月—2018年9月共施行1 308例肝癌肝移植患者的临床资料,其中2例患者在移植后10年出现肝外复发转移灶,患者均为男性。
1.2 方法:2例复发病例均予密切的实验室以及影像学随访,同时给予手术、放疗、化疗、靶向治疗、调整免疫抑制剂使用等综合治疗手段以获得较理想的治疗效果。
1.3 伦理学:本研究符合医学伦理学标准,得到医院伦理委员会审批(审批号:B2018-321)。
2 结 果
病例1为65岁。2003年11月在复旦大学附属中山医院肝外科行肝右叶部分切除术,术中探查肿瘤1枚,位于Ⅴ、Ⅷ段之间,大小为1.8 cm×1.5 cm×1.0 cm,无包膜,界清。术后病理提示肝细胞癌,中等分化。术前甲胎蛋白(alpha fetoprotein,AFP)检测值为64.1 ng/ml(正常范围0 ~ 20 ng/ml),术后降至正常范围内。2004年1月由于AFP上升至12.8 ng/ml,行肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)1次,术中膈顶见可疑染色,给予氟尿苷0.5 g、顺铂40 mg灌注,吡柔比星40 mg和超液化碘油5 ml栓塞,选择性在肝动脉内注入明胶海绵栓塞。
2006年3月患者因肝癌复发行原位肝移植术,术中见重度肝硬化,硬化结节0.3 ~ 1 cm,肿瘤2枚,1枚位于Ⅴ、Ⅵ段交界,3 cm×2 cm×1 cm;另1枚位于Ⅴ段,内有病灶坏死,由不典型增生结节癌变形成,1 cm×1 cm×1cm。病理为肝细胞肝癌(Edmondson-Steiner Ⅰ-Ⅱ级),周围肝结节性硬化。术后患者未给予任何抗复发治疗措施,口服他克莫司(Tacrolimus,FK506)抗排异,AFP由移植前22.5 ng/ml降 至 2.3 ng/ml。2016年7月患者随访发现AFP上升至19.7 ng/ml,2016年9月继续升高至21.4 ng/ml,肝脏增强磁共振成像(magnetic resonance imaging,MRI)、全身PET-CT、胃镜未见异常。2016年12月彩超肝内未见占位,双侧睾丸未见异常。2017年1月患者因查FK506谷值血药浓度6 ng/ml,自行将FK506 0.5 mg Bid改为每5 d减少0.5 mg,丙氨酸转氨酶(alanine aminotransferase,ALT)升至300 U/L,入院给予保肝治疗,同时调整抗排异药物剂量。2017年2月患者肝功能好转,ALT下降至101 U/L,但AFP继续上升至151.0 ng/ml。上腹部增强CT显示移植肝内少许钙化灶,右肾上极前方小结节,考虑转移可能大(图1)。SPECT/CT显像结合全身骨平面显像示双侧髂骨多发结节状低密度骨质破坏区,以左侧髂骨显著(图2)。全身PET-CT考虑为左侧髂骨转移,右侧髂骨、右肾上极前方转移可能。2017年2月患者行左髂骨肿瘤局部刮除术+骨水泥填塞术,病理为肝细胞肝癌骨转移,术后随访AFP降至 66.0 ng/ml。2017年3月患者接受螺旋断层放疗(tomotherapy system,TOMO),靶区为双侧髂骨和右肾上极前方小结节,放射剂量30、42 Gy/10Fx +45 Gy/15Fx ,AFP由放疗前109.6 ng/ml (2017年3月)下降至98.6 ng/ml(2017年4月)。 2017年4月接受SOX方案化疗:奥沙利铂 200 mg静滴D1 +替吉奥口服60 mg Bid D1-14 ,同时将免疫抑制剂FK506更换为西罗莫司(血药谷浓度维持在5.8 ~ 8.5 ng/ml),2017年7月AFP降至13.4 ng/ml, 2017年8月再次行SOX方案化疗 (用药同第1次),患者化疗后出现Ⅲ级骨髓抑制现象,未能继续接受化疗和靶向治疗,予密切随访。
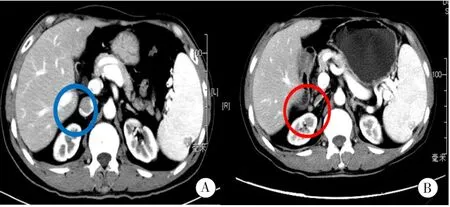
图1 2016年10月上腹部增强CT。B:2017年2月上腹部增强CT :肝移植术后肝内少许钙化灶;右肾上极前方小结节,考虑转移可能大(红圈所示)

图2 2017年2月 SPECT/CT显像结合全身骨平面显像提示双侧髂骨可见多发结节状低密度骨质破坏区,以左侧髂骨显著(黄色箭头所示)
2017年11月患者随访腹腔和盆腔增强CT示肝内少许钙化灶,右肾上极前方小结节较前片减小(图3),双侧髂骨(左侧为主)骨质破坏区,考虑转移,与前片相仿。SPECT/CT显像结合全身骨平面显像示左侧髂骨转移灶术后改变,与前片比较,提示肿瘤活性基本消失,其余全身骨骼未见明显转移征象。虽然在影像学上转移肿瘤表现为“疾病稳定”,但AFP仍上升至56.8 ng/ml。2018年2月全身PET/CT提示新增左侧髋臼转移灶。2018年2 ~3月对新发病灶再次予TOMO放疗(期间AFP由141.8 ng/ml下降至101.4 ng/ml)。2018年4月患者AFP上升至218.3 ng/ml,因骨髓抑制现象有所好转,给予仑伐替尼靶向治疗,AFP呈稳步下降状态,随访至2018年9月为34.9 ng/ml(病例1治疗措施汇总以及肝移植肿瘤复发后AFP变化趋势见图4)。
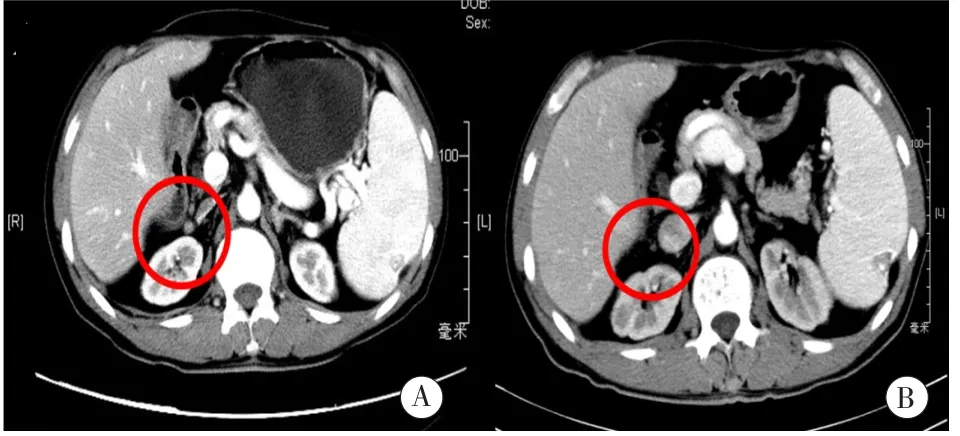
图3 A:2017年2月腹腔增强CT,红圈示右肾上极前方转移结节;B:TOMO放疗后,2017年11月腹腔增强CT示该结节较前减小(红圈所示)

图4 病例1治疗措施汇总以及肝移植肿瘤复发后AFP变化趋势
病例2为65岁,1992年12月因肝细胞癌在本院行肝右叶部分切除,术中见Ⅴ段肿瘤1枚,大小3 cm×2 cm×2 cm,界清,无包膜,术前AFP 219.0 ng/ml,术后恢复正常。2002年因肿瘤复发行TACE治疗2次。2004年10月AFP再次升高至99.9 ng/ml,在本院行原位肝移植。术中探查见肿瘤位于肝Ⅵ段,大小4.5 cm×4 cm×3.5 cm,入肿瘤区肝动脉分支内可见墨黑色栓状物。术后病理为结节性肝硬化伴汇管区胆小管明显增生,重复取材未见肿瘤组织残留。移植后AFP迅速下降至1.4 ng/ml,出院后未给予抗肿瘤复发治疗。2014年12月患者复查AFP升高至30.6 ng/ml,全身PETCT等影像学检查未见异常,予密切随访,直至2015年6月腹部增强CT提示肝右叶包膜处可疑占位,于 2015年7月手术探查发现肿瘤结节位于右侧膈肌近腋后线处,大小约2 cm,界清,包膜完整,术后病理提示肝细胞癌,AFP由141.6 ng/ml迅速下降至正常。患者术后拒绝使用化疗和靶向治疗,继续口服FK506 0.5 mg Bid,随访至今AFP正常。
3 讨 论
临床资料显示肝癌肝移植复发中位时间多为术后8~14个月,一般不超过2年[2]。本文报道的两位患者在移植后10年出现了肝外转移,但肝内始终未见复发灶,国内外罕见有类似文献报道。第2例患者术后病理虽未检出存活肝癌组织,但不排除病肝内仍存在微小癌灶或者移植前已有肝外转移。肿瘤细胞在免疫抑制情况下长时期休眠再复发,可能与微环境改变和机体的免疫监测功能下降有关,值得深入研究。
肝癌肝移植术后如何降低复发一直是临床关注的问题。首先是移植前对高复发风险患者的筛查,目前受体选择标准主要有米兰标准[4]、加州大学旧金山分校标准[5]、up-to-7标准[6]、多伦多标准[7]以及国内常用的上海复旦标准[8-9]、杭州标准[10]等。这些标准主要基于肿瘤大小、个数、有无血管侵犯,个别标准结合AFP、穿刺活检等肿瘤生物学特征进行综合评价。毋庸置疑当选择标准放得越宽,患者生存率会降低,受体、医生、社会共同接受的生存率是何种水平,这涉及到有限的供肝资源如何被公平分配。Volk等[11]提出 5年生存率需达到61%才不至于影响良性肝病受体的公平利益,符合上海复旦标准的患者移植后5年生存率达到74.9%,因此该标准的提出是提高我国肝移植总体疗效的有力支撑。复旦大学肝癌研究所还与米兰标准提出者Mazzaferro等[12]通过术前AFP和影像学获得的肿瘤最大直径、个数,计算出患者术后5年的预期生存概率,可在www.hcc-olt-metroticket.org网站中输入上述参数后实时获得。
本文报道的复发患者术前均符合米兰标准,移植后依然出现转移,说明肿瘤生物学特性复杂,需要更敏感的分子生物学指标来预测患者预后。近年来精准医学及高通量生物信息技术的迅速发展推动肝癌肝移植研究不断前进,例如液体活组织检查技术可以弥补影像学检查的不足,复旦大学肝癌研究所通过分析183例肝癌肝移植患者术前外周血(7.5 ml)循环肿瘤细胞(circulating tumor cells,CTC),发现CTC≥1是导致复发的重要危险因素(CTC≥1与CTC阴性患者2年无瘤生存率分别是76.6%比83.6%,P=0.02)。本所还采用表面加强激光解吸电离-飞行时间质谱技术获取肝癌受体术前血清的蛋白质指纹图谱,建立决策树预测模型,灵敏度为80.0%,特异性为72.7%[13]。利用血浆循环DNA分子遗传学异常预测术后复发转移的敏感度为78.1%,特异性为75.3%[14]。另外钙蛋白酶小亚基 1[15]、X 连锁凋亡抑制蛋白[16]、CpG 岛甲基化表型[17]、循环 DNA p53基因突变[18]、外周血中性粒细胞/淋巴细胞比值[19]等均可准确地预测患者预后。将这些分子指标结合肿瘤的形态学特征,将使受体的筛选更具科学性,也更符合精准医学时代的要求。
上述两位患者坚持长期随访,因此较早地发现了肿瘤的复发转移,治疗效果较理想。复旦大学肝癌研究所肝移植患者中65%以上是肝癌,对高危患者目前术后使用的抗复发措施主要有:① 合理使用免疫抑制剂。平均1个月停止口服激素,在防止急性排斥反应发生的前提下,对肝癌肝移植患者免疫抑制剂逐渐减量、低浓度维持[20]。② 使用新型免疫抑制剂。mTOR抑制剂西罗莫司除了有抗排异作用,还通过多种机制发挥抗肿瘤作用[21-22],西罗莫司与索拉非尼联合应用显著抑制肝癌血管生成及细胞增殖[23-24],多项研究结果也支持将其作为基础免疫抑制剂用于肝癌肝移植的临床实践[25-27]。近期西罗莫司的衍生物——依维莫司已用于肝移植的临床,并且依维莫司可能有更强的抗肿瘤效果[28]。③ 使用化疗或者靶向治疗。其目的在于清除肝外的微小转移灶,延长生存期并推迟肿瘤的复发时间[29]。由于缺乏前瞻性的随机对照研究,靶向治疗和化疗的应用指征、持续时间尚需进一步研究。高通量测序技术和来源于患者原代肿瘤组织的肿瘤移植模型可以筛选出敏感药物达到精准治疗目的。
肝移植术后肿瘤复发转移53%在肝外,31%为肝内外同时复发,复发灶局限于肝内的占16%。肝外转移最多见是肺(43%)和骨(33%),多因素分析提示复发时间早、有骨转移是影响复发后生存的独立因素[2,30]。由于处于免疫抑制状态,肿瘤复发后病情进展迅速,但如果采取手术、TACE、射频消融、放疗、化疗、靶向治疗、中医中药等综合治疗手段,不仅可以提高患者生存质量,还能够延长带瘤生存时间[30]。当然针对复发的治疗需考虑患者整体状况,避免过度治疗,至于免疫检查点抑制剂、嵌合抗原受体T细胞等新技术能否应用于肝癌肝移植领域,值得谨慎地探索和研究。

