四氢姜黄素对H9c2细胞缺血再灌注损伤的影响及机制研究
冯建梅,冯建宇,吴 岩,翟蒙恩,冯 笑,金振晓,曹 磊
以冠状动脉支架和冠状动脉旁路移植术为主的再灌注技术在临床上已经广泛应用,但冠状动脉粥样硬化性心脏病仍然是世界上多数国家致死的主要原因之一[1]。及时恢复缺血区域血流是减少心肌组织损伤最有效的方案之一,但缺血心肌组织恢复血流后,活性氧(reactive oxygen species, ROS)随之大量产生,继而加重心肌细胞凋亡和坏死,这种现象称为心肌缺血再灌注损伤(ischemia reperfusion injury,IRI)[2]。 清除缺血再灌注过程中产生的过量自由基是减轻心肌IRI的有效策略之一。四氢姜黄素(tetrahydrocurcumin,THC)是姜黄素在体内的主要代谢物之一,具有多种药理作用,如抗炎、抗氧化和心肌保护作用[3-5]。 但 THC是否能够减轻心肌细胞IRI尚未见报道且机制不明。本研究拟于离体细胞水平观察THC预处理对于H9c2细胞系IRI保护作用并初步探究其可能机制。
1 材料和方法
1.1 实验材料
1.1.1 主要试剂 THC、二甲基亚砜(dimethylsulfoxide,DMSO)、脱氧葡萄糖、连二硫酸钠、乳酸、羟乙基哌嗪乙硫磺酸(2-hydroxyethyl,HEPES)、蛋白酶抑制剂、磷酸酶抑制剂(Sigma公司);抗 β-actin、Bax、Bcl-2、Caspase-3 抗体(CST 公司);羊抗兔、兔抗鼠二抗(北京中杉金桥公司);二喹啉甲酸(BCA)法蛋白定量试剂盒(Pierce公司);ROS含量检测试剂盒(Invitrogen公司);胎牛血清(Gibco公司);DMEM(Dulbecco's modified Eagle medium)培养液(Hyclone公司);CCK-8细胞毒性检测试剂盒(七海生物公司);丙二醛(malonaldehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dimutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(南京建成生物工程研究所)。
1.1.2 细胞培养 H9c2细胞系购自美国标准菌库(American Type Culture Collection, ATCC),细胞培养方法如前所述[6]。
1.2 实验方法
1.2.1 细胞模型的建立 如前所述[7],缺血液配方为:10 mmol脱氧葡萄糖、137 mmol氯化钠、12 mmol氯化钾、0.49 mmol氯化镁、0.9 mmol二水氯化钙、0.75 mmol连二硫酸钠、20 mmol乳酸以及 4 mmol HEPES(羟乙基哌嗪乙磺酸),缺血液pH为6.5。用缺血液处理H9c2细胞1 h,而后置于正常DMEM无血清的细胞培养基中4 h以模拟在体IRI。
1.2.2 实验分组及给药方式 将正常培养的H9c2细胞随机分为以下4组:对照(Control)组:整个实验阶段,H9c2细胞均用DMEM处理;THC预处理组:H9c2细胞先给予THC 6 h,继而给予DMEM处理4 h;模拟缺血再灌注(SIR)组:H9c2细胞先给予DMEM预处理6 h,继而缺血液处理1 h,再灌注液处理4 h;THC+SIR组:H9c2细胞先给予THC预处理6 h,继而缺血液处理1 h,再灌注液处理4 h。
1.2.3 细胞活力测定 H9c2细胞模拟再灌注后4 h,吸出细胞培养液,用无菌PBS清洗3次;每孔内加入 100 μl DMEM 和10 μl的 CCK-8 试剂,避免加样时产生气泡影响读数;将培养板继续在37℃、5%CO2的孵箱中孵育2 h;用酶标仪测定450 nm波长处的吸光度值。认定正常组细胞活力为100%,各实验组的吸光度值为正常组的相对值。
1.2.4 氧化应激水平检测 DCFH-DA(二氯荧光素)染色检测各组H9c2细胞ROS产量,具体方法如前所述[8]。按照1∶9的比例用生理盐水制备成细胞蛋白匀浆。严格按照试剂盒说明书检测MDA含量、SOD与GSH-Px活性。
1.2.5 Bax、Bcl-2 和 Caspase-3 蛋白表达测定 实验结束后提取各组细胞蛋白样品,提取方法如前所述[9]。用BCA蛋白定量试剂盒检测各组样品蛋白浓度。在电泳加样孔内加入等量蛋白质(40 μg),10%Bis/Tris凝胶分离蛋白,并用湿转法将蛋白转移到PVDF(聚片氟乙烯)膜上;5%脱脂牛奶封闭 PVDF 膜2 h;孵育抗 Bcl-2(1 ∶1 000稀释)、Bax(1 ∶1 000稀释)、Caspase-3(1 ∶1 000稀释)和 βactin(1∶1 000稀释)抗体,4℃过夜;TBST洗涤 3次,8 min/次;室温孵育相应二抗(1∶5 000稀释)1.5 h;TBST 洗涤3 次,8 min/次。 使用 BioRad 成像系统检测蛋白质条带并使用Image Lab软件定量。
1.3 统计分析 用SPSS 13.0统计学软件进行统计分析,实验数据均以均数±标准误(±SEM)表示;差异显著性检验采用单因素方差分析,两组间差异比较用 LSD-t检验。P<0.05表示有统计学意义。
2 结 果
2.1 THC预处理呈剂量依赖性地改善H9c2细胞缺血再灌注后细胞活力 首先笔者检测了不同浓度THC对正常细胞的细胞活力的影响。结果显示,THC 给药剂量为 2.5 μmol、5 μmol、10 μmol时对正常H9c2细胞的细胞活力无明显影响(P>0.05,见图1A)。与Control组细胞相比,SIR组细胞活力明显降低(P<0.05)。与SIR组相比,THC预处理可明显增加细胞活力,且呈剂量依赖性,THC给药5 μmol时保护作用最佳(P<0.05,见图 1B)。 因此,下一步着重探讨5 μmol剂量THC的抗H9c2细胞IRI作用及相关机制。
2.2 THC预处理明显降低SIR后H9c2细胞凋亡率、Bax与Caspase-3表达,增加 Bcl-2表达 凋亡是心肌细胞IRI过程中的主要表现之一。笔者通过TUNEL染色检测了各组H9c2细胞凋亡率。TUNEL染色阳性(绿色)细胞为凋亡细胞,DAPI染色阳性(蓝色)细胞为全部细胞。结果显示,与Control组细胞相比,SIR组细胞凋亡率明显增加(P<0.05)。THC预处理可以显著降低SIR后细胞凋亡率(P<0.05)。单纯给予THC对正常细胞凋亡率无明显影响(P>0.05,见图 2Ⓐ~Ⓑ)。

图2 THC预处理对H9c2细胞缺血再灌注后凋亡率、Bax、Bcl-2和Caspase-3表达的影响
此外,笔者进一步检测了凋亡相关蛋白Bax、Bcl-2和 Caspase-3的表达情况。 Bax和 Caspase-3是促凋亡关键分子,而Bcl-2为抗凋亡关键分子。Western blot结果显示,与 Control组细胞相比,SIR组细胞Bax和Caspase-3表达量明显增加,而Bcl-2表达量明显降低(P<0.05)。与SIR组细胞相比,THC预处理可明显增加Bcl-2表达并降低Bax和Caspase-3表达(P<0.05)。 单纯给予 THC 对正常细胞 Bax、Bcl-2和 Caspase-3的表达量无明显影响(P>0.05,见图 2Ⓒ~Ⓔ)。
2.3 THC预处理可降低SIR后H9c2细胞ROS产量和MDA含量 缺血再灌注过程中ROS的过量产生是导致心肌损伤的关键因素。H9c2细胞再灌注后4 h笔者通过DCFH-DA染色检测了各组细胞ROS产量。结果显示,与Control组细胞相比,SIR组细胞ROS产量明显增加(P<0.05)。与SIR组细胞相比,THC预处理可以明显降低SIR后H9c2细胞内ROS含量(P<0.05)。过量ROS可导致脂质过氧化,引起细胞膜和细胞器的损害,进而导致凋亡。MDA是脂质过氧化的标志性分子。笔者发现,与Control组细胞相比,SIR组细胞MDA含量明显增加(P<0.05)。与SIR组细胞相比,THC预处理可以明显降低SIR后H9c2细胞内MDA含量(P<0.05)。单纯给予THC对于正常细胞内ROS产量和MDA 含量无明显影响(P>0.05,见图3Ⓐ~Ⓒ)。
2.4 THC预处理可增加SIR后H9c2细胞SOD与GSH-Px活性 机体内部有多种抗氧化酶来对抗自由基对组织细胞的损害。其中,SOD与GSH-Px是机体清除自由基的关键酶。笔者检测了缺血再灌注后H9c2细胞内SOD与GSH-Px活性变化。结果显示,与Control组细胞相比,SIR组细胞SOD与GSHPx活性明显下降(P<0.05)。与SIR组细胞相比,THC预处理可以明显增强SIR后H9c2细胞内SOD与GSH-Px活性(P<0.05)。 单纯给予THC对于正常细胞内SOD与GSH-Px活性无明显影响(P>0.05,见图 3Ⓓ~Ⓔ)。
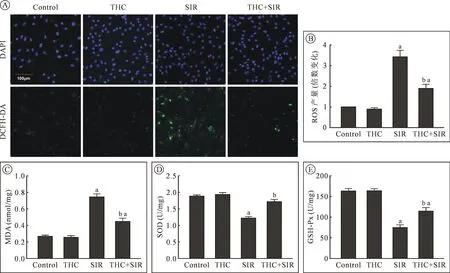
图3 THC预处理对H9c2细胞缺血再灌注后ROS、MDA、SOD与GSH-Px的影响
3 讨 论
缺血性心肌损伤是常见的心血管病之一,其致死率和致残率较高[1]。心肌缺血发生后,及时恢复缺血区域血流是减少心肌组织损伤最有效的方案之一,但缺血心肌组织恢复血流后,ROS随着大量产生,引起脂质过氧化继而加重细胞凋亡和坏死,这种现象称为心肌IRI[2]。大量研究证实,氧化应激和凋亡在心肌IRI的病理过程中发挥了重要作用[2,10],因此,寻找有效治疗方案抑制缺血再灌注过程中氧化应激和凋亡一直是国内外基础与临床研究的热点。
THC是姜黄素在体内的主要代谢产物之一,具有抗氧化、抗凋亡等多种生物学活性。Xiang等[11]研究发现,THC可通过调节FOXO转录因子抑制氧化应激反应从而发挥延长寿命的作用。Gao等[12]发现,THC可以通过激活自噬,抑制氧化应激诱导的脑组织凋亡,改善神经功能并降低脑水含量,最终发挥抗创伤性脑损伤作用。Wei等[13]进一步证实,THC主要通过激活Nrf2信号通路抑制脑细胞凋亡,减轻创伤性脑损伤。Song等[14]通过在体和离体研究证实,THC可以缓解肾脏组织氧化应激反应,抑制凋亡关键分子Caspase3的激活,抑制凋亡,进而改善顺铂引起的肾脏损害。近年来研究发现,THC处理也是缓解脏器IRI的有效措施之一。Lin等[15]证实,THC通过调节细胞外信号调节激酶抑制GRASP65磷酸化发挥抗脑IRI作用。值得注意的是,也有报道指出,THC可改善缺血再灌注引起的心脏损伤。Ali等[16]通过大鼠心肌缺血再灌注模型发现,与假手术组相比,心肌缺血再灌注组大鼠发生大面积心肌梗死、脂质过氧化增高、过氧化氢酶抗氧化活性下降、谷胱甘肽减少。而THC处理可以明显改善上述改变。但THC是否直接作用于心肌细胞尚无相关报道。由于H9c2细胞被广泛应用于心肌IRI相关研究[7,9],因此本研究采用 H9c2 细胞探究THC的保护作用及具体作用机制。
如前所述,氧化应激反应是导致心肌IRI的重要启动因素[2]。H9c2细胞再灌注4 h后,笔者首先检测了H9c2细胞内ROS产量,结果显示THC能够有效抑制 SIR后 H9c2细胞ROS产生。MDA是ROS过量产生引起脂质过氧化的主要产物之一,通过检测其含量,笔者发现,THC处理可以明显降低H9c2细胞缺血再灌注后MDA含量。SOD是体内抗氧化酶之一,可以将过量的过氧化物还原为过氧化氢[17-18]。 GSH-Px 可将过氧化氢还原为水以及将脂质氢过氧化物还原为相应醇类[19]。通过检测H9c2细胞缺血再灌注后SOD与GSH-Px活性,笔者首次证实,THC能够提高SOD与GSH-Px活性,增强细胞抗氧化应激能力。
细胞凋亡是一种由基因控制的细胞自主的有序的死亡形式,对多细胞生物的发育和存活至关重要。线粒体途径细胞凋亡是凋亡的主要方式之一,是细胞应对线粒体DNA(mtDNA)损伤、生长因子剥夺、热休克、缺氧和内质网应激等多种刺激的反应[20]。研究发现,ROS与线粒体途径的激活密切相关。线粒体是细胞内ROS产生的最主要部位,线粒体衍生的ROS能够损害线粒体内成分,例如mtDNA,导致其产生氧化应激损伤。线粒体DNA损伤会损害参与电子传递链蛋白质的生成,导致呼吸链功能的破坏,ROS的产生进一步增加,继发线粒体膜电位的丧失和ATP合成受损。这些事件通过线粒体途径最终导致细胞凋亡[21]。通过TUNEL染色和凋亡相关蛋白表达水平检测,笔者首次证实,THC能够明显抑制H9c2细胞缺血再灌注后凋亡情况。THC抗凋亡作用的发挥可能与其清除ROS的作用有关。综上所述,本研究从H9c2细胞水平首次证实THC预处理能够明显改善心肌IRI,其主要作用机制为抑制缺血再灌注引起的细胞氧化应激反应和细胞凋亡。本课题将促进THC治疗IRI进一步作用及机制研究,并为临床上应用THC治疗缺血性心肌病患者提供了新的理论依据。

