黄连素激活核因子E2相关因子/血红素氧合酶-1增强内皮细胞抗过氧化氢损伤
王 臻,丁 慧,杨 瑞
伴随着全球人口的老龄化,衰老相关性疾病(特别是累及循环系统的)正日益威胁着人类健康[1]。内皮细胞在维持脉管系统稳态中具有关键作用[2]。一旦暴露于有害因素,内皮细胞将产生一系列改变,统称为内皮功能障碍[3],这也是许多心血管疾病(如动脉粥样硬化,高血压和心力衰竭)发展的主要病理基础[4-5]。研究表明,氧化应激和内皮功能之间存在相互作用,活性氧(reactive oxygen species,ROS)增加则会导致内皮功能障碍[6]。 核因子E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)是重要的抗氧化应激酶,主要通过调节血红素氧合酶-1(heme oxygenase-1,HO-1)发挥作用[7]。 黄连素(berberine,BBR,图 1Ⓐ)是黄连的主要活性异喹啉生物碱成分,具有多效药理活性,包括抗菌,抗生素,抗炎和抗氧化特性[8],特别是对心血管系统也有保护作用[9]。现已证明,BBR通过激活 Nrf2/HO-1 发挥神经保护[10-11]及抗内毒素性休克[12]的功效,然而对内皮细胞的作用未见报道。本研究采用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为研究对象,利用过氧化氢(H2O2)构建氧化应激条件下的凋亡损伤模型,观察BBR对其的保护作用及Nrf2/HO-1所扮演的角色,旨在为揭示BBR介导HUVECs抗氧化应激损伤提供新的理论基础。
1 材料与方法
1.1 主要材料和仪器 HUVECs细胞株(美国);CCK-8试剂盒(上海);细胞ROS检测试剂盒(上海);末端标记法(TUNEL)(德国);DAPI(美国);RPMI-1640培养基和胎牛血清(美国);BBR和青-链霉素双抗混合液(100×)(北京);细胞核蛋白与细胞浆蛋白抽提试剂盒(江苏);Nrf2和HO-1抗体(美国);Cy3标记的山羊抗兔LgG二抗(西安);核纤层蛋白 B(Lamin B)和 β-肌动蛋白(β-actin)抗体以及Nrf2 siRNA(美国);辣根过氧化物酶标记的羊抗鼠和羊抗兔二抗(北京);3111型CO2细胞培养箱(美国);SpectraMax M5型多功能酶标仪(美国);FV10i激光共聚焦显微镜(日本);ChemiDoc XRS+(Universal Hood II)型Western blot蛋白分离及成像系统(美国)。
1.2 实验方法
1.2.1 细胞培养 HUVECs培养于含10%胎牛血清及1%双抗混合液的RPMI-1640培养基中,培养条件为37℃、CO2体积分数5%的饱和湿环境。隔天换液,待细胞生长达90%左右传代(0.25%胰酶)。取对数生长期的细胞为实验对象,达80%左右后给予干预。
1.2.2 实验分组和药物处理 实验分为以下4组:①Control组;② H2O2处理组;③H2O2+L-BBR(5 μmol/L)组;④H2O2+H-BBR(10 μmol/L)组。 根据之前的研究构建H2O2损伤模型[13]。BBR溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中,4℃保存,用时以RPMI-1640培养基稀释成工作液(DMSO浓度低于1‰),根据分组预处理12 h。
1.2.3 细胞活力测定 以 0.5×105个/孔的密度于96孔板中接种细胞,每组设5个复孔。分别给予不同处理,弃去培养基,PBS洗3次。倒置显微镜观察后,每孔加入100 μl的RPMI-1640 和10 μl的CCK-8 试剂,37℃孵育2 h后,于450 nm波长处测定吸光值。1.2.4 细胞凋亡检测 以 0.5×105个/孔的密度于24孔板内制作细胞爬片,并给予不同处理后,4%的多聚甲醛室温固定15 min,并用含1‰的Triton X-100溶液进行细胞破膜10 min。严格按照试剂盒步骤对细胞进染色。50%甘油封片后用计算随机10个视野中的细胞凋亡率(凋亡率%=绿色细胞数/蓝色细胞数×100%)。
1.2.5 ROS含量测定 按照1∶1 000比例用无血清培养液稀释DCFH-DA(二氯荧光素),使其终浓度为10 μmol/L。取一定量的上述工作液覆盖于处理后的细胞爬片,37℃避光孵育30 min。于488 nm激发波长和525 nm发射波长处,测定荧光强度,单纯DCFH-DA溶液用做调零,Image J分析结果,空白处理组的值设为“1”,各组值与之相后比表示。
1.2.6 荧光染色 调整细胞密度为 0.5×105个/ml,接种至装有盖玻片的24孔板中。常规培养,待细胞稳定,并给予药物处理。弃去培养基,4%多聚甲醛室温固定15 min,1‰的 TritonX-100破膜 15 min,5%的牛血清白蛋白封闭30 min,PBS洗3次,加入一定比例稀释的Nrf2抗体(1∶200),4℃过夜。随后,PBS洗3次,加入Cy3标记的山羊抗兔LgG二抗(1 ∶200),室温避光孵育 30 min,DAPI复染细胞核10 min,封片后用激光共聚焦显微镜下观察染色结果,并用Image J分析结果。
1.2.7 细胞转染 严格按照试剂说明书,对细胞进行操作,转染48 h后,Western blot(免疫印迹法)检测目的蛋白的表达情况[14]。
1.2.8 Western blotting 分析 细胞处理后,预冷的PBS洗3次,并用清洁的细胞刮收集,高速离心并尽可能洗尽上清液。根据操作手册步骤提取细胞核蛋白液。分别定量后,高温变性,行SDS-PAGE(聚丙烯酰胺凝胶电泳),将蛋白质转移至硝酸纤维素膜上,加入含5%脱脂奶粉的TBST(洗涤缓冲液)中,室温封闭1.5 h,分别用一定浓度的一抗(Nrf2、HO-1和β-actin为1∶1 000)4℃孵育过夜。加入相应的二抗(1 ∶5 000)室温孵育1.5 h,电化学发光法显影,并用软件分析蛋白的相对表达量。
1.3 统计学方法 所有实验操作均重复3次。以SPSS 13.0统计软件行统计分析,实验结果以均数±标准差(±SD)表示。采用单因素方差分析(oneway ANOVA)比较差异,进一步采用LSD法组间比较。P<0.05说明有统计学意义。
2 结 果
2.1 BBR对H2O2诱导HUVECs损伤后细胞活力及ROS的影响 实验结果显示,不同浓度BBR(5、10、50、100 μmol/L)处理 HUVECs细胞 24 h 后,CCK-8检测发现,BBR在浓度剂量超过50 μmol/L时,各组吸光度(optical density,OD)显著降低(P<0.05),提示BBR对细胞产生毒性作用,因此选择5和10 μmol/L用于后续实验(图 1Ⓑ)。 H2O2明显抑制HUVECs增殖,与对照组相比,细胞表现为变圆、碎裂、折光性增强,并可见大量悬浮体;BBR预处理12 h有效缓解上述损伤情况(×200,图1Ⓒ)。CCK-8结果进一步提示,模型组细胞活性明显降低,BBR干预增加各损伤组的OD值,并呈“剂量依赖性”,以10 μmol/L H-BBR 组作用最为明显(P<0.05,图 1Ⓒ)。此外,如图1Ⓓ所示,H2O2提高 HUVECs中ROS的水平,表现为绿色荧光亮度增加,BBR预处理则显著降低其表达含量(P<0.05,图1Ⓓ)。以上结果提示,BBR对H2O2诱导的HUVECs损伤具有一定的保护作用。
2.2 BBR对H2O2诱导HUVECs损伤后细胞凋亡的影响 TUNEL 染色显示,H2O2(200 μmol/L)处理 4 h后,HUVECs中绿色荧光所占的比例明显增加(图2),应用 BBR(5 和 10 μmol/L)预处理 12 h 有效降低细胞凋亡率,差异具有统计学意义(P<0.05,图2),说明BBR能显著抑制H2O2诱导HUVECs发生细胞凋亡。
2.3 BBR对 H2O2诱导 HUVECs损伤后细胞Nrf2/HO-1通路的影响 Nrf2/HO-1是重要的细胞抗氧化应激调控通路,参与多种疾病病理过程[7]。本研究显示,H2O2作用后,HUVECs中 Nrf2/HO-1 通路被部分激活,表现为Nrf2的荧光信号核内转移;BBR处理后,Nrf2转位进一步增强(P<0.05,图 3)。Western blot检测同时证实,H2O2增加Nrf2在核内的表达,并降低其在细胞质内的含量;BBR处理后趋势更加明显。此外,作为Nrf2重要的下游蛋白,HO-1在H2O2作用下明显上调,BBR则进一步提高其水平(P<0.05,图 4)。 以上结果证明,BBR 可以有效激活H2O2诱导HUVECs损伤过程中Nrf2/HO-1通路的活性。
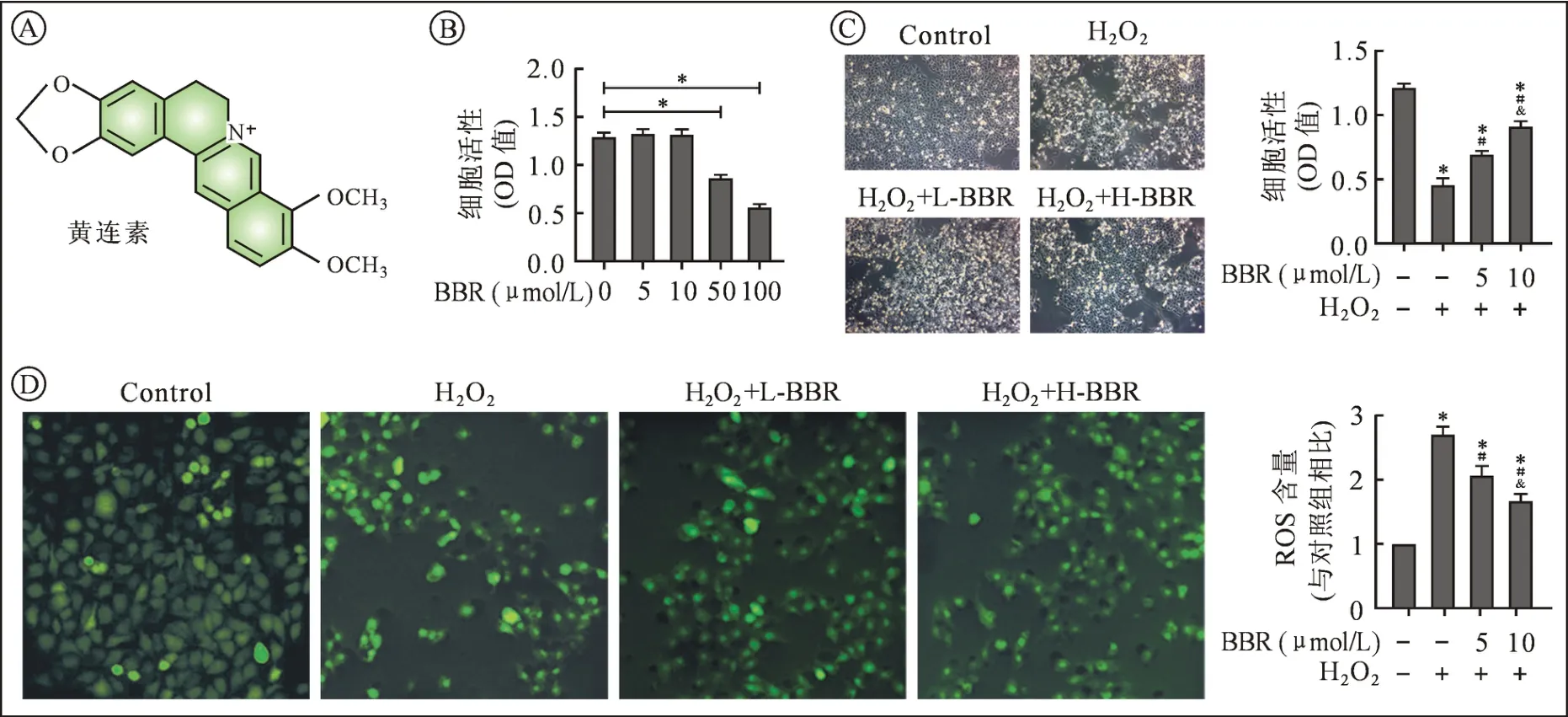
图1 不同浓度BBR对H2O2诱导HUVECs损伤后细胞活力及ROS的影响

图2 不同浓度BBR对H2O2诱导HUVECs损伤后细胞凋亡的影响

图3 不同浓度BBR对H2O2诱导HUVECs损伤后细胞Nrf2分布的影响
2.4 抑制Nrf2对 BBR保护 HUVECs抗 H2O2损伤的影响 为了探讨 Nrf2/HO-1在 BBR介导 HUVECs抗H2O2损伤中的作用,实验应用Nrf2 siRNA预先降低Nrf2的活性。结果显示,①单纯Nrf2 siRNA 对 HUVECs未见明显毒性(P>0.05,图 5Ⓐ)。在细胞核及细胞质水平,Nrf2 siRNA均能显著降低Nrf2表达含量(P<0.05,图 5Ⓔ)。 抑制 Nrf2活化后,H2O2的损伤作用明显增强。如图5Ⓐ所示,相对于H2O2处理组,H2O2+Nrf2 siRNA组OD值更低(P<0.05,图 5Ⓑ);②细胞 ROS 活性更强(P<0.05,图5Ⓒ);③细胞 TUNEL 阳性率更高(P<0.05,图 5Ⓓ)。同时,降低Nrf2活性有效逆转了BBR对H2O2损伤HUVECs后的保护作用,表现在H2O2+BBR+Nrf2 siRNA处理组中 OD值降低(P<0.05,图 5Ⓑ)、细胞 ROS活性增强(P<0.05,图 5Ⓒ)、凋亡率升高(P<0.05,图5Ⓓ)。 此外,Western blot结果显示,联合应用BBR和Nrf2 siRNA可以进一步减少Nrf2及下游 HO-1的表达程度(P<0.05,图 5Ⓔ)。上述结果揭示,抑制Nrf2通路可以明显降低BBR对H2O2诱导HUVECs损伤的保护作用。

图4 不同浓度BBR对H2O2诱导HUVECs损伤后细胞Nrf2和HO-1表达的影响

图5 抑制Nrf2对BBR保护HUVECs抗H2O2损伤的影响
3 讨 论
血管内皮细胞是心血管系统重要的组成部分,其损伤后可导致炎性细胞浸润、血管平滑肌增殖等病理状态,这是多种疾病的发病基础[4]。氧化应激反应是指机体组织或细胞内的氧自由基生成增加或清除减少,导致ROS在体内或细胞内蓄积从而引起的氧化损伤过程[15]。生理条件下,氧自由基和机体相应的清除功能处于动态平衡,如果抗氧化系统作用减弱,就会产生氧化活性物堆积,可以引起内皮功能障碍[16-17]。有效的逆转上述过程是治疗相关疾病,并提高患者生存率的有效途径。因此,探索新型的抗内皮细胞氧化应激损伤方法以及潜在的调控机制,成为目前该领域研究的热点。
BBR又称小檗碱,是从毛莨科植物(如黄连、黄柏、三颗针)的根茎中提取的活性碱成分,它具有多种药理学作用,包括抗菌、抗糖尿病、抗癌活性等[8]。近年来,BBR对心血管系统疾病转归的影响受到了广泛的重视。Zhao等人[18]的研究结果证实,BBR通过调控内质网应激相关蛋白显著降低缺血再灌注损伤后的心肌梗死面积,改善心脏功能,并抑制心肌细胞凋亡和应激反应。此外研究发现,BBR疗法通过腺苷酸活化蛋白激酶/雷帕霉素靶蛋白途径抑制心肌自噬和细胞凋亡,部分缓解术后患者的心肌损伤[19]。重要的是,研究表明,BBR对高脂、高糖诱导的血管内皮细胞损伤具有保护作用,其机制与调控一氧化氮分泌以及细胞外信号调节激酶通路有关。综上,BBR具有广泛的药理学作用以及多种分子调控机制,在心血管系统疾病的治疗过程中发挥大的作用;然而,其对不同因素诱导的内皮细胞损伤的保护机制仍需深入研究。因此,本实验以常用的氧化应激诱导剂H2O2构建HUVECs损伤模型,探讨 BBR 对其保护作用。 结果显示,H2O2(200 μmol/L)处理4 h,引起细胞活性降低和细胞凋亡。结合DCFH-DA检测发现,上述过程中伴随着大量ROS产生,这与之前的研究相一致[13,20]。 不同浓度的BBR(5 和 10 μmol/L)呈“剂量依赖性”地有效清除细胞内ROS含量,进一步降低凋亡率,以增加细胞活性,说明BBR通过抑制氧化应激反应介导HUVECs抗H2O2损伤过程。
Nrf2属于碱性亮氨酸拉链转录激活因子家族成员,是体内分布广泛、作用最强的抗氧化应激活性蛋白[21]。生理情况下,Nrf2通常与细胞质内的Kelch样环氧氯丙烷相关蛋白-1(Kelch-like Ech-associated protein-1,Keap1)结合,由胞内的泛素化途径进行降解,以保持Nrf2处于低水平的非活化状态[22]。一旦细胞受到损伤,Nrf2自身会发生磷酸化,随后Nrf2与Keap1解离,Nrf2向细胞核内移位,后与抗氧化应激反应元件作用,启动下游抗氧化或抗炎蛋白的表达[23]。HO-1是由Nrf2调节的重要抗氧化蛋白,参与血管多种疾病的发生与发展[24]。Chen等发现外源性给予黄芩苷可以通过激活Nrf2及其下游分子降低高血糖引起的HUVECs氧化应激损伤反应[25]。 重要的是,BBR 可以激活 Nrf2/HO-1,减轻细胞氧化应激损伤,介导神经保护[11,26]或者肝保护[27]过程。上述发现强烈提示,BBR可能通过类似的机制在HUVECs损伤中发挥作用。本实验中,H2O2诱导HUVECs损伤后,细胞内Nrf2核转位明显增强,下游HO-1蛋白表达增加。说明Nrf2/HO-1参与氧化应激导致的HUVECs损伤,这种激活可能是细胞的内在保护机制。应用BBR预处理则进一步提高上述保护效应,提示BBR可能通过Nrf2/HO-1活化发挥保护作用。此外,特异性siRNA,不仅有效抑制目标及其下游蛋白HO-1的表达和活化,而且明显减弱BBR对HUVECs的保护作用,提示BBR部分通过上调Nrf2/HO-1介导HUVECs抗H2O2诱导的氧化应激损伤。

图6 黄连素激活Nrf2/HO-1介导内皮细胞抗H2O2损伤机制的模式图
综上所述,BBR具有明显的HUVECs保护作用,该作用一定程度上与激活Nrf2/HO-1信号通路,并进而提高细胞清除ROS的能力,以减轻氧化应激诱导的凋亡有关(图6);然而,BBR保护HUVECs的具体作用机制尚未完全阐明,仍需深入研究。

