成人心脏术后心源性休克患者接受体外膜肺氧合辅助的临床结果荟萃分析
邵程程,王粮山,王 红,侯晓彤
研究显示心脏术后顽固性心源性休克在成人患者发生率为 0.5%~1.5%,早期预后较差[1]。 对于此类患者,体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是短期机械循环辅助的常规选择。在ECMO辅助下,患者心肺功能得以恢复或者过渡到其他后续治疗[2]。近些年,ECMO在心脏术后心源性休克(postcardiotomy cardiogenic shock,PCS)的治疗中得到广泛应用。然而,关于ECMO能提高PCS患者的生存率的证据仍然匮乏。
目前,关于接受ECMO治疗的PCS患者的研究很少。有3项观察性研究的系统回顾和荟萃分析证明应用ECMO能够提高患者生存率[3-5]。这其中的2项分析纳入了较少患者,而另一项则未报道中期死亡率及ECMO并发症的发生率。因此,关于接受ECMO治疗的PCS患者的生存结果的研究仍不足。
鉴于ECMO对PCS患者生存影响方面的研究还很欠缺,本研究旨在通过检索相关文献,系统评价ECMO对心脏术后患者的临床疗效。
1 资料与方法
1.1 研究策略 本项系统回顾及荟萃分析是根据系统评价和荟萃分析的首选报告项目指南进行报道。通过搜索 PubMed,Embase及Cochrane Library for English等数据库查找截止日期为2018年5月30日前的相关文章,检索词包括“extracorporeal membrane oxygenation”,“extracorporeal life support”,“cardiac surgery”和“postcardiotomy”。1.2 文献纳入标准
1.2.1 人群 人群选取的是发生PCS的患者。排除研究人群包括儿童及发生过心脏骤停患者的文献。研究患者人数少于10人的文献也被排除。当不同的文献报道的是同一人群的时候,只选取其中最大的研究。
1.2.2 干预 应用 ECMO。
1.2.3 终点 院内死亡率、1年生存率、中期生存率、PCS相关并发症及ECMO相关并发症。
1.2.4 研究设计 观察性的回顾性队列研究。排除关于事件报道或动物实验的研究。
1.3 数据提取及质量评估 两个作者独立评估选取文献,选出符合纳入标准的所有观察性研究。对于缺失信息或需要详细资料的研究,作者会联系第一作者,以求获许更多信息。通过讨论解决团队内部的分歧。两个作者独立浏览所有合格文献,提取出以下信息:第一作者及发表的年份、背景、设计、研究类型、纳入及排除标准、患者数量、ECMO持续时间、ECMO类型、院内死亡率的高风险因素、终点事件。
主要终点事件设定为院内死亡率。次要终点事件包括1年及中期生存率、下肢缺血、二次手术、肾衰竭、神经系统并发症及感染。中期生存率定义为3~5年生存率。
使用纽卡斯尔渥太华量表的修改版本评估观察性研究的方法学质量[6]。总分越高表示偏倚风险越低;r5分(9分)表明存在较高的偏倚风险。2名作者独立评估偏倚风险。
1.4 统计分析 使用R版本3.2.3软件进行数据分析(R Foundation)。结果以95%置信区间(95%CI)汇集的比例(%)表示。使用Q统计量来评估统计学异质性(P<0.1被认为有统计学差异)和I2检验(I2>50%表示有显著的统计学差异)。鉴于整个研究的临床和方法学变异范围广泛,故使用随机效应模型。
2 结 果
2.1 搜索结果和研究特征 通过计算机文献检索选取304项研究,其中93项为重复文献,在对标题和摘要进行初步审查后排除183项。对其余28篇发表的文献进行全文审查,并根据纳入标准进行评估,排除未进行心脏手术2篇、儿童患者2篇、心脏骤停1篇、病例报道4篇、重叠5篇,最后,确定14项研究进行系统评价和荟萃分析[7-20]。
纳入文献的出版日期介于2004年和2018年之间,纳入文献均为回顾性研究,自1991年2016年共包括2 653(14~1 137)名患者,其中两项为多中心研究[15-16]。 所有研究皆报道了院内死亡率(51%~76%),6 项研究报道了 1 年生存率[8-9,12,15-16,19],3项报道了中期生存率[9,16,19],只有 2 项报道了 10 年生存率[12,19]。 ECMO模式 13项研究为静脉—动脉(VA),仅 1 项研究未报告[19]。 9 项研究报道了下肢缺血的发生率[7,8-9,11,13-14,16,18-19], 8 项研究报道了二次手术的发生率[7,8-9,11,13,16,19-20], 9 项报道了肾衰竭的发生率[7,8-11,13-14,16-17,19], 10 项报道了神经系统并发症的发生率[7,8-11,13-14,16-17,19],7 项报道了感染的发生率[7,8,10-11,13,17,19]。只有 5 项研究的纳入人数>100 人[7,9,16,18-19],涵盖了本实验几乎 86%的患者。手术方式主要为冠状动脉旁路移植术、瓣膜成形术、主动脉手术和心脏移植。
9项研究调查了接受ECMO的PCS患者的院内死亡风险因素[8-9,11-14,16,18-19]。 大部分研究表明,年龄>65岁、ECMO前及ECMO后的血乳酸值升高、肾功能不全、ECMO的持续时间长、神经系统并发症都是接受ECMO治疗的PCS患者的院内死亡风险因素。
2.2 质量评估 因所有的研究都是回顾性分析,故大多数研究的质量评分较低。只有6项研究得分介于6和 8 之间,表明方法学质量很高[7,9,11-13,19]。 见表 1。
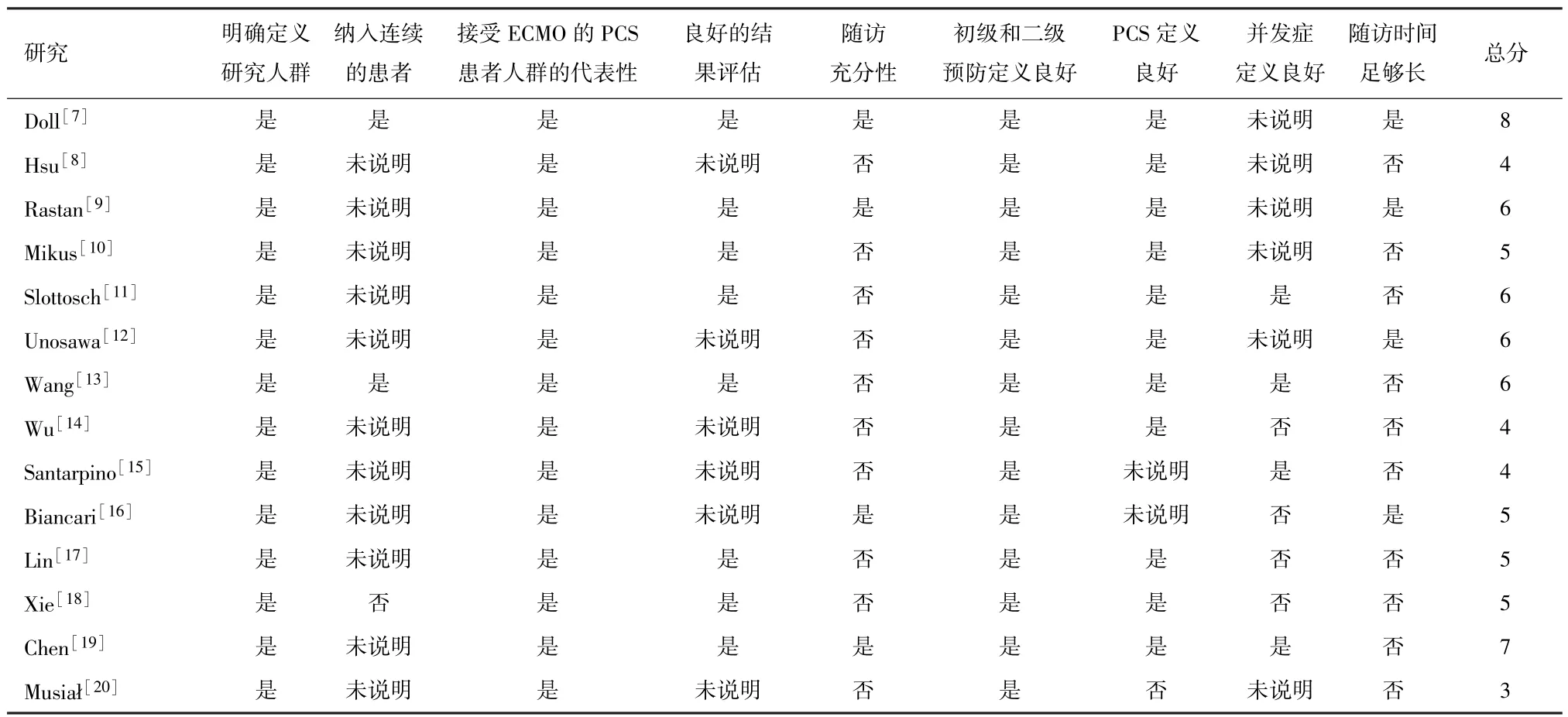
表1 文献的质量评估
2.3 终点 累计分析表明,接受ECMO的PCS患者的合并院内死亡率为66.0%(95%CI 61.0%~71.0%,I2=78.3%)。为了评估结果的稳定性,本项研究进行了敏感性分析,显示每项研究的省略没有显著差异,证实结果具有稳定性。
6项研究(n=1 920)调查了1年生存率,合并生存率为 24%(95%CI 19.0% ~30.0%, I2= 75.2%),2项研究(n=665)报道了中期生存率,合并生存率为19%(95%CI 10.0%~34.0%, I2=92.2%)。
14%(95%CI 10.0%~20.0%, I2=50.2%)的患者发生下肢缺血(6项,n=538)。1项研究发现,接受股动脉切开ECMO支持的PCS患者与接受经皮股动脉穿刺ECMO支持的患者之间的腿部缺血发生率无显著差异(优势比1.55,95%CI 0.36~6.56,P=0.83)。 44%(95%CI 21.0% ~ 70.0%, I2= 98.8%)的患者因出血接受了二次手术(9项,n=2 273),49%(95%CI 38.0%~61.0%, I2= 95%)的患者发生肾衰竭(12 项,n=2 360),18%(95%CI 11.0%~29.0%I2=94.1%)的患者发生神经系统并发症(10项,n=2 286),23%(95%CI 16.0%~31.0%,I2= 83.6%)的患者发生系统感染(8项,n=1 652)。
2.4 出版偏倚 Egger检验的所有P值均<0.05。
3 讨 论
据作者所知,本项研究是第一个报道接受ECMO的PCS患者的合并1年和中期生存率及ECMO并发症发生率的系统回顾和荟萃分析。在本研究中,14项观察性研究共纳入2 653名患者,并证明用ECMO治疗的PCS患者的短期和中期生存率比较低。此外,ECMO并发症的发生率相对较高,许多危险因素与院内死亡率有关。
目前,只有3项meta分析着重于研究ECMO在心源性休克患者中的潜在益处[3-5]。 Khorsandi等人纳入24项研究,包括接受ECMO的1 926例PCS患者,发现总院内死亡率为 69.2%[3],这与本研究相似。然而,该研究并未报道ECMO的中期生存结果及ECMO并发症发生率。此外,Khorsandi等人没有评估纳入研究的质量偏倚。Ouweneel等对包括235名急性心肌梗死后PCS患者在内的4项观察性研究进行了meta分析,他们证实ECMO与主动脉内球囊反搏(intra-aortic balloon pump,IABP)相比 30 天存活率增加33%,但与TandemHeart和Impella辅助泵比较无差异[4]。同样,Romeo等人发现与单用IABP相比,ECMO联合IABP能显著降低院内死亡率[5]。这些发现可能表明接受ECMO的PCS患者有令人接受的院内结果。尽管如此,Ouweneel等人和Romeo等人纳入了相对较少数量的患者,而且没有研究接受ECMO治疗的PCS患者。
院内死亡率相对较高仍是ECMO的弱点。在本研究中,院内死亡率从51%到76%不等,合并的出院死亡率为66.0%,证实了ECMO对三分之一的PCS患者中起到了挽救生命的作用。尽管如此,在大多数纳入研究中,院内死亡率超过了60%。总体而言,尽管设备质量和重症监护管理取得显著进展,但在过去的二十年中,院内死亡率并未明显降低。此外,几项研究表明大约有60%的患者能够成功脱机,但是这些患者中有很大的比例在住院期间死亡[9]。Xie等人表明,ECMO期间的神经系统并发症,下肢缺血及ECMO撤机后的多器官功能衰竭与院内死亡率独立相关[18]。因此,器官并发症可能导致撤机患者的死亡,所以临床中应该努力减少并发症的发生。此外,低存活率也可能是由于患者选择不当或缺乏替代技术。
在以前的许多研究中发现ECMO与高并发症发病率相关[21]。本研究显示,肾衰竭是最常见的并发症,肾储备能力下降以及缺氧和低灌注不耐受可能是PCS患者肾功能衰竭高发的主要原因。ECMO期间的早期肾脏替代治疗可能会降低肾功能衰竭的发生率。出血被认为是应用V-A ECMO心脏术后患者的重要并发症。本研究显示,近一半患者因出血需要二次手术和大量输血,出血可能与V-A ECMO期间肝素化和凝血因子消耗有关。下肢缺血是另一常见并发症。本研究中14%的患者发生下肢缺血。其中1项研究发现,接受股动脉切开ECMO支持的PCS患者与接受经皮股动脉穿刺ECMO支持的患者之间的腿部缺血发生率无显著差异。然而,更多接受股动脉切开ECMO支持的患者接受了远端插管。
最近,许多研究已经建立了死亡率预测模型来预测接受 ECMO治疗 PCS的患者的死亡率[22-24]。SAVE评分模型提示,慢性肾功能衰竭、ECMO开始前机械通气时间较长、ECMO前器官衰竭、ECMO前心脏停搏、先天性心脏病、较低的脉压及较低的血清碳酸氢盐是与死亡率相关的危险因素。ENCOURAGE评分模型发现,年龄>60岁、女性、体质量指数>25 kg/m2、格拉斯哥昏迷评分<6、肌酐>150 μmol/L、乳酸增加和凝血酶原活性<50%是死亡的危险因素。此外,简单评分模型还表明,高乳酸和肾功能障碍是死亡的危险因素。本研究显示,年龄>65岁、糖尿病、术前肾功能不全、肥胖、logistic EuroSCORE>20%、肺部疾病和ECMO前血乳酸增加是接受ECMO治疗的PCS患者的院内死亡风险因素。
本研究有几处局限性。首先,所有符合条件的研究皆为回顾性研究。本研究设计可能有较低的证据水平,较高的选择偏倚风险和报告偏倚。因此,作者评估了纳入的研究的方法学质量,只有6项研究具有较高质量[25]。Egger检验的P值没有显示显著的发表偏倚。其次,所纳入研究的手术术式不同,这可能导致选择性偏倚的风险更大。此外,不同研究中心之间可能存在PCS患者ECMO支持经验的差异。这些因素可能会影响合并的结果。再次,只有5项纳入的患者人数超过100人,本研究中约86%的患者来自这5项研究,结果似乎也取决于这些研究的数据。然而,本研究的作者进行了敏感性分析,证实了结果的稳定性。
总之,本研究表明接受ECMO治疗的PCS患者的短期和中期生存率较低,ECMO并发症的发生率相对较高,应尽可能减少ECMO后并发症的发生率,进行前瞻性研究来确认ECMO对PCS患者的潜在益处。

