长链非编码RNA DANCR在结肠癌组织细胞中表达及其对LOVO细胞侵袭能力的影响
李涛,王江,王舒,朱玄
(1中国医科大学第七临床学院 抚顺矿务局总医院,辽宁抚顺113008;2中国医科大学附属第一医院鞍山医院)
作为消化系统最常见的恶性肿瘤,结肠癌被认作是肿瘤相关死亡的常见原因之一[1]。研究发现,大约一半以上的结肠癌患者最终死于肿瘤的远处转移,尤其是肝转移[2,3]。基质金属蛋白酶9(MMP9)又称明胶酶B,在恶性肿瘤的侵袭和转移中具有重要作用。尽管包括手术、放疗化疗在内的多种治疗手段均不断提高,但结肠癌患者5年生存率依然不高[4]。长链非编码RNA(lncRNA)属于非编码RNA家族,是一类转录本长度200~2 000 nt的非编码RNA。研究发现,lncRNA在肿瘤、炎症、阿尔茨海默病等多种疾病中均发挥了重要作用[5~10]。lncRNA分化拮抗非编码RNA(DANCR)定位于人染色体4q12,在多种肿瘤中扮演了类似于癌基因的角色。目前,关于DANCR在结肠癌中作用的相关研究报道不多。2016年6月~2018年6月,我们观察了DANCR在结肠癌组织细胞中的表达情况及其对结肠癌细胞侵袭能力的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料及试剂
1.1.1 结肠癌组织标本及细胞系来源 收集2016年6月~2018年6月抚顺矿务局总医院医院收治结肠癌患者92例,术中切取的新鲜结肠癌及癌旁组织并立即用液氮保存送检,术后均经病理学检查证实为结肠癌。患者中男44例、女48例,年龄49~73岁,术前均未接收放疗及化疗。本研究经医院医学伦理委员会批准,患者均签署知情同意书。人结肠癌细胞株LOVO、人正常肠上皮细胞株NCM460均购自美国ATCC公司。
1.1.2 主要试剂 RPMI1640培养基、胎牛血清(FBS),购自美国Gibco公司;RNA提取试剂盒、反转录试剂盒、实时荧光定量PCR试剂盒及LipofectamineTM3000转染试剂盒,均购自美国Invitrogen公司;Transwell小室,购自美国Corning公司;BCA蛋白定量试剂盒,购自中国江苏凯基生物技术股份有限公司;PVDF膜,购自美国Merck Millipore公司;MMP9、GAPDH一抗(稀释比率为1∶1 000),购自英国Abcam公司;辣根过氧化物酶标记的羊抗兔二抗(稀释比率为1∶1 000),购自中国江苏凯基生物技术股份有限公司。主要质粒:DANCR沉默质粒si-DANCR及相应的对照质粒si-con,由广州锐博公司设计合成。
1. 2 细胞培养 将NCM460、LOVO细胞接种于RPMI1640培养基(添加10% FBS、100 IU/mL青霉素和100 mg/mL链霉素),置于37 ℃、5% CO2恒温培养箱中培养;待细胞融合率达80%时,以0.25%胰蛋白酶消化并传代。
1.3 组织及细胞中DANCR检测 采用实时荧光定量PCR法。采用TRIzol分别提取组织标及细胞内的总RNA,按照Invitrogen试剂盒说明书逆转录合成cDNA,采用SYBR Green实时荧光定量PCR试剂盒在荧光定量仪上行PCR反应。引物序列:DANCR上游5′-AGTTCTTAGCGCAGGTTGAC-3′,下游5′-AAGGTGAACATGAAGCACCT-3′;β-actin上游5′-AGTGTGACGTGGACATCCGCAAAG-3′,下游5′-ATCCACATCTGCTGGAAGGTGGAC-3′。PCR反应条件: 95 ℃预变性15 s;95 ℃变性5 s,60 ℃退火延伸30 s,共47个循环。以DANCR与β-actin条带灰度的比值计算DANCR相对表达量。根据受试者工作特征曲线分析,将DNACR相对表达量高于截断值为高表达、低于截断值为低表达。
1.4 DANCR沉默对LOVO细胞侵袭能力及MMP9蛋白表达影响的观察
1.4.1 细胞分组与转染处理 取生长状况良好的LOVO细胞,胰酶消化后接种6孔板,调整细胞密度为2×105/孔。将细胞随机分为对照组和沉默组,培养24 h后分别参照LipofectamineTM3000说明书转染si-con质粒及si-DANCR质粒,转染48 h。
1.4.2 细胞DANCR检测 参照1.3,采用qRT-PCR法检测两组转染48 h后的DANCR。
1.4.3 细胞侵袭能力观察 采用Transwell侵袭实验。参照Transwell小室说明书,常规包被底部膜,水化;取转染48 h的两组细胞,调整细胞密度为2×105/mL,接种于Transwell上室中。上室内加入100 μL含10%胎牛血清的DMEM培养基,下室内加入500 μL含20%胎牛血清的DMEM培养基,37 ℃、5%CO2孵育48 h。取出Transwell小室,棉签擦去Transwell小室内部细胞,冲洗、固定、染色后倒置显微镜下计数穿膜细胞数。每组铺6个Transwell小室,取其平均值。
1.4.4 细胞MMP9蛋白检测 采用Western blotting法。取转染48 h的两组细胞,提取细胞总蛋白,BCA试剂盒测定蛋白浓度。取200 μL样品进行SDS-PAGE凝胶电泳,转膜。封闭1 h后,分别加入MMP9一抗或GAPDH一抗,孵育过夜;辣根过氧化物酶标记的羊抗兔二抗,孵育1 h。参照ECL试剂盒说明书行电化学发光检测,采用Quantity One软件分析蛋白条带灰度值,以MMP9与GAPDH蛋白条带灰度比值计算MMP9蛋白相对表达量。
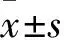
2 结果
2.1 结肠癌组织、细胞中lncRNA DANCR表达情况 结肠癌组织DANCR相对表达量为9.18±1.11(高表达59例、低表达33例),高于癌旁组织中的1.41±0.61(P<0.01)。LOVO细胞DANCR相对表达量为2.29±0.41,高于NCM460细胞的0.37±0.13(P<0.01)。
2.2 不同临床病理特征患者结肠癌组织中DANCR表达比较 临床分期Ⅲ期+Ⅳ期、T分期T3期+T4期、淋巴结转移和远处转移患者结肠癌组织中DANCR高表达率高于临床分期Ⅰ期+Ⅱ期、T分期T1期+T2期、无淋巴结转移和无远处转移者(P均<0.01)。见表1。

表1 不同临床病理特征患者结肠癌组织中DANCR表达比较(例)
2.3 DANCR沉默对LOVO细胞侵袭能力及MMP9蛋白表达的影响 与对照组比较,沉默组细胞DANCR表达降低、穿膜细胞减少、细胞MMP9蛋白表达降低(P均<0.01)。见表2。
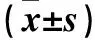
表2 DANCR沉默对LOVO细胞侵袭能力及MMP9蛋白表达的影响
注:与对照组比较,*P<0.01。
3 讨论
越来越多的研究表明,lncRNA在多种细胞生物学行为和过程中均扮演了重要的调控者角色[11]。DANCR又名ANCR,最初发现时被认为是一种促进表皮内未分化细胞状态必须的lncRNA。目前,多项研究表明DANCR广泛参与干细胞分化、细胞增殖、肿瘤恶性表型维持等多种细胞学过程[12~14]。Wang等[15]研究发现,DANCR可作为miR-335-5p及miR-1972的竞争性内源性RNA(ceRNA),促进ROCK1的表达并促进骨肉瘤增殖及侵袭转移。Wang等[16]报道,DANCR能够通过调控miR-758-3p促进非小细胞肺癌细胞SPC-A1和H1299的增殖和侵袭转移。目前,关于DANCR在结肠癌中作用的报道不多。Wang等[17]研究发现,DANCR在结直肠癌细胞中表达增高,下调其表达可抑制热休克蛋白27(HSP27)表达,并抑制其介导的结直肠癌细胞增殖及侵袭转移。本研究发现, DANCR在结肠癌组织中表达高于癌旁组织,在结肠癌细胞LOVO中表达高于正常肠上皮细胞NCM460。这提示DANCR在结肠癌中表达增高,即DANCR存在作为调控结肠癌发生发展癌基因的病理学基础。我们进一步分析结果发现,临床分期Ⅲ期+Ⅳ期、T分期T3期+T4期、淋巴结转移和远处转移患者结肠癌组织中DANCR高表达率高于临床分期Ⅰ期+Ⅱ期、T分期T1期+T2期、无淋巴结转移和无远处转移者,进一步表明DANCR在结肠癌中扮演了类似于癌基因的角色。
结肠癌是一类高致死率的恶性肿瘤,很大一部分患者死于原发肿瘤的远处转移[18,19]。在确诊结肠癌时,约10%的患者即已出现肝转移或肺转移[20]。既往研究发现,MMP9作为肿瘤侵袭转移的标志性蛋白,在结肠癌等多种肿瘤中表达增高,并且与患者不良预后密切相关[21~25]。Yang等[25]报道,MMP9在结直肠癌患者中高表达,且高表达的MMP9与肿瘤的深层侵袭、淋巴结转移及更高的TNM分期密切相关。在本研究中,我们同样关注了DANCR对结肠癌细胞LOVO侵袭能力以及MMP9表达的影响。我们通过RNA干扰的方式,下调DANCR在LOVO细胞中的表达,并通过qRT-PCR进行确认;同时,我们通过Transwell侵袭实验检测了不同DANCR表达水平对LOVO细胞侵袭能力的影响。结果显示,相比于对照组,沉默组LOVO细胞的侵袭能力明显降低,细胞内MMP9蛋白表达减少。这表明DANCR能够提高结肠癌细胞LOVO的侵袭能力,并促进侵袭转移相关蛋白MMP9的表达。
综上所述,lncRNA DANCR在结肠癌组织和细胞中表达增高,DANCR在结肠癌的发生发展过程中起到了癌基因的角色,DANCR能够促进结肠癌侵袭转移。结肠癌的侵袭转移是一个涉及多通路、多因子、多机制的复杂的生物学行为过程,本研究仅仅初步探讨了DANCR在结肠癌中表达及其对结肠癌细胞株LOVO侵袭能力的影响,长链非编码RNA的作用机制极为复杂,我们仅初步考察了DANCR对侵袭转移标志性蛋白MMP9表达的影响,具体作用机制仍需进一步深入研究。

