原发性肝癌精准肝切除术临床效果观察及患者血清miR-199a/b-3p水平变化
张树彬,吕海涛,刘三光,王文斌,段佳悦,刘建华
(河北医科大学第二医院,石家庄050000)
原发性肝癌(简称肝癌)发病早期无明显症状,多数患者确诊时已为中晚期,预后差,病死率较高。肝癌切除术是目前治疗肝癌的主要手段,由于部分肝癌体积较大,会压迫周围重要脉管结构,增加切除困难,术中出血风险高、术后并发症多,患者预后较差[1,2]。精准肝切除术能在彻底清除目标病灶的同时,保障剩余肝脏解剖结构的功能性与完整性体积最大化,尽可能控制全身性创伤侵袭与手术出血[3]。miR-199a/b-3p是一种微小RAN(miRNA),其血清水平可用于肝癌的诊断及预后评估[4]。2014年4月~2017年2月,我们观察了肝癌精准肝切除术的临床效果,以及手术前后血清miR-199a/b-3p水平变化,旨在进一步为精准肝切除术的临床应用提供依据。
1 资料与方法
1.1 临床资料 收集同期河北医科大学第二医院收治的肝癌患者。纳入标准:①符合《原发性肝癌诊疗规范》[5]关于肝癌的相关诊断标准;②年龄≤75岁;③术前未接受化疗等抗肿瘤治疗;④Child-Pugh分级为A级;⑤术前血糖、血压稳定;⑥自愿加入本次研究,并签署知情同意书。排除标准:①合并严重的器官功能障碍;②凝血功能异常;③术前肝功能检查有异常者;④门静脉肉眼癌栓;⑤转移性肿瘤。共选择肝癌患者108例,按随机数字表法分为两组各54例。观察组男38例、女16例,年龄(56.28±8.91)岁,肿瘤直径(6.95±1.28)cm。对照组男40例、女14例,年龄(56.31±8.93)岁,肿瘤直径(7.01±1.31)cm。本研究经医院医学伦理委员会批准,两组性别、年龄、肿瘤直径具有可比性。
1.2 手术治疗方法 两组术前均行CT、B超等探查肿瘤的位置、大小、有无包膜等情况,且手术均在全麻下实施。①观察组实施精准肝切除术:术前用3D虚拟规划技术重建肝脏模型,观察肿瘤位置、大小、与周围解剖结构的关系,预测肝切除体积,计算机模拟规划最佳手术方案。手术体位取平卧位,于右侧肋缘下切口进腹,探查肝脏有无明显硬化、质地、有无肝门部淋巴结肿大以及腹腔积液等情况。采用B超探查肿瘤位置、大小、与周围重要管道的关系。手术预切线,根据术前3D规划结果与B超探查结果确定;对部分行半肝切除或肝断切除者,以B超对肝段血管探查,以明确预切线位置。将病灶所在肝断的肝动脉与门静脉分支行选择性阻断,见明确的肝断分界线后,离断肝实质(沿分界线);确保将肿瘤完全切除,并尽可能避免损伤周围脉管结构的功能与完整性。或术中在B超的引导下,经门静脉导管注入染色剂亚甲蓝行肝断染色,根据其结果实施精确解剖性肝断切除。若病灶位置特殊或体积太大需行半肝切除,则需游离肝周韧带;解剖出第一、二、三肝门,对第一肝门的门静脉右支和肝右动脉行选择性阻断;将左、右半肝缺血线显露后,以术中B超对肝中静脉位置探查,确认在其右侧或左侧以电刀标记肝切除线;将肝实质离断,使肝中静脉显露,实施精细解剖性肝切除。一般按缺血线以超声吸引刀或超声刀,并配合钳夹法对肿瘤组织游离,将肝实质离断。对管道以4-0 Prolene线缝扎或结扎,贴敷止血沙布。肿瘤切除后,以氩气喷凝于断面,无需实施对拢缝合;确认无胆汁漏、活动性出血后关腹,尽可能不放置引流管。②对照组实施传统肝切除术:手术体位取平卧位,于右侧肋缘下切口进腹,探查肝脏有无明显硬化、质地、有无肝门部淋巴结肿大以及腹腔积液等情况。游离肝周围韧带,阻断肝门(以Prigle入肝血流阻断法),电刀在距离肿瘤边界1~2 cm位置标记预切线;将肝实质以钳夹法离断,并缝扎或结扎血管、胆管;断面充分止血后,对拢缝合,将引流管置入后关腹。两组术后均常规禁食水,常规抑酸、化痰、保肝等治疗。
1.3 手术效果观察及血清miR-199a/b-3p检测方法 记录两组手术情况,包括肝门阻断率、手术时间、术中出血量、术后住院时间、总住院费用。分别于术前、术后5 d检测肝功能,包括 ALT、TBIL、AST、ALB。分别于术前、术后5 d取空腹外周静脉血4 mL,4 ℃下离心取上清液,采用实时定量PCR法检测miR-199a/b-3p,内参用U6,以miRNA相对表达量为2-ΔΔCt计算miR-199a/b-3p相对表达量。观察术后并发症发生情况,术后随访1年记录复发情况,复发标准:术后AFP正常单1年后AFP快速升高,无药物性或肝脏介入性肝损伤或乙肝病毒发作、影像学检查发现肝内或肝外有新生肿瘤病灶。

2 结果
2.1 两组手术情况比较 观察组和对照组肝门阻断率分别为31.48%(17/54)、51.85%(28/54),观察组肝门阻断率低于对照组(P<0.05)。对照组术中出血量、术后住院时间和总住院费用均高于观察组,手术时间短于观察组(P均<0.05)。见表1。
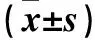
表1 两组术中出血量、手术时间、术后住院时间和总住院费用比较
注:与对照组比较,*P<0.05。
2.2 两组肝功能比较 术前,两组肝功能指标差异无统计学意义;术后,两组ALT、TBIL、AST升高而ALB降低,且观察组ALT、TBIL、AST低于对照组而ALB水平高于对照(P均<0.05)。见表2。
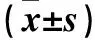
表2 两组肝功能比较
注:与同组术前比较,*P<0.05;与对照组术后比较,#P<0.05。
2.3 两组血清miR-199a/b-3p水平比较 术前两组血清miR-199a/b-3p水平比较差异无统计学意义;术后两组血清miR-199a/b-3p水平均较术前升高(P均<0.05),且观察组高于对照组(P<0.05)。见表3。
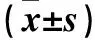
表3 两组血清miR-199a/b-3p水平比较
注:与同组术前比较,*P<0.05;与对照组术后比较,#P<0.05。
2.4 两组术后并发症与复发情况比较 观察组术后并发腹水3例、胆漏0例、肺部感染1例、肝功能衰竭0例、切口感染2例,术后并发症发生率为11.1%;对照组分别为5、1、3、1、4例,术后并发症发生率为25.93%;观察组术后并发症发生率高于对照组(P<0.05)。观察组术后1年复发14例(25.93%),对照组复发23例(42.59%),观察组复发率低于对照组(P<0.05)。
3 讨论
外科手术是治疗肝癌的重要手段,包括肝切除术和肝移植术,其中以肝切除术较为常规。传统肝切除术对肿瘤直径≤3 cm的小肝癌患者治疗,可使患者获得长期的生存;但对肿瘤直径>5 cm的大肝癌,因肝功能储备差,常合并肝硬化、术后肝容量小等,手术危险性或手术难度均大于小肝癌的治疗[6,7]。
本研究中,对照组肝门阻断率、术中出血量、术后住院时间、总住院费用、并发症发生率与复发率均高于观察组,且肝功能损害程度高于观察组,提示精准肝切除术治疗效果优于传统肝切除术。对照组手术时间短于观察组,这与观察组术中解剖肝门、行B超探查等操作有关。
miRNA具有多相性,可对生物体的功能与基因表达控制,一旦其表达水平异常,则会引起疾病的发生。miRNA可调节细胞的分化、增殖与凋亡,多聚集在与肿瘤相关的脆性位点和部分基因多变取,其异常表达与肿瘤的发生、侵袭转移、复发、细胞黏附以及血管生成等关系密切[8~10]。miR-199a/b-3p为一种抑癌基因,与正常组织相比,其在肝癌组织中miR-199a/b-3p表达水平明显降低,其降低幅度与患者的总生存率与无瘤生存期关系密切。miR-199a/b-3p对PAK4具有靶向抑制作用,通过PAK4/Raf/MEK/ERK信号通路对下游的ERK表达起到抑制作用,进而抑制肝细胞的增殖与生长[11~13]。本研究中,对照组血清miR-199a/b-3p水平低于观察组,提示精准肝切除术能有效改善miR-199a/b-3p水平,促进患者预后恢复。
精准肝切除的技术体系和理念涵盖了外科治疗的手术规划、术前评估、术中操作、术后管理等全过程。术前在常规评估的基础上,采用3D虚拟手术规划系统对肝脏剩余功能进行评估,可防止因切除体积过大而造成剩余肝功能衰竭等情况的发生。精准肝切除术中重建肝脏三维模型,医生可直观地观察肿瘤大小、位置以及与周围毗邻节后的关系等,确认门静脉、肝后下腔静脉、胆管等重要的脉管结构是否受到肿瘤侵袭,提前了解肿瘤供血血管,模拟术中场景,术中可能损伤或需要离断的血管,评估术中可能遇见的解剖结构[14]。因大肝癌患者肿瘤体积较大,一般需行右三叶或左三叶、半肝切除。精准肝切除术中在常规手术操作外,对第一、二、三肝门行精准解剖,能将重要脉管结构骨骼化,利于实施针对性的肝血流阻断,无需行传统的Pringle肝血流阻断。Pringle法对入肝血流行阻断时,可损害残余肝功能,血流恢复后,会损伤肝脏缺血再灌注,延缓患者术后肝功能的恢复[15]。提前离断术中无需保留血管,能防止术中对肿瘤的反复挤压造成其医源性扩散,降低术后肿瘤转移的风险。
综上所述,对肝癌患者行精准肝切除术治疗效果显著,可有效减少术中出血量,降低肝门阻断率、并发症发生率、复发率,可改善血清miR-199a/b-3p水平,减轻肝功能损害,术后恢复快,减轻患者经济负担。

