沉默HIF-1α表达对缺氧环境下胃癌细胞GLUT-1、PKM2表达的影响
舍玲,丁永年,彭媛媛,白洁,梁灿灿
(新疆医科大学第二附属医院,乌鲁木齐830063)
由于肿瘤组织血管生长异常、血流灌注不足及肿瘤细胞快速增殖消耗大量氧气,因此肿瘤细胞内普遍缺氧。在缺氧环境下,肿瘤细胞选择开启糖酵解代谢形式,快速产生大量ATP供能,这一现象称为Warburg效应[1]。缺氧诱导因子1α(HIF-1α)是调节缺氧水平的主要转录因子[2]。研究表明,HIF-1α、M2型丙酮酸激酶(PKM2)[3]、葡萄糖载体蛋白1(GLUT-1)[4]是肿瘤细胞Warburg效应的重要调控因子。2016年6月~2018年1月,我们检测了缺氧条件及RNA干扰技术沉默HIF-1α后胃癌细胞内HIF-1α、GLUT-1、PKM2表达的情况,探讨HIF-1α与GLUT-1、PKM2的关系。
1 材料与方法
1.1 细胞、试剂与仪器 胃癌BGC-823细胞、兔抗人HIF-1α多克隆抗体、兔抗人PKM2多克隆抗体、兔抗人GLUT-1多克隆抗体、羊抗兔IgG二抗、氯化钴(CoCl2)购自武汉博士德公司;GAPDH抗体、HIF-1α siRNA、Control siRNA购自美国Santa Cruz公司;蛋白提取试剂盒、蛋白检测试剂盒购自中国凯基生物公司;转染试剂LipofectamineTM2000购自美国Thermo公司;SYBR Green荧光实时定量PCR试剂盒购自美国Life Technologies公司;RPMI1640培养液购自美国Hyclone公司;胎牛血清购自杭州四季青生物有限公司。荧光定量PCR仪、蛋白质电泳仪、全能型成像分析系统、紫外分光光度计等购自美国Bio-Rad公司,细胞培养箱购自美国Thermo公司。
1.2 细胞分组与干预 向胃癌细胞中加入含10%胎牛血清的RPMI1640培养液,置于37 ℃、5% CO2培养箱中传代培养。取对数生长期细胞,接种于6孔板,待细胞贴壁后分为正常组、缺氧对照组、转染HIF-1α siRNA组和转染对照组。正常组、缺氧对照组不进行转染处理,转染HIF-1α siRNA组和转染对照组使用LipofectamineTM2000进行转染操作,分别转入HIF-1α siRNA、Control siRNA。转染48 h后,转染HIF-1α siRNA组、转染对照组、缺氧对照组加入终浓度为200 μmol/L的CoCl2建立缺氧环境,置于37 ℃、5% CO2培养箱中传代培养12 h;正常组置于37 ℃、5% CO2培养箱中培养12 h。
1.3 细胞HIF-1α、GLUT-1、PKM2 mRNA表达检测 采用实时荧光定量PCR法。收集各组细胞,提取细胞总RNA,逆转录合成cDNA。以GAPDH为内参照,于实时荧光定量PCR仪进行反应。引物序列:HIF-1α上游5′-TGCAACATGGAAGGTATTGC-3′,下游5′-TTCACAAATCAGCACCAAGC-3′;GLUT-1上游5′-ACAACCAGACATGGGTCCAC-3′,下游5′-TAACGAAAAGGCCCACAGAG-3′;PKM2上游5′-AGAACATCCTGTGGCTGGAC-3′,下游5′-ACCTTTCTGCTTCACCTGGA-3′;GAPDH上游5′-CAGGAGGCATTGCTGATGAT-3′,下游5′-GAAGGCTGGGGCTCATTT-3′。反应条件:50 ℃ 2 min,95 ℃ 2 min预变性;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,40个循环。测得各组Ct值,绘制标准曲线,实验重复3次,用2-ΔΔCt方法计算目的基因的相对表达量。
1.4 细胞HIF-1α、GLUT-1、PKM2蛋白表达检测 采用Western blotting法。收集各组细胞,提取细胞总蛋白,测定蛋白浓度。取25 μg总蛋白,经10%的SDS-PAGE胶进行电泳,电转移至PVDF膜,以5%脱脂奶粉封闭。加入一抗(HIF-1α、PKM2、GLUT-1以1∶200稀释,GAPDH以1∶1 000稀释),4 ℃孵育过夜。TBST清洗,加入HPR标记的羊抗兔二抗(以1∶2 000稀释),室温孵育1 h,TBST清洗。用ECL发光法显色,Bio-Rad Chemi DOC MP全能型成像分析系统摄取图像,分析图形灰度值。
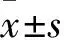
2 结果
2.1 各组HIF-1α、GLUT-1、PKM2 mRNA表达比较 与正常组比较,缺氧对照组HIF-1α mRNA表达无明显变化(P>0.05),GLUT-1、PKM2 mRNA表达均升高(P<0.05或<0.01);与缺氧对照组比较,转染HIF-1α siRNA组HIF-1α、GLUT-1、PKM2 mRNA表达均降低(P均<0.01),转染对照组HIF-1α、GLUT-1、PKM2 mRNA表达无明显变化(P均>0.05);与转染对照组比较,转染HIF-1α siRNA组HIF-1α、GLUT-1、PKM2 mRNA表达均降低(P<0.05或<0.01)。见表1。
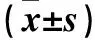
表1 各组HIF-1α、GLUT-1、PKM2 mRNA表达比较
注:与正常组比较,*P<0.05,**P<0.01;与缺氧对照组比较,#P<0.01;与转染对照组比较,△P<0.05,△△P<0.01。
2.2 各组HIF-1α、GLUT-1、PKM2蛋白表达比较 与正常组比较,缺氧对照组HIF-1α、GLUT-1、PKM2蛋白表达均升高(P均<0.01);与缺氧对照组比较,转染HIF-1α siRNA组HIF-1α、GLUT-1、PKM2蛋白表达均降低(P<0.05或<0.01),转染对照组HIF-1α、GLUT-1、PKM2蛋白表达无明显变化(P均>0.05);与转染对照组比较,转染HIF-1α siRNA组HIF-1α、GLUT-1、PKM2蛋白表达均降低(P<0.05或<0.01)。见表2。
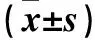
表2 各组HIF-1α、GLUT-1、PKM2蛋白表达比较
注:与正常组比较,*P<0.01;与缺氧对照组比较,#P<0.05,##P<0.01;与转染对照组比较,△P<0.05,△△P<0.01。
3 讨论
肿瘤组织血管生长异常、血流灌注不足以及肿瘤细胞快速增殖消耗大量氧气,导致组织缺氧;为适应缺氧,肿瘤细胞通过激活上调缺氧诱导因子(HIF),进而调节其下游多种调控因子如能量代谢相关因子GLUT-1、PKM2等,促进肿瘤无氧糖酵解(即Warburg效应)。研究显示,胃癌组织中HIF-1α、GLUT-1、PKM2表达升高,三者共同促进胃癌细胞Warburg效应,在肿瘤的增殖、耐药、转移、预后等过程中起重要作用。本研究通过探索HIF-1α在调控胃癌能量代谢过程中的作用机制,旨在为胃癌的治疗提供分子靶标。
HIF-1α是调节缺氧水平的主要转录因子。在常氧状态下HIF-1α会迅速降解;在低氧状态下HIF-1α会持续稳定表达,不断积聚,然后移至细胞核,与核内HIF-1β结合,形成二聚体HIF-1[2]。研究表明,HIF-1α高表达不仅是反映胃癌组织缺氧的重要指标,而且在胃癌增殖、转移、预后等过程中也具有重要作用[5,6]。GLUT-1是人体内分布最广泛的葡萄糖转运体,HIF-1α介导的GLUT-1高表达不仅导致糖代谢途径能量的物质转运和生成增强,还可增强细胞内化疗药物外排,增强细胞耐药[7,8]。GLUT-1已被确定为是缺氧的标志之一,其在肿瘤糖代谢过程中所引起的恶性表型中起重要作用。研究表明,GLUT-1表达与胃癌临床分期、浸润深度、淋巴结转移相关,胃癌组织中HIF-1α与GLUT-1表达呈正相关[9]。PKM2在糖酵解途径中催化磷酸烯醇丙酮酸和ADP转化为丙酮酸和ATP[10]。研究显示,PKM2在多种类型的肿瘤细胞中高表达,并明显增强肿瘤的Warburg效应,促进肿瘤的快速生长;而反过来敲除PKM2后可以降低Warburg效应,抑制肿瘤快速生长。在胃癌组织中,PKM2高表达与肿瘤分期、淋巴转移、预后差显著相关[11,12]。研究发现,HIF-1α通过脯氨酰羟化酶3(PHD3)[10]、双加氧酶(JMJD5)[13]、表皮生长因子受体(EGFR)[14]等基因调控PKM2,促进肿瘤细胞PKM2高表达。
本研究结果显示,与正常组比较,胃癌细胞缺氧后HIF-1α mRNA无明显变化,蛋白增加,提示缺氧主要在翻译水平影响HIF-1α表达。而GLUT-1、PKM2 mRNA及蛋白均增高,提示缺氧条件下HIF-1α被活化,在转录及翻译水平均诱导GLUT-1、PKM2高表达,共同促进Warburg效应。与缺氧对照组比较,转染HIF-1α siRNA后HIF-1α、GLUT-1、PKM2 mRNA及蛋白均降低,而转染Control siRNA后HIF-1α、GLUT-1、PKM2 mRNA及蛋白均无明显变化,表明HIF-1α siRNA能有效沉默BGC-823细胞中的HIF-1α,进而减少下游靶基GLUT-1、PKM2表达,进一步证实HIF-1α对GLUT-1、PKM2有调控作用。与转染对照组比较,转染HIF-1α siRNA组HIF-1α、GLUT-1、PKM2 mRNA及蛋白均降低,两者对比表明,转染HIF-1α siRNA组的实验效果可。
综上所述,在缺氧环境下,胃癌细胞中HIF-1α表达升高,并通过促进下游GLUT-1、PKM2表达,为胃癌增殖、转移提供大量及快速的能量供给,三者在促进肿瘤代谢方面起重要作用。本研究为以HIF-1α、GLUT-1、PKM2为靶点的基因治疗提供了一定的依据。肿瘤细胞异常能量代谢方式与肿瘤细胞的恶性表型与治疗耐药密切相关[15],故靶向抑制恶性肿瘤共有的代谢途径,使用化疗联合细胞代谢抑制剂的治疗是抵抗肿瘤增殖、耐药、转移的一种有前景的治疗方式。

