分化型甲状腺癌术后 TSH抑制治疗对骨代谢的影响
邱海江 罗钧刚 方孙阳 夏恒
分化型甲状腺癌(DTC)术后促甲状腺激素(TSH)抑制治疗是分化型甲状腺癌内分泌治疗的常规治疗方法。根据患者的肿瘤复发危险分层给予超过生理剂量的左旋甲状腺素(LT4),通过负反馈作用抑制TSH的生成,从而减少患者的远期复发风险。TSH抑制治疗可以引起患者骨质代谢的改变,近年来国内外有较多研究。本文探讨DTC术后 TSH 抑制治疗对患者骨密度的影响。
1 资料与方法
1.1 临床资料 选取2013年6月至2015年6月本院DTC术后TSH抑制治疗患者150例,纳入标准:(1)根据诊治指南行甲状腺癌手术方式;(2)病理证实为分化型甲状腺癌;(3)根据肿瘤复发危险分层,口服左甲状腺素片抑制治疗;(4)术后甲状旁腺功能正常;(5)家庭、生活习惯及营养状况良好;(6)无引起骨密度减低的疾病史及药物史;(7)患者知情同意并通过医院伦理委员会批准。退出标准:(1)出现淋巴结、对侧或远处转移行再次手术;(2)不能耐受大剂量左甲状腺素抑制治疗引起的心血管系统症状;(3)治疗随访期间失访;(4)患者自行加服补钙剂;(5)治疗随访期间发现其他影响骨代谢的疾病;(6)不配合定期复查甲状腺功能或检测骨密度;(7)术前已存在骨质疏松症患者;(8)治疗期间出现绝经。其中男30例,平均年龄(45.3±3.2)岁,中、高危组24例,低危组6例;女120例,绝经前患者82例,平均年龄(43.5±5.2)岁,低危组28例,中、高危组54例;绝经后患者38例,平均年龄(55.7±4.5)岁,低危组10例,中、高危组28例。
1.2 方法 根据患者肿瘤复发危险分层因素中国指南[1],32例为低危患者,TSH控制在0.1~0.5mU/L。118例为中、高危患者,TSH<0.1mU/L,当TSH达标后,术后第1、2年3个月检测甲状腺功能、第3年开始6个月检测甲状腺功能。另分别于术前、术后1年、术后2年,术后3年分别测定股骨颈、髋关节及正位腰椎(L2、L4)的骨密度(BMD)。诊断标准根据世界卫生组织(WHO)推荐的骨质疏松诊断标准[2],T值是检测值与健康成人BMD峰值比较的标准差,所测部位的T值≤同年龄人群参考值2.5个标准差判定为骨质疏松;低于同年龄人群参考值1.0~2.5个标准差判定为骨量减少。
1.3 统计学方法 采用SSPS19. 0 统计软件进行分析。计量资料以(±s)表示,组内比较用配对t检验,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 男性DTC患者不同时间点各检测部位BMD比较 见表1、2。
表1 男性低危组TSH 抑制治疗后骨密度的变化[g/cm2,(±s)]
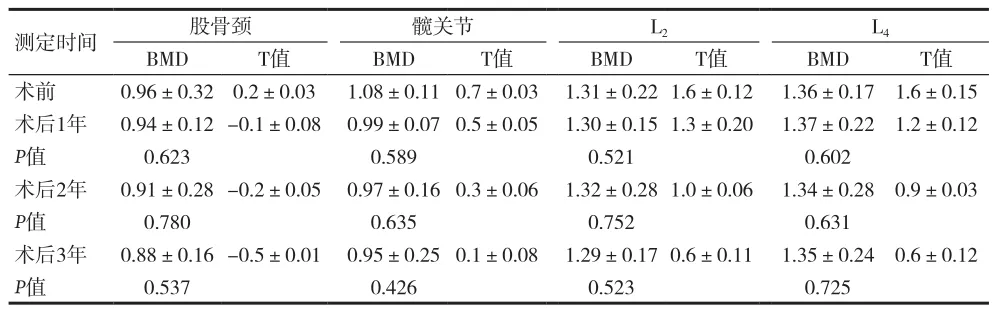
表1 男性低危组TSH 抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.96±0.32 0.2±0.03 1.08±0.11 0.7±0.03 1.31±0.22 1.6±0.12 1.36±0.17 1.6±0.15术后1年 0.94±0.12-0.1±0.08 0.99±0.07 0.5±0.05 1.30±0.15 1.3±0.20 1.37±0.22 1.2±0.12 P值 0.623 0.589 0.521 0.602术后2年 0.91±0.28-0.2±0.05 0.97±0.16 0.3±0.06 1.32±0.28 1.0±0.06 1.34±0.28 0.9±0.03 P值 0.780 0.635 0.752 0.631术后3年 0.88±0.16-0.5±0.01 0.95±0.25 0.1±0.08 1.29±0.17 0.6±0.11 1.35±0.24 0.6±0.12 P值 0.537 0.426 0.523 0.725
表2 男性高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
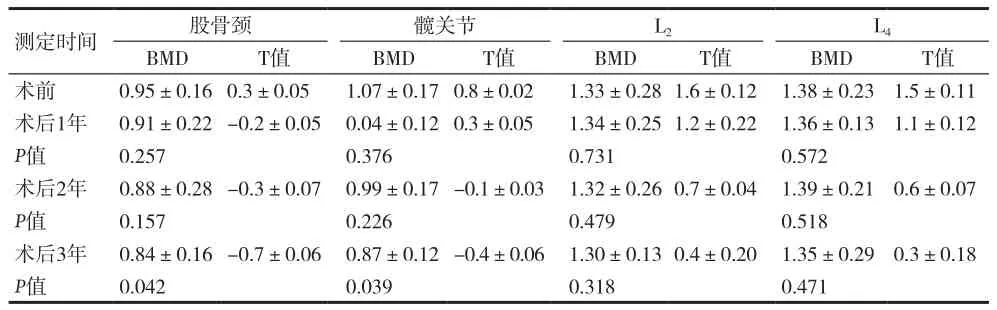
表2 男性高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.95±0.16 0.3±0.05 1.07±0.17 0.8±0.02 1.33±0.28 1.6±0.12 1.38±0.23 1.5±0.11术后1年 0.91±0.22-0.2±0.05 0.04±0.12 0.3±0.05 1.34±0.25 1.2±0.22 1.36±0.13 1.1±0.12 P值 0.257 0.376 0.731 0.572术后2年 0.88±0.28-0.3±0.07 0.99±0.17-0.1±0.03 1.32±0.26 0.7±0.04 1.39±0.21 0.6±0.07 P值 0.157 0.226 0.479 0.518术后3年 0.84±0.16-0.7±0.06 0.87±0.12-0.4±0.06 1.30±0.13 0.4±0.20 1.35±0.29 0.3±0.18 P值 0.042 0.039 0.318 0.471
2.3 女性绝经前DTC患者不同时间点各检测部位BMD比较 见表3、4。
表3 绝经前DTC低危组TSH 抑制治疗后骨密度的变化[g/cm2,(±s)]
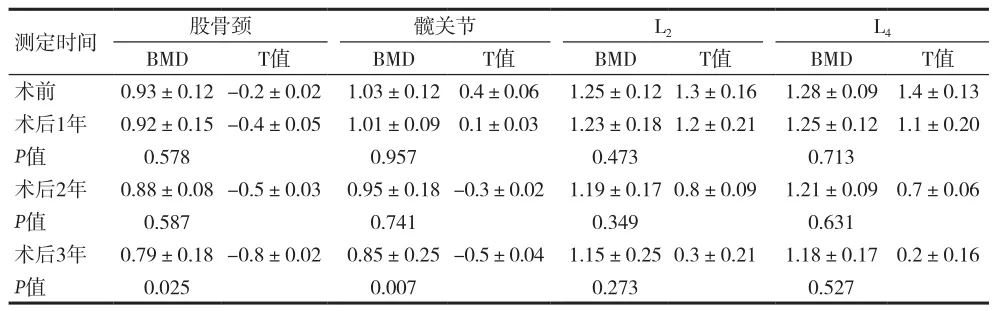
表3 绝经前DTC低危组TSH 抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.93±0.12-0.2±0.02 1.03±0.12 0.4±0.06 1.25±0.12 1.3±0.16 1.28±0.09 1.4±0.13术后1年 0.92±0.15-0.4±0.05 1.01±0.09 0.1±0.03 1.23±0.18 1.2±0.21 1.25±0.12 1.1±0.20 P值 0.578 0.957 0.473 0.713术后2年 0.88±0.08-0.5±0.03 0.95±0.18-0.3±0.02 1.19±0.17 0.8±0.09 1.21±0.09 0.7±0.06 P值 0.587 0.741 0.349 0.631术后3年 0.79±0.18-0.8±0.02 0.85±0.25-0.5±0.04 1.15±0.25 0.3±0.21 1.18±0.17 0.2±0.16 P值 0.025 0.007 0.273 0.527
表4 绝经前DTC中、高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
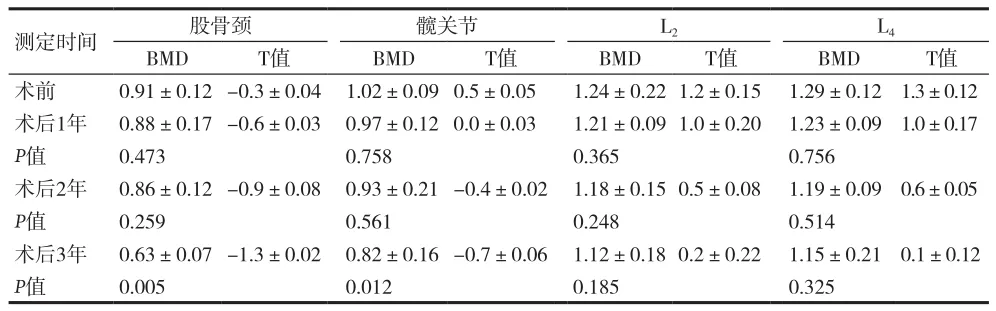
表4 绝经前DTC中、高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.91±0.12-0.3±0.04 1.02±0.09 0.5±0.05 1.24±0.22 1.2±0.15 1.29±0.12 1.3±0.12术后1年 0.88±0.17-0.6±0.03 0.97±0.12 0.0±0.03 1.21±0.09 1.0±0.20 1.23±0.09 1.0±0.17 P值 0.473 0.758 0.365 0.756术后2年 0.86±0.12-0.9±0.08 0.93±0.21-0.4±0.02 1.18±0.15 0.5±0.08 1.19±0.09 0.6±0.05 P值 0.259 0.561 0.248 0.514术后3年 0.63±0.07-1.3±0.02 0.82±0.16-0.7±0.06 1.12±0.18 0.2±0.22 1.15±0.21 0.1±0.12 P值 0.005 0.012 0.185 0.325
2.4 绝经后女性DTC患者不同时间点各检测部位BMD比较 见表5、6。
表5 绝经后低危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
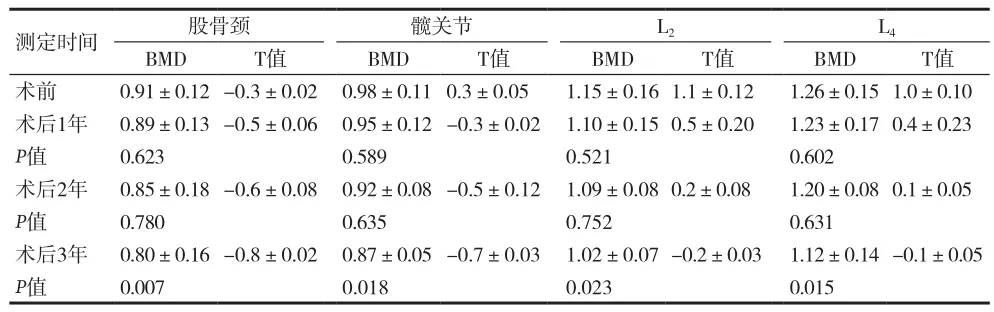
表5 绝经后低危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.91±0.12-0.3±0.02 0.98±0.11 0.3±0.05 1.15±0.16 1.1±0.12 1.26±0.15 1.0±0.10术后1年 0.89±0.13-0.5±0.06 0.95±0.12-0.3±0.02 1.10±0.15 0.5±0.20 1.23±0.17 0.4±0.23 P值 0.623 0.589 0.521 0.602术后2年 0.85±0.18-0.6±0.08 0.92±0.08-0.5±0.12 1.09±0.08 0.2±0.08 1.20±0.08 0.1±0.05 P值 0.780 0.635 0.752 0.631术后3年 0.80±0.16-0.8±0.02 0.87±0.05-0.7±0.03 1.02±0.07-0.2±0.03 1.12±0.14-0.1±0.05 P值 0.007 0.018 0.023 0.015
表6 绝经后中、高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]

表6 绝经后中、高危组TSH抑制治疗后骨密度的变化[g/cm2,(±s)]
测定时间 股骨颈 髋关节 L2 L4 BMD T值 BMD T值 BMD T值 BMD T值术前 0.92±0.21-0.1±0.03 0.97±0.18 0.4±0.06 1.13±0.09 1.0±0.16 1.27±0.13 1.1±0.12术后1年 0.88±0.09-0.5±0.05 0.95±0.15-0.2±0.03 1.08±0.12 0.7±0.21 1.24±0.16 0.6±0.20 P值 0.653 0.389 0.561 0.302术后2年 0.80±0.08-1.3±0.03 0.82±0.13-0.5±0.02 1.05±0.16 0.2±0.09 1.19±0.11 0.2±0.06 P值 0.028 0.016 0.320 0.308术后3年 0.68±0.16-2.9±0.08 0.73±0.03-1.3±0.05 1.00±0.13-0.2±0.03 1.10±0.17-0.4±0.05 P值 0.000 0.006 0.017 0.008
3 讨论
DTC是最常见的甲状腺恶性肿瘤,甲状腺切除、131I治疗和长期TSH抑制治疗是目前DTC的主要治疗手段。TSH主要通过作用于TSH受体(TSHR),形成配体-受体复合物,从而能激活TSHR与G蛋白偶联后,激活细胞内cAMP信号通路,从而刺激癌细胞的生长[3]。Mazzaferri等研究1528例DTC患者显示,初治后40年内复发率约35%,其中2/3发生在初治后10年内[4]。因此,DTC患者在术后及时给予TSH抑制治疗是避免肿瘤复发和转移,降低病死率的重要措施。临床研究证实TSH抑制水平与DTC的复发、转移和癌症相关死亡密切相关。Mazzaferri等[4]研究显示TSH抑制治疗可使肿瘤直径≥1.5cm的DTC患者术后复发率显著降低,最高降幅达18%。Mc Griff NJ等研究发现TSH抑制治疗使 DTC 患者复发和死亡风险下降27%,显著提高 DTC 患者的总体生存率[5]。Jonklaas研究11个中心参与的登记显示,TSH抑制治疗总体生存时间显著延长[6]。
尽管TSH 抑制治疗的作用已得到公认,但长期TSH抑制治疗可导致患者机体内环境发生变化,打破成骨细胞和破骨细胞的动态平衡,干扰骨代谢的过程,随着治疗时间的增加,使部分患者骨密度受影响。Abe等研究发现,TSH对骨密度的影响通过TSHR介导,成骨细胞与破骨细胞均可表达TSHR,TSHR的减少可导致骨质疏松症的发生。相反,TSHR的过度表达可抑制破骨细胞的生成[7]。同时,Abe研究发现TSH可以通过RANK-L的JNK/C-jun和NF-KB信号通路抑制破骨细胞的形成和存活,TSH抑制治疗后,对破骨细胞的形成和存活抑制作用减弱,从而影响骨密度[7]。另有研究证实,肿瘤坏死因子-α(TNF-α)与骨密度呈负相关。TSH通过促使高迁移率蛋白1(HMGB1)及高迁移率蛋白2(HMGB2)与TNF-α基因启动因子结合抑制TNF-α的生成[8]。
有研究报道TSH抑制治疗不会对男性患者的骨密度造成明显的影响[9]。本资料显示,与术前相比,低危组男性患者TSH 抑制治疗后各检测时间点各检测部位的BMD无改变,不会对男性患者的骨密度产生影响。中、高危组患者,TSH抑制治疗后1年、2年,各检测部位的BMD无改变,术后3年腰椎(L2、L4)BMD无改变,股骨颈、髋关节BMD检测示骨量减少,提示随着TSH抑制程度和抑制时间的不同,对机体不同部位的骨密度的影响存在一定的差异,对股骨颈、髋关节影响较高。这是由于股骨颈及髋关节处以皮质骨为主,腰椎以松质骨为主,皮质骨中破骨细胞较松质骨活跃,受甲状腺激素影响更明显[10]。
有研究表明,绝经前妇女行TSH抑制治疗平均6.5年后,出现术后骨质疏松的风险增加4倍[11]。而另外一项研究发现,绝经前妇女行TSH抑制治疗平均5.6年后,脊椎、股骨颈Ward三角处的骨密度未见差异[12]。其他横向研究中,也并未发现 TSH抑制治疗对绝经前女性患者的骨密度造成明显影响[13]。本资料显示,与术前比较,不同水平的TSH抑制,不会减少腰椎(L2、L4)的BMD,但3年后能减少股骨颈、髋关节的BMD,尤其是中、高危患者,TSH抑制治疗对股骨颈BMD影响较低危患者更显著。本资料显示,TSH水平与时间存在交互作用,推测接受越长时间的TSH抑制治疗,绝经前女性DTC患者股骨颈、髋关节的BMD下降情况会越明显,尤其对于女性中、高危患者,会引起骨质疏松,随访过程中要密切关注风险,定期监测患者的骨密度,并采取合适的干预措施。
有研究表明TSH抑制治疗对绝经后女性骨密度影响较为明显[14]。一方面,绝经后女性运动能力下降,骨骼重建速率下降;另一方面,性激素的变化,尤其是雌激素分泌减少,垂体分泌的FSH会代偿性增加,改变骨代谢的平衡。Sowers MR等研究表明FSH可以通过与破骨细胞的卵泡刺激素受体结合直接促进其生长及活动,进而促进骨吸收。同时,FSH还会释放破骨细胞生长因子IL-1β、TNFα,间接的促进破骨细胞的生长,降低BMD[15]。本资料显示,TSH抑制治疗对绝经后女性影响较绝经前女性明显增加,无论TSH抑制水平高低,其骨量丢失情况远比绝经前的患者明显,第2年就出现骨量减少,尤其对股骨颈、髋关节的影响更明显。对于绝经后患者,在TSH抑制治疗的同时应接受抗骨质疏松的初级预防,保证钙离子摄入。
DTC患者大多预后良好,随着TSH抑制水平与时间的相互作用,对骨密度的远期影响不容忽视。在临床工作中需结合我国DTC患者双风险评估的分层标准及TSH抑制治疗的个体化目标[1],进行合理治疗及预防措施,既降低 DTC复发、转移和死亡风险,又减少不良反应,提高 DTC患者的生存率和生活质量。

