腹腔镜下脑室-腹腔分流术治疗小儿脑积水的疗效及安全性分析
马俊,马志明,邹志浩,修彬华,杨江河
小儿脑积水是小儿神经外科常见的严重脑部疾病[1]。脑室-腹腔分流术(ventriculoperitoneal shunt,VPS)在神经外科被广泛用于成人、小儿脑积水治疗,其手术效果良好,安全性高[2,3]。但术后易出现管道堵塞、术后感染、脑出血等并发症,并影响预后。近年来,全麻下气腹腹腔镜下VPS成为了治疗脑积水的首选外科手术方式[4]。在改善临床症状的基础上可降低颅内压及脑组织的损害程度,减少术后并发症发生,快速恢复脑部功能[5,6]。本研究对我院收治的小儿脑积水患者应用腹腔镜下VPS进行治疗,收到良好效果,报告如下。
1 资料与方法
1.1 一般资料
选取2009年2月至2016年12月我院神经外科救治的小儿脑积水56例,年龄<15岁;主要临床表现为颅高压症状,有恶心、呕吐、头痛、眩晕、血压升高及视力模糊、步态不稳、记忆力障碍等;均经头颅CT或MRI检查确诊,并显示皮质萎缩、侧脑室扩大、侧脑室额角间质性脑水肿表现明显。排除对手术不耐受,有手术禁忌症者;合并颅内及腹腔感染者;脑脊液蛋白>500 mg/L或有新鲜出血者;临床资料不完整者。本研究经医学伦理研究委员会批准且所有纳入患儿家属均知情同意。
1.2 方法
1.2.1 分组 将56例患儿依据手术方式分为对照组与腹腔镜组,各28例。对照组男17例,女11例;年龄7个月~13岁,平均(3.33±4.26)岁;脑积水致病原因:先天性15例,外伤性10例,肿瘤性3例;脑积水Vassilouthis分级:轻度脑积水10例,中度脑积水16例,重度脑积水2例。腹腔镜组男19例,女9例;年龄5个月~12岁,平均(3.26±4.33)岁;脑积水致病原因:先天性16例,外伤性9例,肿瘤性3例;脑积水Vassilouthis[4]分级:轻度脑积水9例,中度脑积水16例,重度脑积水3例。2组患儿年龄、病程、病因、Vassilouthis分级等方面差异无统计学意义(P>0.05),具有可比性。
1.2.2 治疗 2组患儿手术中头颅部分操作相同,患儿仰卧位头转向左,背下垫高,暴露颈部,头部切口均为右侧额角,经右侧额角侧脑室穿刺,并于耳后皮下固定分流阀,用脑室腹腔专用通条,将分流管自头皮下经乳突后方,胸骨前面引至腹壁。对照组患儿采用传统VPS术式,于腹部剑突下,做旁正中切口,长约5 cm,逐层切开腹壁,将通条沿胸骨皮下引至腹壁切口处,撤出通条,将分流管尾端从腹壁向腹腔内引入,见分流管腹腔端脑脊液流出通畅后,将脑室-腹腔分流管尾端置入腹腔右髂窝,不固定,逐层缝合腹壁,手术完毕。腹腔镜组患儿采用腹腔镜下VPS:患儿脐缘做一约10 mm切口,穿刺后制造气腹,腹压控制在10 mmHg,置入腹腔镜,腔镜下常规对腹腔各器官进行探查,排除有无腹腔粘连及腹腔病灶,在上腹剑突下及右侧季肋下再分别做约10 mm、5 mm表浅小口,由腔镜套管于患儿剑突下将脑室-腹腔分流管腹腔端导入腹腔,分流管尾端固定于肝圆韧带上,防止脱落,确定分流管腹腔端通畅后停气腹,逐层缝合切口,手术完毕。2组患儿均随访12个月。
1.2.3 观察指标 ④Kamofsky评分[7]评价2组手术前后临床症状改善情况:0分表示死亡,100分表示健康,无临床症状和体征。④Salmon标准[8]评价2组手术效果,分为临床治愈、明显好转、轻度改善、无变化、恶化及术后死亡;总有效率%=(临床治愈例数+明显好转例数+轻度改善例数)/总例数×100%。④统计2组术后并发症发生情况。④于术前及术后3 d和1月各时间点采集2组患儿晨起空腹血清标本,采用ELISA法检测神经元特异性烯醇化酶(neuron specific enolase,NSE)和S-100蛋白含量[9]。
1.3 统计学处理
采用SPSS 22.0软件处理数据。符合正态分布以及方差齐性的计量资料以(x±s)表示,组内治疗前后比较采用配对t检验,组间比较采用独立样本均数t检验;计数资料以率表示,组间比较采用秩和检验;P<0.05为差异有统计学意义。
2 结果
2.1 手术时间及术后临床指标比较
与对照组比较,腹腔镜组手术时间及术后排气时间明显缩短(P<0.01);但2组手术前后双侧脑室额角变化及脑积水症状好转情况差异无统计学意义(P>0.05);术后2组Kamofsky评分均明显升高(P<0.01),且腹腔镜组评分高于对照组[10](P<0.05),见表1。
2.2 NSE及S-100蛋白含量比较
术前2组血清NSE及S-100蛋白含量差异无统计学意义(P>0.05);术后2组NSE及S-100蛋白含量均呈现先升高后降低趋势,与同组术前差异有统计学意义(P<0.01);术后第3天腹腔镜组血清NSE及S-100蛋白含量均低于对照组(P<0.05),术后1个月2组间NSE及S-100蛋白含量均无统计学意义(P>0.05),见表3。
2.3 临床疗效及并发症比较
2组术后Salmon标准评价结果显示,腹腔镜组总有效率为85.71%,高于对照组的60.71%(P<0.05),见表2。腹腔镜组并发症总发生率为10.71%,明显低于对照组的39.29%(P<0.05),见表4。
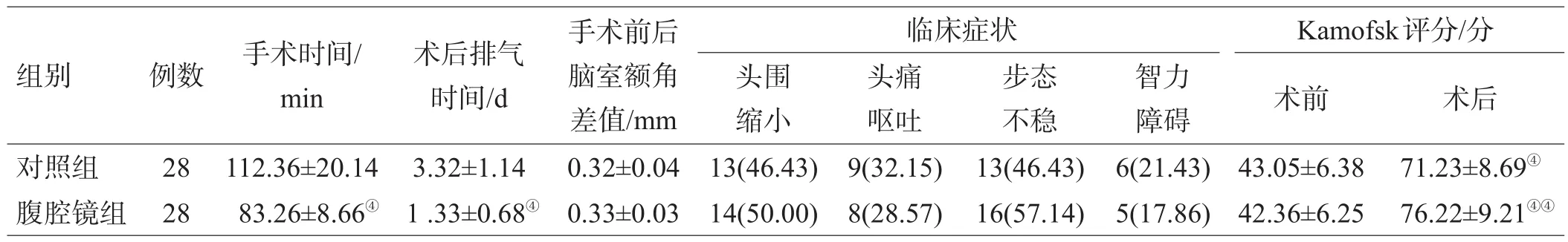
表1 2组手术时间及术后各临床指标的比较[(x±s)或例(%)]

表2 2组术后Salmon标准评价结果[例(%)]

表3 2组手术前后NSE、S-100蛋白含量比较(μg/mL,x±s)
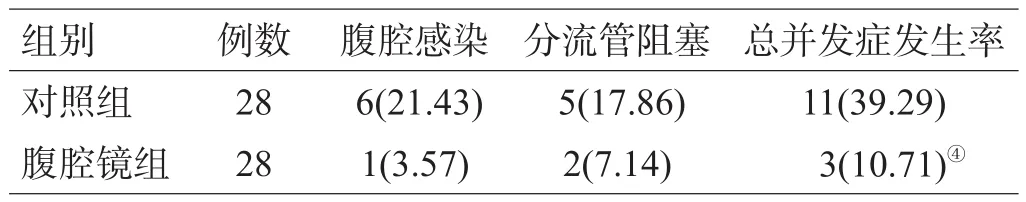
表4 2组术后并发症比较[例(%)]
3 讨论
小儿脑积水多由先天因素造成;患儿临床死亡率高、预后差,并严重影响患儿身体和智力的发育[11],是小儿神经外科研究的重点及难点。手术治疗是小儿脑积水最常用且最有效的治疗方法。但对于晚期重度脑积水患儿,手术治疗的预后也通常较差[12]。VPS是临床常用治疗脑积水的术式,但术中需开腹,创伤较大,恢复慢,同时由于无法直视下将分流管被置入腹腔,容易产生腹部感染、分流管阻塞、腹腔穿孔及消化道症状等并发症,降低手术疗效[13]。腹腔镜下VPS具有切口小、术后并发症发生率低、患儿预后快的特点,术中脑室穿刺采用额角,脑室端分流管沿矢状面走行,生理性脑脊液循环更符合,对患者脑脊液正常循环通路的影响较小[14]。同时,腹腔镜操作手术视野开阔,可避免分流管对腹腔内脏器的损伤,且分流管末端被固定在肝膈间隙,降低了分流管腹腔端被大网膜包裹而阻塞,提高手术成功率。
本组研究显示,先天因素是引起小儿脑积水的主要原因,占本组的64.6%,与此前报道相类似;同时,虽然2组手术前后双侧脑室额角变化及脑积水临床症状好转情况无显著性差异,但是腹腔镜组的手术时间及术后排气时间均较对照组明显缩短;同时,术后2组Kamofsky评分虽然均明显升高,但是腹腔镜显著高于对照组,腹腔镜组治疗的总有效率也明显高于对照组,且腹腔镜组术后并发症发生率明显低于对照组。这提示腹腔镜下VPS较传统VPS治疗小儿脑积水疗效更好,术后腹腔并发症更低。
脑损伤与血液代谢产物及局部酸中毒后释放多种生化物质造成的继发损伤有关[15,16],目前研究较多的生化标志物有NSE、S-100蛋白、髓鞘碱性蛋白(myelin basic protein,MBP)及基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)等,均与脑损伤及神经功能缺损程度密切相关。NSE特异性存在于神经元和神经内分泌细胞中,脑积水后周围神经元大量坏死,NSE释放并由血脑屏障进入外周血,造成外周血NSE水平升高。脑积水后血清NSE升高的程度与脑积水发病时间、病情严重程度正相关,呈动态变化过程[17];血清NSE的浓度与脑损伤后近、远期脑功能的恢复也密切关系。S-100蛋白是一种生物学活性较强的酸性钙离子结合蛋白,存在于中枢神经的星形胶质细胞中。S100蛋白增高及进入外周血的方式与NSE类似[17],并与巨噬细胞降解作用、脑损伤程度和血脑屏障损伤程度呈正相关,是评价脑组织内神经胶质细胞损伤的程度的特异性指标。本研究结果显示,2组术后NSE及S-100蛋白含量呈现先升高后降低的趋势,且术后3 d腹腔镜组NSE及S-100蛋白含量均低于对照组。该结果表明腹腔镜下VPS的应用可加快血脑屏障功能的修复,促进神经功能的早期恢复,降低死亡率和致残率,改善预后。
综上所述,腹腔镜下VPS治疗小儿脑积水可明显提高治愈率,改善临床症状,且不良反应发生率低,安全有效。但本次临床研究中病例数较少,需要积累更多的病例以进一步确认腹腔镜下VPS治疗小儿脑积水的临床疗效。
--腹腔分流管更换术中的作用

