低氧诱导因子-1α、血管内皮生长因子、Bcl-2与急性脑梗死患者神经功能缺损度的相关研究
李山,蒋向阳,刘顺达
脑梗死是目前我国致残率和死亡率最高的疾病之一[1]。早期神经功能恶化(early neurologic deterioration,END)是脑梗死患者常见的临床表现之一,严重影响患者的近期疗效和远期预后[2]。脑卒中后脑局部灌注压降低是造成END的主要病理基础之一[3]。近年来,研究认为低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、血管内皮生长因 子(vascular endothelial growth factor,VEGF)、Bcl-2在脑损伤过程中发挥着重要作用[4-6]。本研究对HIF-1α、VEGF、Bcl-2在脑梗死患者中动态变化规律及与END的相关性进行研究。
1 资料与方法
1.1 一般资料
选取2015年11月至2017年10月我院神经内科收治的脑梗死患者173例,男97例,女76例;年龄48~83岁,平均(63.48±7.32)岁;均符合《中国急性期缺血性脑卒中诊治指南(2014版)》[7]中关于脑梗死的诊断标准,并在入院24 h内通过颅脑CT或MRI检查确诊为脑梗死。根据是否发生END,将患者分为END组59例和非END组114例。2组一般资料差异无统计学意义(P>0.05),见表1。
1.2 纳入及排除标准
本研究纳入标准:符合2015年《中国急性期缺血性脑卒中诊治指南(2014版)》中关于脑梗死的诊断标准;经头颅脑影像学检查确诊;发病时间≤72 h;入院24 h内接受神经功能评估;患者家属签署知情同意书。本研究排除标准:不符合上述纳入标准者;入院期间接受机械取栓、动静脉溶栓治疗者;合并严重的肝肾功能损伤;合并慢性充血性心力衰竭、急性心肌梗死等器质性心脏疾病;恶性肿瘤患者;合并严重的血液系统疾病、免疫系统疾病等。
1.3 方法
1.3.1 临床资料收集 患者入院当天,详细记录患者的姓名、性别、年龄、体质量指数(body mass index,BMI)、高血压病史、糖尿病病史、高血脂病史、冠心病病史、美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分及发病至入院时间。
1.3.2 诊断标准 ④高血压病:既往有高血压病史或入院后2次血压测量值异常(收缩压>140 mmHg和/或舒张压>90 mmHg)(1 mmHg=0.133 kPa)。④糖尿病:既往有糖尿病病史或入院后10 d内检查空腹血糖>7 mmol/L或餐后2 h血糖>11.1 mmol/L。④高脂血症:既往有高脂血症史或入院检查血脂异常。④起病至入院时间:患者神经功能缺损症状发生的时间至入院接受诊疗的时间间隔。④END定义[8]:由同1名神经内科医师于患者入院当天、24 h、48 h、72 h分4次采用NIHSS量表评估患者神经功能缺损情况,任意1次评分较入院时增加≥2分定义为END。④END分级:根据患者入院时NIHSS评分,NIHSS<4分为轻度,4~15分为中度,>15分为重度。
1.3.3 实验室检测指标 所有患者于入院后12 h、24 h、3 d、5 d、7 d、10 d清晨空腹抽取5 mL肘静脉血,4℃静置30 min,离心,收集上层血清。采用双抗体夹心酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测血清 HIF-1α、VEGF、Bcl-2水平。ELISA试剂盒购自上海恪敏生物科技有限公司。所有操作严格按照试剂盒说明书进行。
1.3.4 脑梗死面积评估 采用扩散加权成像-Alberta卒中早期CT评分法(diffusion weighted imaging Alberta stroke program early CT score,DWI-ASPECTS)评估患者10个动脉供血区缺血性表现。1分表示正常,0分表示缺血性梗死,总分为10分。
1.4 统计学处理
采用SPSS 21.0软件处理数据。符合正态分布以及方差齐性的计量资料以(x±s)表示,组间比较采用独立样本均数t检验;计数资料以率表示,组间比较采用χ2检验;将单因素分析中P<0.05的因素纳入多因素Logistic回归模型分析与END的相关性;P<0.05为差异有统计学意义。
2 结果
2.1 临床特征比较
与非END组患者比较,END组患者NIHSS评分及DWI-ASPECTS≤7分的患者比例明显较高(P<0.05)。2组平均发病至入院时间和血压差异无统计学意义(P>0.05),见表2。
2.2 外周血HIF-1α、VEGF、Bcl-2水平比较
END组患者入院后12 h、24 h、3 d、5 d、7 d时血清HIF-1α、VEGF和Bcl-2水平均明显上升,高于非END组(P<0.05);在入院24 h时,2组血清HIF-1α、VEGF和Bcl-2水平均达到高峰,随后呈逐渐下降趋势。入院10 d后2组血清HIF-1α、VEGF和Bcl-2水平差异无统计学意义(P>0.05),见表3。
2.3 不同程度END亚组患者外周血HIF-1α、VEGF、Bcl-2水平比较
根据患者入院时NIHSS评分,本组轻度END18例,中度END26例,重度END15例。重度END亚组患者外周血HIF-1α、VEGF、Bcl-2水平明显高于轻度和中度END亚组患者(P<0.05),见表4。
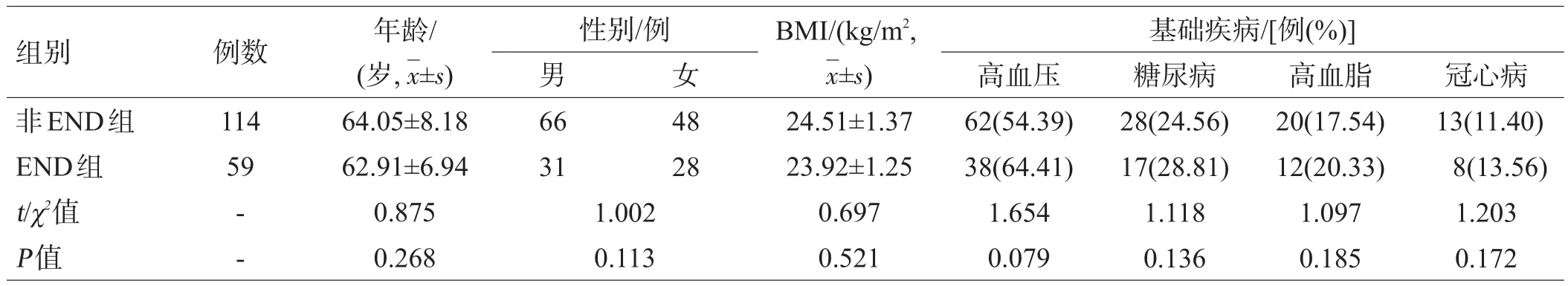
表1 2组一般资料比较
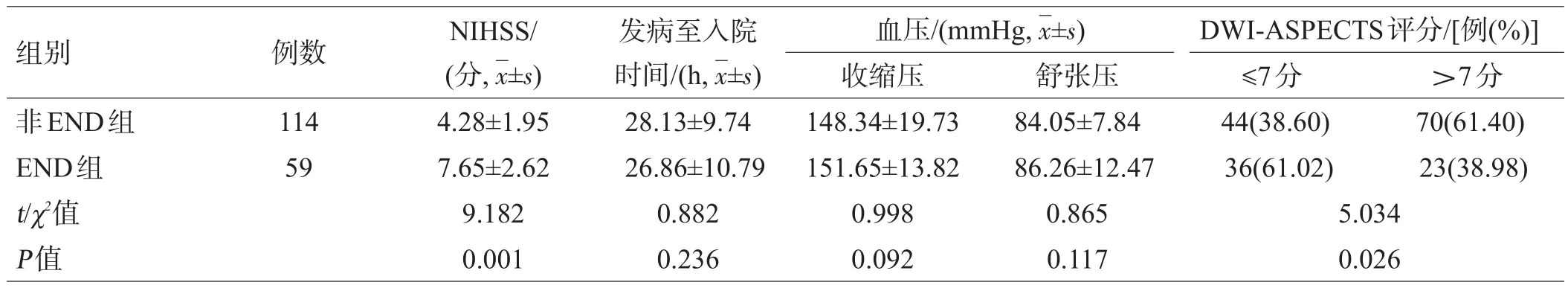
表2 2组临床特征比较

表3 2组不同时间点外周血HIF-1α、VEGF、Bcl-2水平比较(x±s)
2.4 HIF-1α、VEGF、Bcl-2水平与END的相关性分析
选择单因素分析中P<0.05的变量HIF-1α、VEGF、Bcl-2、NIHSS、DWI-ASPECTS评分为自变量,END为应变量,进行多因素Logistic回归分析,结果显示,患者外周血HIF-1α、VEGF、Bcl-2水平升高是脑梗死患者发生END的独立危险因素(P<0.05),见表5。
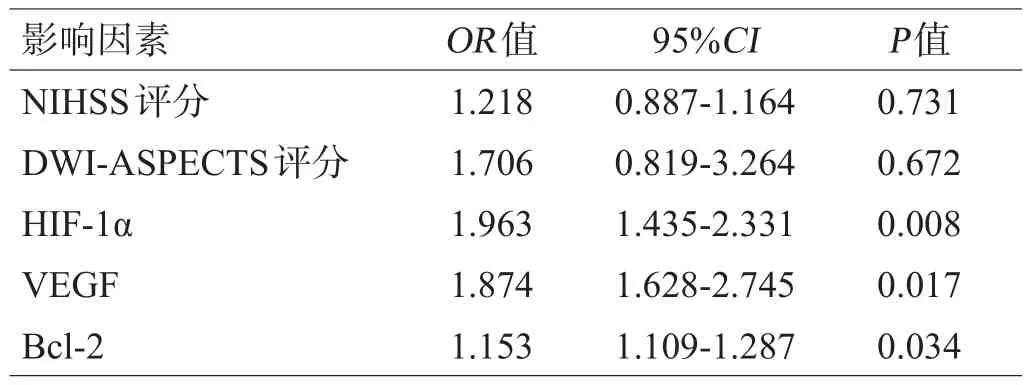
表5多因素Logistic回归分析脑梗死患者发生END的影响因素
3 讨论
END与脑梗死患者的预后密切相关[8,9]。HIF-1是组织在缺氧情况下产生的一种无氧应答调节因子,通过参与对血管生成通路、肾素-血管紧张素转化酶通路、氨基酸代谢通路等缺氧反应性信号通路的调控作用,介导内环境的稳定,发挥神经保护作用[10,11]。在脑卒中早期,HIF-1α可促使细胞凋亡,在后期则促使细胞增殖,因此HIF-1α可能属于双向调节因子[12]。HIF-1α磷酸化后可激活VEGF等抗凋亡基因,一方面促进微血管和侧支循环的形成,增加脑血流量,同时刺激神经元细胞增殖、分化等,起到脑保护作用;另一方面可能会提高血管的通透性,破坏血脑屏障,加重脑损伤。也有研究证实,HIF-1α可参与启动Bcl-2诱导的细胞凋亡过程,据推测可能的作用机制与Bcl-2家族的前凋亡成员Nip3有关[13],缺血缺氧的脑组织细胞Nip3基因表达上调,从而启动caspase级联反应[14]。而caspase-3是一种分布相当广泛的半胱氨酸-天冬氨酸蛋白酶,在受到凋亡信号刺激时,可被激活,降解凋亡抑制蛋白,如Bcl-2蛋白,从而诱导细胞凋亡程序启动;而Bcl-2蛋白的裂解产物可进一步激活caspase家族成员促使凋亡级联反应被放大,直至细胞解体[15]。既往有研究证实HIF-1α作为氧感受器已经成为低氧应答时基因表达和恢复内环境稳定的调节中心,而VEGF是最重要的血管调节生长因子,因此HIF-1α、VEGF、Bcl-2与脑梗死的相关性已经得到大量研究的证实[16],但是目前关于这3个因子在梗死后不同时间点的具体表达特点及相关机制尚没有明确报道。本项研究结果显示,在入院12 h时已可以检测到脑梗死患者外周血HIF-1α、VEGF、Bcl-2的表达,在24 h时3种血清因子水平均达到高峰,随后逐渐降低,在第10天时,END组患者和非END组患者外周血HIF-1α、VEGF、Bcl-2水平基本一致。说明HIF-1α、VEGF、Bcl-2可能属于脑梗死急性期的神经损伤敏感因子。
本项研究显示,END组患者的基线NIHSS评分明显高于非END组患者,说明NIHSS评分与END的发生呈正相关性。但是NIHSS对于某些特定部位的神经功能缺损欠缺灵敏性,因此无法更进一步预测脑梗死的不良结局。而本项研究进一步经Logistic回归分析证实,脑梗死患者HIF-1α、VEGF、Bcl-2水平是脑梗死患者发生END的独立危险因素。
因此,当临床表现和影像学检查结果不能准确评估患者病情时,可以密切监控外周血HIF-1α、VEGF和Bcl-2水平变化,作为急性脑梗死后早期预后的参考预测指标。

