血清神经丝蛋白轻链多肽水平预测急性颅脑损伤患者临床预后的研究
李全春
急性颅脑损伤是外力作用于头部所导致的颅骨、脑膜、脑血管和脑组织的机械形变所致,是致死和致残的主要原因之一[1]。临床上,常用格拉斯哥昏迷量表评估急性颅脑损伤的严重程度,而结构性损伤可能通过磁共振技术检查发现,但准确度不高,且并不能预测患者的长期临床预后[2]。S100钙结合蛋白B(S100B)和神经元特异性烯醇化酶(NSE)是常用的检测急性颅脑损伤的生物学标志物,但其灵敏度均不高[3,4]。探寻一种高度敏感的生物学检测指标用于颅脑损伤治疗和预后评估成为临床研究的热点[5]。为探讨血清神经丝蛋白轻链多肽(neurofilament light polypeptide,NF-L)预测急性颅脑损伤预后的应用价值,我院对100例急性颅脑损伤患者进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月至2016年1月我院收治的急性颅脑损伤患者100例作为观察组,男65例,女35例,年龄18~67岁,平均(41.2±10.2)岁,排除患神经和/或自身免疫性疾病史者及怀孕者。选取同期我院体检的年龄和性别相匹配的50例健康人群作为对照组。本研究经医院伦理委员会讨论通过,所有患者或其家属知情后签署知情同意书。
1.2 方法
在观察组患者入院后立即完善各项常规检查,并且于受伤后D0、D1、D2、D3、D4、D6、D8-9和D10-12检测血清NF-L水平(采用人NF-L酶联免疫吸附检测试剂盒,上海童耀生物科技有限公司)和血清S100B水平(采用ELISA,Bio-rad680型酶标仪)。同时检查对照组血清NF-L水平和血清S100B水平,比较2组血清NF-L水平和血清S100B水平。
对观察组进行CT分级。Fisher CT分级标准:1级:蛛网膜下腔未见血液;2级:纵裂、脑岛池等各扫描层有薄层血液,厚度<1 mm,或血液弥漫分布于蛛网膜下腔;3级:蛛网膜下腔局限血凝块,或垂直各层面血块厚≥1 mm;4级:脑内或脑室内血块,无或有弥漫性蛛网膜下腔出血。分析观察组受伤后D0 CT分级和血清NF-L、S100B水平相关性。
随访观察组受伤后1年预后情况:采用格拉斯哥预后量表(Glasgow outcome scale,GOS)对患者评分,分值1~5分,其中1分为死亡;2分为持续性植物状态;3分为严重残疾;4分为中度残疾;5分为完全恢复。1~3分为预后不良;4~5分为预后良好。根据观察组1年后生存和GOS评分分为生存亚组和非生存亚组、预后良好亚组和预后不良亚组,比较不同亚组血清NF-L水平。分析观察组预后和血清NF-L水平的相关性,分析血清NF-L水平预测急性颅脑损伤预后的ROC曲线。
1.3 统计学处理
采用SPSS 18.0软件处理数据。计量资料以(x±s)表示,组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验,采用Spearman相关性分析软件进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者血清NF-L水平比较
观察组患者受伤后D0、D1、D2、D3、D4、D6、D8-9和D10-12血清NF-L水平均显著高于对照组(均P<0.05),见表1。
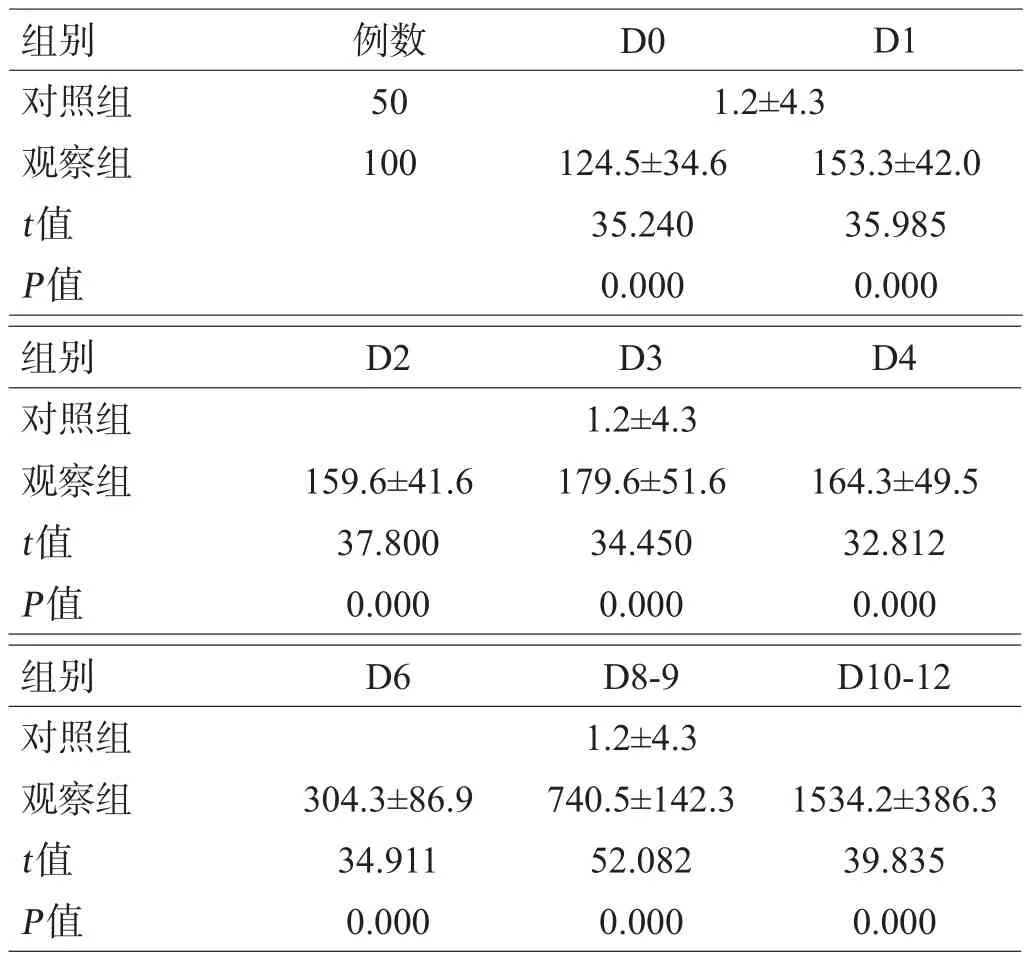
表1 2组患者不同时间点血清NF-L水平比较(pg/mL)
观察组患者受伤后D0、D1、D2、D3和D4血清S100B水平均显著高于对照组(均P<0.05),D6、D8-9和D10-12血清S100B水平与对照组比较差异无统计学意义(均P>0.05),见表2。
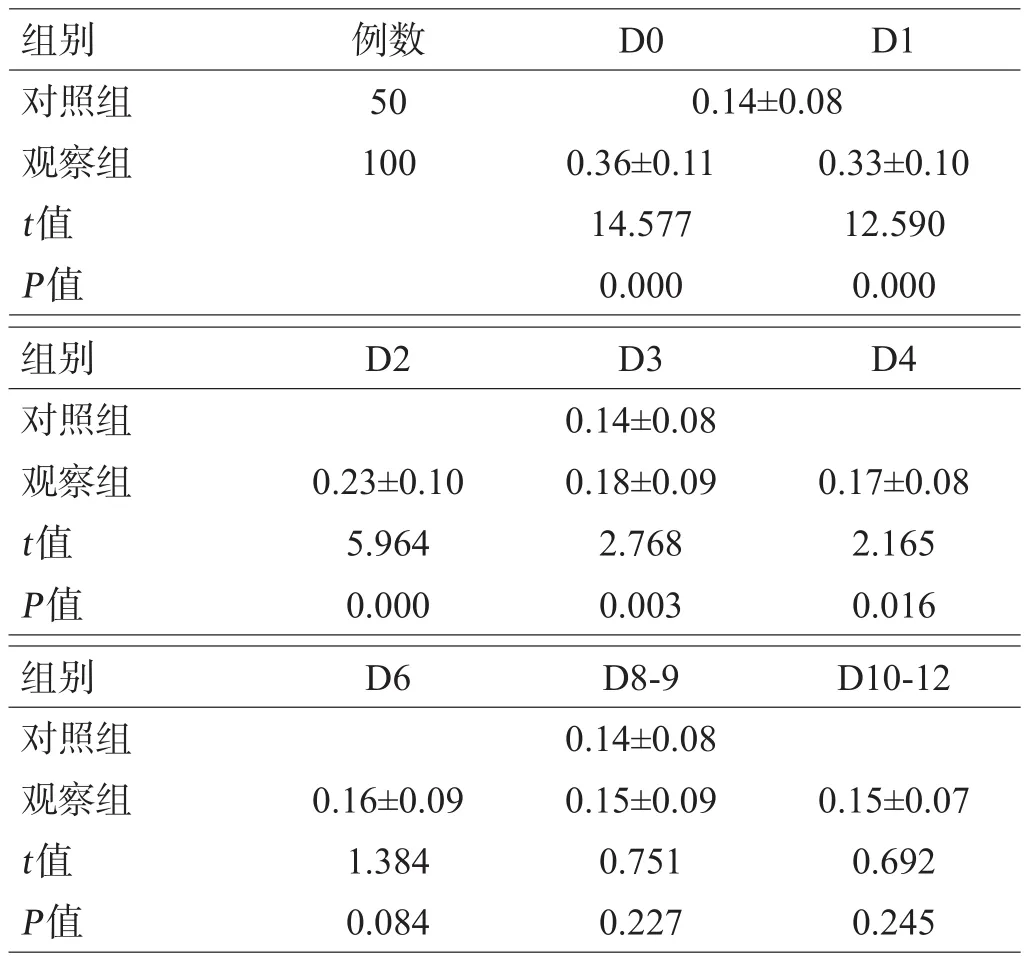
表2 2组患者不同时间点血清S100B水平比较(μg/L)
2.2 观察组受伤后D0 CT分级和血清NF-L、S100B水平相关性
Spearman相关性分析结果显示观察组受伤后D0CT分级与血清NF-L水平呈显著正相关(r=0.386,P=0.001),与血清S100B水平无相关性(r=0.234,P=0.125)。
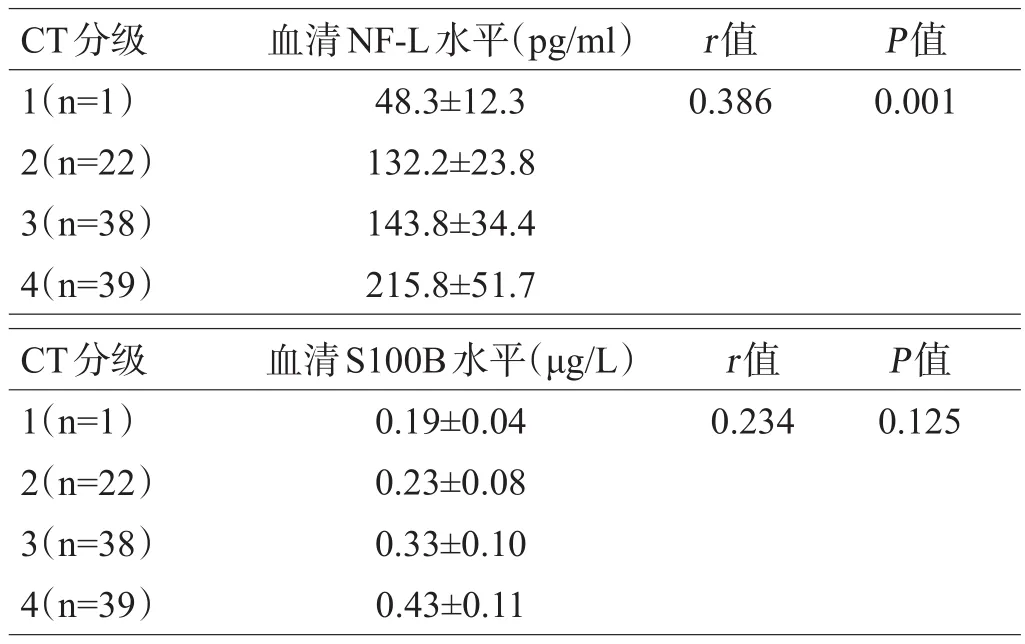
表3 观察组受伤后D0 CT分级和血清NF-L、S100B水平相关性分析
2.3 不同预后亚组血清NF-L水平比较
非生存亚组患者受伤后24 h和1~12 d血清NF-L水平均显著高于生存亚组(均P<0.05),见表4。
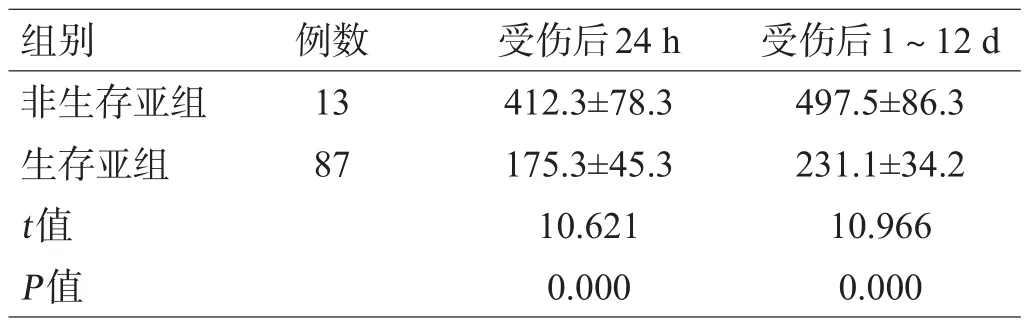
表4 非生存亚组和生存亚组患者血清NF-L水平比较(pg/mL)
预后不良亚组患者受伤后24 h血清NF-L水平显著高于预后良好亚组(P<0.05),见表5。

表5预后不良亚组和预后良好亚组患者受伤后24 h血清NF-L水平比较(pg/mL)
2.4 观察组预后和血清NF-L水平的相关性分析
Spearman相关性分析结果显示观察组患者1年后GOS评分与血清NF-L水平呈显著负相关(r=-0.367,P=0.008),见表6。
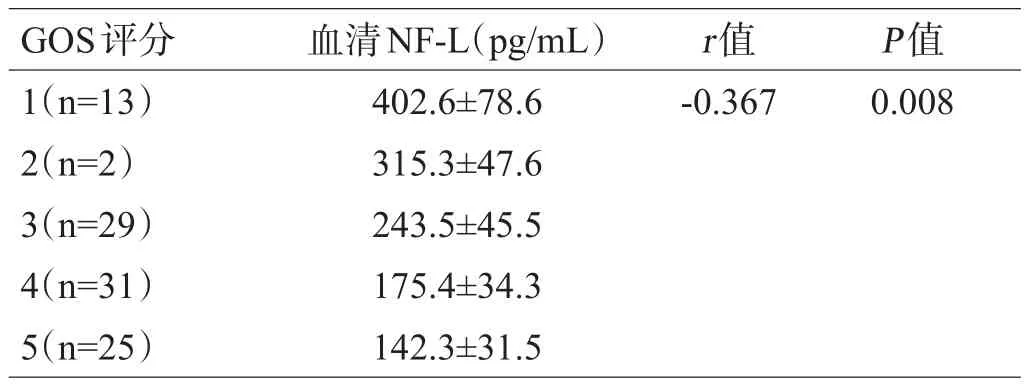
表6观察组患者1年后GOS评分与血清NF-L水平相关性分析
2.5 血清NF-L水平预测急性颅脑损伤预后的ROC曲线分析
入院当天血清NF-L预测急性颅脑损伤的AUC为0.99,且在入院后6 d AUC上升到1.00;入院当天血清NF-L预测急性颅脑损伤生存的最佳截断值为412 pg/mL,灵敏度和特异度分别为71%和88%;入院24 h血清NF-L预测急性颅脑损伤预后的最佳截断值为217 pg/mL,灵敏度和特异度分别为86%和56%。
3 讨论
近年来,研究发现多种与颅脑损伤相关的生物学标记物,这些标记物在颅脑损伤病情发展和预后中起到一定作用,但特异性和灵敏度均不高[6]。外力所致轴突白质损伤是引起颅脑损伤的主要因素,而NF-L大量表达于轴突白质中,是细胞骨架的重要组成部分,并维持轴索的正常生理功能,包括树突的分支和生长等[7]。研究表明颅脑损伤患者的脑脊液NF-L水平显著增高,可以用于评估患者的病情和预后,然而,由于腰椎穿刺的侵入性,临床上常规进行重复腰椎穿刺是不可行的[8,9],因此我们采用超灵敏的ELISA法来测量急性颅脑损伤患者血清NF-L水平,来探讨其与预后的关系。
本研究分析了100例急性颅脑损伤患者和50例健康人群的血清NF-L水平,结果显示观察组血清NF-L水平显著高于对照组,在发生急性颅脑损伤后很快可以从患者血清中检测到NF-L,且浓度显著高于对照组,且在患者入院后至D12呈迅速升高趋势,这可能与颅脑损伤后继发的颅内高压和低氧血症有关[10,11]。进一步研究显示非生存亚组和预后不良亚组患者血清NF-L浓度显著高于生存亚组和预后良好亚组,表明颅脑损伤患者血清NF-L水平与患者的死亡风险和损伤严重程度显著相关。这是由于NF-L高表达于轴索,在受外力作用后,神经元损伤,NF-L进入细胞外液,通过血脑屏障进入血液中,直至达到平衡[12]。因此,颅脑损伤更为严重的患者的血清NF-L浓度要高于颅脑损伤较轻的患者。S00B蛋白属于S100家族,主要存在于神经胶质细胞中,S100B与肿瘤、精神障碍、癫痫有关,而且与脑损伤有密切关系。正常情况下,S100B蛋白不能通过血脑屏障,颅脑损伤导致脑组织损伤,脑细胞和血脑屏障的破坏使血S100B迅速升高,对脑损伤的诊疗评价具有一定的价值。本研究结果也显示在急性脑损伤后患者血液中的S100B蛋白急速升高,显著高于对照组,但是随着时间的推移,血清S100B蛋白水平不断下降,到受伤后第6天血清S100B蛋白水平与对照组无显著差异。进一步分析结果显示S100B蛋白与患者颅脑损伤的CT分级无相关性,而血清NF-L与患者颅脑损伤的CT分级呈显著正相关,能够很好表现患者的颅脑损伤程度,这与S100B蛋白比较,具有一定的优势。
进一步研究的结果也表明血清NF-L水平和患者1年后的GOS评分呈显著负相关。本研究通过绘制ROC曲线发现入院当天血清NF-L预测急性颅脑损伤的AUC就达到0.99。预测患者死亡风险和预后的灵敏度和特异度分别达到71%、88%和86%、56%,灵敏度和特异度较高,且与国内外其他研究的结果相似[13,14]。最近一项关于脑脊髓神经鞘损伤的研究表明NF-L是轴突损伤的标志,NF-L的浓度与MRI的轴突损伤程度有关[15],而本研究并没有评估NF-L浓度和轴突损伤的关系,存在一定局限性,后续研究将通过磁共振成像技术,如扩散张量成像来评估轴突的损伤程度与血清NF-L浓度。
综上所述,血清NF-L水平与急性颅脑损伤患者临床预后呈显著负相关,检测血清NF-L水平有利于敏感评价急性颅脑损伤后神经元损伤的严重程度,血清NF-L可以作为预测急性颅脑损伤的理想生物学标记物,有利于敏感评价患者预后、监测病情发展及疗效、及时改善治疗方法,值得临床加以关注。

