MiR-499靶向HMGB1保护缺氧复氧心肌细胞损伤的分子机制探讨
周慧良,甘受益,李宾,冯光瑞,宋巧巧,王淼
高迁移率族蛋白1(HMGB1)是进化上高度保守的非组蛋白染色质结合蛋白[1]。应激状态下,活化的免疫细胞和受损细胞将HMGB1释放到细胞外,其中HMGB1作为促炎介质发挥作用并在炎性疾病的发病机制中起重要作用[2]。最近研究表明,炎症小体,细胞内蛋白质复合物,响应各种外源性和内源性危险信号,并调节激活的免疫细胞释放HMGB1[3]。鄂璐莎等[4]在心肌缺血/再灌注损伤的研究中阐明,缺血/再灌注可使大鼠心肌中HMGB1表达上调,心肌组织中葡萄糖调节蛋白78(GRP78)、内质网应激蛋白(CHOP)、含半胱氨酸的天冬氨酸蛋白水解酶(caspase-12)的表达上调,且沉默HMGB1可明显减轻内质网应激水平。内质网功能紊乱,细胞将启动caspase12依赖的细胞凋亡。据报道,HMGB1在缺氧复氧心肌损伤中发挥关键作用,但其具体的作用及机制尚未完全清楚。miRNA为一类内源性的小核苷酸片段,约30%的人类基因受miRNA的调节[5]。miRNA在很多心脏病的发生发展中也具有重要作用,近几年出现很多miRNA治疗心脏病的研究。柳培宇等[6]发现,miRNA-214在心肌损伤中表达上调且具有保护心肌损伤功能。miR-499为肌球蛋白基因编码的miRNA家族成员,其主要在动物体的心肌、骨骼肌中表达,在心肌细胞的分化中起关键作用[7]。但miR-499在缺氧复氧心肌细胞中的作用机制尚未十分清楚。本研究将建立缺氧复氧心肌细胞H9c2损伤模型,检测miR-499、HMGB1的表达,观察过表达miR-499、敲减HMGB1、过表达HMGB1对缺氧复氧H9c2细胞凋亡的影响,揭示miR-499可抑制缺氧复氧心肌细胞凋亡,其机制可能与靶向结合HMGB1有关,将为心脏病的预防和治疗提供理论依据。
1 材料与方法
1.1 材料心肌细胞H9c2购自美国菌种保藏中心(ATCC);BCA蛋白定量试剂盒、脂质 LipofectamineTM2000、逆转录试剂盒、双荧光素酶报告基因检测试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)(Annexin V-FITC/PI)双染色法凋亡检测试剂盒购于Takara公司;改良Eagle培养基(DMEM)培养基、胎牛血清均购自美国Sigma公司。
1.2 方法
1.2.1 细胞培养及模型制造将心肌细胞H9c2用含
10%胎牛血清的DMEM培养液,放在恒温培养箱中进行培养,待细胞呈正常增殖状态时,将含有胎牛血清的DMEM培养液更换为低氧缓冲液(139 mM NaCl,4.7 mM KCl,0.5 mM MgCl2,1.0 mM CaCl2,5 mM Hepes,20 mM CH3CHOHCOONa 乳酸钠),并放置于气体组成为(95% N2,5% CO2)的缺氧复氧培养箱进行缺氧培养12 h,然后去掉培养液,重新加入含有胎牛血清的 DMEM培养基,放置于37℃,20% O2,5% CO2中培养4 h,即完成缺氧复氧(H/R)心肌细胞模型制造。
1.2.2 细胞转染为探究miR-499、HMGB1对缺氧复氧心肌细胞凋亡的影响,我们使用LipofectamineTM2000脂质体试剂将H/R+miRcon组(转染miR-con)、H/R+miR-499组(转染miR-499 mimics)、miR-con组(转染miRcon)、miR-499组(转染miR-499 mimics)、anti-miR-con组(转染anti-miR-con)、antimiR-499组(转染anti-miR-499)、H/R+si-con组(转染si-con)、H/R+si-HMGB1组(转染si-HMGB1)、H/R+miR-499+Ctrl组(miR-499 mimics和pcDNA3.1共转染)、H/R+miR-499+HMGB1组(miR-499 mimics和pcDNA3.1-HMGB1共转染),转染至H9c2细胞,转染8 h后,更换新鲜培养基继续培养48 h,然后按照1.2.1方法进行缺氧复氧细胞模型制造,最后用qRT-PCR法检测转染的效率,确认转染成功后将各组细胞用于 Western blot实验、qRT-PCR实验、Annexin V-FITC/PI双染色法细胞凋亡检测实验、双荧光素酶报告基因检测实验。
1.2.3 Western blot实验取适量对数生长期1.2.2各组细胞,用RIPA裂解,提取总蛋白,BCA法进行蛋白定量后变性,进行蛋白电泳,再行PVDF转膜,封闭2 h,然后用Ⅰ抗,4℃孵育过夜。次日,洗膜后用辣根过氧化物酶标记的Ⅱ抗37℃孵育2 h。结束后加入显影混合液,显影曝光。以目的条带灰度值与β-actin灰度值的比值表示目的蛋白HMGB1、B细胞淋巴瘤/白血病-2(Bcl-2)、免抗人单克隆抗体(Bax)、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)的表达。
1.2.4 qRT-PCR实验取适量对数生长期1.2.2各组细胞,遵照RNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按逆转录试剂盒按照说明书操作合成cDNA。最后按qRT-PCR试剂盒说明书操作进行miR-29c检测。用2-△△Ct计算miR-499的表达。
1.2.5 Annexin V-FITC/PI双染色法检测细胞凋亡取适量对数生长期1.2.2各组细胞,用预冷的PBS洗涤3次。另用结合缓冲液500 μl悬浮细胞,之后加入5 μl的 Annexin V-/FITC和PI,混匀,室温避光静置15 min。细胞凋亡率采用流式细胞仪分析测定。细胞凋亡率(%)= 早期凋亡率+晚期凋亡率。
1.2.6 双荧光素酶报告基因检测实验取适量对数生长期1.2.2各组细胞,遵照双荧光素酶报告基因检测试剂盒技术手册要求操作。psiCHECK2载体以萤火虫荧光素酶活性为内参,psiCHECK2-HMGB1-3 UTR WT和psiCHECK2-HMGB1-3 UTR MUT的表达为对照,转染24 h后,检测荧光强度。海参荧光素酶的发光强度与萤火虫荧光素酶发光强度的比值即反应miR-499与HMGB1的结合力。
1.2.7 统计学处理实验所用数据均使用SPSS 21.0软件分析。计量资料用均数±标准差(±s)表示,多组间数据比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧复氧H9c2心肌细胞对miR-499和HMGB1表达的影响运用Western blot检测缺氧复氧H9c2心肌细胞中HMGB1的蛋白表达,与NC组相比,H/R组细胞中HMGB1的蛋白表达显著升高(图1,表1)。用qRT-PCR法检测缺氧复氧H9c2心肌细胞中miR-499的表达水平,与NC组相比,H/R组细胞中miR-499表达显著降低(表1),均具有统计学意义(P均<0.05)。

图1 缺氧复氧H9c2心肌细胞中HMGB1蛋白的表达

表1 缺氧复氧H9c2心肌细胞中miR-499和HMGB1的表达(n=9)

图2 过表达miR-499对缺氧复氧H9c2心肌细胞中凋亡相关蛋白Bcl-2、Bax、Caspase-3蛋白表达影响
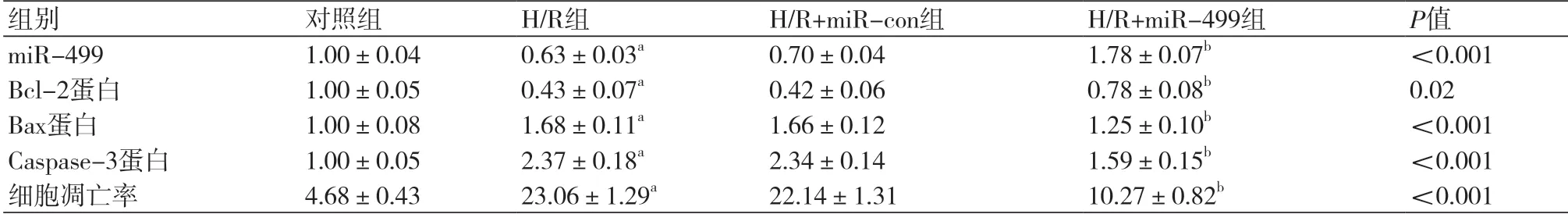
表2 过表达miR-499对缺氧复氧心肌细胞H9c2凋亡的影响(n=9)
2.2 过表达miR-499抑制缺氧复氧H9c2心肌细胞凋亡运用流式细胞术检测过表达miR-499对缺氧复氧H9c2心肌细胞的凋亡率,与NC组相比,H/R组、H/R+miR-con组细胞中miR-499表达均显著降低,Bcl-2蛋白表达均显著降低,Bax、Caspase-3蛋白表达均显著升高(图2),凋亡率均显著升高(表2),差异均具有统计学意义(P均<0.05);与H/R+miR-con组相比,H/R+miR-499组细胞中miR-499表达均显著升高,Bcl-2蛋白表达均显著升高,Bax、Caspase-3蛋白表达均显著降低(图2),凋亡率均显著降低(表2),差异均具有统计学意义(P均<0.05)。可见,过表达miR-499抑制缺氧复氧H9c2心肌细胞凋亡。
2.3 miR-499靶向HMGB1通过TargetScan对miR-499和HMGB1的结合进行预测,发现miR-499与HMGB1存在结合位点(图3A)。与miR-con组相比,miR-449组HMGB1的蛋白表达显著降低,与anti-miR-con组相比,antimiR-499组HMGB1的蛋白表达显著升高(图3B,表4)。运用双荧光素酶报告基因检测实验检测细胞荧光活性,与miR-con组相比,miR-449组WT处理的细胞荧光活性显著降低,MUT处理的细胞荧光活性变化不显著(表3),均具有统计学意义(P均<0.05)。可见,miR-449靶向HMGB1。
2.4 敲减HMGB1抑制缺氧复氧H9c2心肌细胞的凋亡将si-con、si-HMGB1转染H/R H9c2心肌细胞,分别标记为H/R+si-con组、H/R+si-HMGB1组。与对照组相比,H/R组细胞中HMGB1蛋白表达均显著降低,Bcl-2蛋白表达均显著降低,Bax、Caspase-3蛋白表达均显著升高(图4),凋亡率均显著升高(表5);与H/R+si-con组相比,H/R+si-HMGB1组细胞中HMGB1蛋白表达均显著降低,Bcl-2蛋白表达均显著降低,Bax、Caspase-3蛋白表达均显著升高(图4),凋亡率均显著升高(表5),均具有统计学意义(P<0.05)。可见,敲减HMGB1抑制缺氧复氧H9c2心肌细胞凋亡。
2.5 过表达HMGB1逆转miR-499对缺氧复氧H9c2心肌细胞凋亡的抑制作用将miR-499 mimics和pcDNA 3.1共转染至H/R H9c2心肌细胞,标记为H/R+miR-499+Ctrl组,miR-499 mimics和pcDNA 3.1-HMGB1共转染至H/R H9c2心肌细胞,标记为H/R+miR-499+HMGB1组。与H/R+miR-con组相比,H/R+miR-449组细胞HMGB1蛋白表达均显著降低,Bcl-2蛋白表达均显著升高,Bax、Caspase-3蛋白表达均显著降低(图5),凋亡率均显著降低(表6);与H/R+miR-499+Ctrl组相比,H/R+miR-499+HMGB1组细胞中HMGB1蛋白表达均显著升高,Bcl-2蛋白表达均显著降低,Bax、Caspase-3蛋白表达均显著升高(图5),凋亡率均显著升高(表6),均具有统计学意义(P<0.05)。可见,过表达HMGB1逆转miR-499对缺氧复氧H9c2心肌细胞凋亡的抑制作用。

图3 HMGB1为miR-499的靶基因
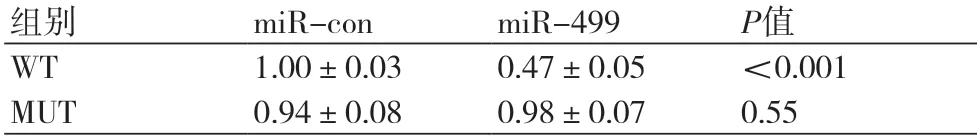
表3 miR-499对H9c2心肌细胞荧光活性的影响(n=9)
表4 H9c2心肌细胞中HMGB1的蛋白表达量(n=9)
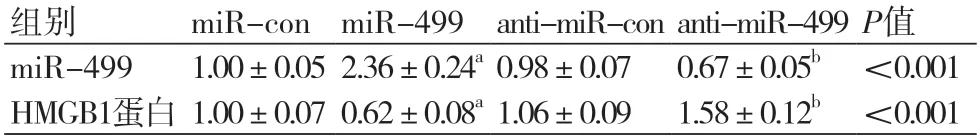
注:HMGB1:高迁移率族蛋白1;与miR-con组比较,aP<0.05;与anti-miR-con组比较,bP<0.05

图4 敲减HMGB1对缺氧复氧H9c2心肌细胞中凋亡相关蛋白表达的影响

表5 敲减HMGB1对缺氧复氧H9c2心肌细胞凋亡的影响(n=9)

图5 过表达HMGB1对缺氧复氧H9c2心肌细胞凋亡相关蛋白表达的影响
3 讨论
miRNA为长度在19-25个核苷酸长度的非编码微小RNA(ncRNA),其可调节基因表达[8]。miRNA在心脏生物学、癌症及其他疾病中均具有重要作用,但miRNA在心脏病中研究较少,其潜在治疗作用尚需继续开发[9]。孙小琴等[10]研究发现miR-499过表达能通过靶向SOX6抵抗缺氧诱导的神经PCI2细胞损伤,提高细胞活力,并降低细胞凋亡率。而岳莹等[11]发现,缺氧复氧心肌细胞中miR-499表达下调,Caspase-3蛋白表达上调、PI3K/Akt信号通路失活,而miR-499可以通过活化PI3K/Akt信号通路,减少缺氧/复氧所诱导的心肌细胞的凋亡。郑重洲等[12]研究也表明miR-499在H/R的H9C2细胞中低表达,且过表达miR-499可下调H/R H9C2细胞中JNK、Caspase-3的表达,抑制H/R H9c2细胞凋亡。本实验结果和他们的研究结果一致,也证明了miR-499在缺氧/复氧的心肌细胞中表达水平显著降低,过表达miR-499可显著下调Bax、Caspase-3的蛋白表达,上调Bcl-2的蛋白表达,且降低缺氧/复氧H9c2细胞的凋亡率。提示miR-499在缺氧/复氧所致的心肌细胞损伤中具有重要作用,其或可作为治疗心肌细胞损伤的靶点。
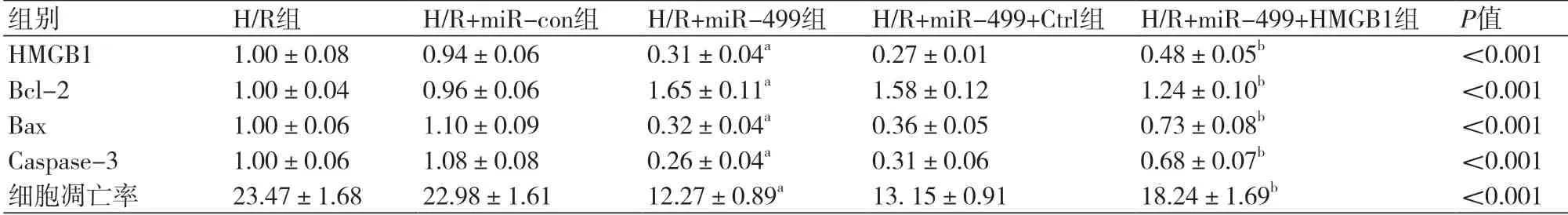
表6 过表达HMGB1逆转miR-499对缺氧复氧H9c2心肌细胞凋亡的抑制作用(n=9)
HMGB1是一种免疫炎症细胞分子,参与调节免疫反应[13,14]。且HMGB1能够结合DNA,维持核酸结构和基因转录,当其释放到细胞外环境时,可充当炎症的介质[15,16]。细胞外HMGB1有助于许多慢性炎症和自身免疫疾病的发病,包括败血症,类风湿性关节炎,动脉粥样硬化,慢性肾病,系统性红斑狼疮(SLE)及癌症[17,18]。邓秋菊等[19]研究发现缺氧复氧诱导的心肌细胞中HMGB1高表达,敲低HMGB1可减弱缺氧复氧诱导的心肌细胞凋亡,减轻氧化损伤。赵丽华等[20]发现下调 HMGB1表达可降低Caspase-3的水平,提高SOD、p-STAT3的水平,降低缺氧复氧对心肌细胞的氧化损伤进而抑制心肌细胞凋亡。邵忠华等[21]发现针灸可预处理减轻大鼠心肌缺血再灌注损伤的机制与减少HMGB1的表达有关。以上研究结果均表明 HMGB1参与了缺氧复氧诱导的心肌细胞凋亡,下调其表达可减轻氧化损伤。但均为说明其可能的作用机制。而本研究结果不仅证明了在缺氧复氧的心肌细胞中HMGB1上调表达,敲减HMGB1可下调Bax、Caspase-3的蛋白表达,显著抑制H/R诱导的H9c2细胞凋亡。此外还发现HMGB1被miR-499靶向调控,过表达HMGB1可逆转miR-499对H/R诱导的H9c2细胞凋亡的抑制作用。提示,HMGB1减弱缺氧复氧诱导的心肌细胞凋亡的机制或与miR-499有关。还有研究发现缺氧-复氧模拟肾缺血-再灌注可诱导HK2细胞HGMB1/TLR-4信号通路活化,参与调控TNF-α、IL-1β炎症介质的表达及HK2细胞的凋亡[22,23]。即HGMB1通过调控炎症介质介导细胞凋亡,而本实验未研究炎症介质的表达,今后可进一步从此角度进行相关研究,更清楚的了解HGMB1的作用机制,为临床应用提供理论依据。
综上所述,miR-499可抑制缺氧复氧心肌细胞凋亡而发挥保护作用,其机制与靶向调控HMGB1的表达有关,将可为心血管疾病的治疗奠定基础,提供新靶点。

