环状RNA hsa_circ_0058514在三阴性乳腺癌中的表达及作用研究
杨 睿,陈俊霞
重庆医科大学细胞生物学与遗传学教研室,重庆 400016
乳腺癌是严重威胁全球女性健康的肿瘤,占全部女性恶性肿瘤的23%。随着医疗技术的不断发展,在发达国家中乳腺癌的病死率有所下降,但是在世界范围内其发病率仍在不断上升,乳腺癌仍是因癌症导致女性死亡的主要原因[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)均为阴性的一类乳腺癌,占全部乳腺癌的10%~20%。TNBC多发生于年轻女性(<40岁),侵袭性强,复发和转移率高,是一种高危乳腺癌,其发病机制尚不清楚,迄今缺乏有效的治疗手段[2]。因此,迫切需要寻找诊断和治疗TNBC的新的生物标志物。非编码RNA(non-coding RNA,ncRNA)是近年来肿瘤研究的热点,许多非编码RNA在肿瘤中存在差异表达,在功能上起着致癌或抑癌基因的作用[3]。环状RNA(circular RNA,circRNA)是新近发现的具有重要调节潜能的非编码RNA,它不具有5'末端帽子和3'末端尾巴,呈闭合环状结构[4]。研究表明,环状RNA参与了肺癌、肝癌及结肠癌等多种肿瘤的发生、发展[5],但目前有关环状RNA在TNBC中的报道较少。本研究利用RNA测序(RNA sequencing,RNA-seq)对4对TNBC组织及癌旁组织进行分析,发现环状RNA hsa_circ_0058514在TNBC组织中高表达,hsa_circ_0058514来源于AGFG1基因的第2到第5个外显子,经剪接后形成长度为527 nt的环状转录本,目前尚未见有关hsa_circ_0058514的报道。本研究进一步通过转染干扰质粒下调hsa_circ_0058514的表达,探讨其在TNBC增殖、迁移、侵袭、细胞凋亡和周期中的作用,为寻找TNBC诊断和治疗新靶点提供理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞株和组织标本
TNBC细胞MDA-MB-231、BT-549和正常人乳腺上皮细胞MCF-10A由重庆医科大学分子医学与肿瘤研究中心保存。本研究中的20例TNBC组织和癌旁组织来自重庆医科大学附属第一医院,20例患者均为女性,平均年龄(51.40±9.10)岁,其中非特殊型癌16例,髓样癌3例,化生性癌1例,TNM分期:Ⅰ期9例,Ⅱ期10例,Ⅲ期1例。所有患者均签署知情同意书,所有标本经过严格的病理诊断,并在手术后立即投入液氮中,标本的收集均得到重庆医科大学伦理委员会的批准。
1.1.2 主要试剂
培养基DMEM购自美国Gibico公司;MEBM培养基套装购自瑞士Lonza公司;胎牛血清(fetal bovine serum,FBS)购自重庆博全生物科技有限公司;hsa_circ_0058514干扰质粒pLL3.7-shcirc和对照质粒pLL3.7-sh-nc由广州吉赛生物科技股份有限公司合成;转染试剂LipofectamineTM2000购自美国Invitrogen公司;反转录试剂盒和TB Green购自宝生物工程(大连)有限公司;Cell-LightTMEdU Apollo567In VitroKit购自广州锐博生物科技有限公司;Transwell小室购自美国Millipore公司;Matrigel基质胶购自美国BD Biosciences公司;细胞计数试剂盒(cell counting kit-8,CCK-8)购自武汉博士德生物工程有限公司;兔抗人细胞周期蛋白E1(cyclin E1,CCNE1)和细胞周期蛋白依赖性激酶2(cyclindependent kinase 2,CDK2)购自英国Abcam公司。
1.2 方法
1.2.1 RNA测序
提取4对TNBC组织及癌旁组织总RNA,Nanodrop检测总RNA的纯度,利用Agilent 2100 Bioanalyzer检测RNA完整度,质检合格后进行下一步实验。RNA测序文库的构建、上机测序及差异基因分析均由广州吉赛生物科技股份有限公司提供技术服务。
1.2.2 细胞培养及转染
TNBC细胞MDA-MB-231和BT-549均使用含10%FBS的DMEM培养基,正常人乳腺上皮细胞使用MEBM培养基,3株细胞均在37 ℃、CO2体积分数为5%的条件下培养。将TNBC细胞接种到6孔板中,待细胞汇合度达到70%时,使用LipofectamineTM2000按照说明书对细胞进行质粒转染,48 h后收获细胞。
1.2.3 实时荧光定量聚合酶链反应(real-time fuorescent quantitative polymerase chain reaction,RTFQ-PCR)
用TRIzol法提取TNBC组织和癌旁组织以及正常人乳腺上皮细胞MCF-10A和TNBC细胞MDA-MB-231和BT-549总RNA,琼脂糖凝胶电泳判断提取RNA的完整性,酶标仪检测其浓度和纯度。按照反转录试剂盒说明书将RNA反转录为cDNA。利用美国Bio-Rad公司的RTFQ-PCR仪进行RTFQ-PCR。hsa_circ_0058514上游引物序列:5'-CCAG T T G TA G G T C G T T C T C A A G-3',下游引物序列:5'-G G AT T TA AT C C T C G C CTGCATG-3';GAPDH上游序列:5'-GAAGGT GAAGGTCGGAGTC-3',下游引物序列:5'-GAAGATGGTGATGGGATTTC -3'。以cDNA为模板,GAPDH为内参,扩增条件为:95 ℃预变性3 min;95 ℃ 5 s变性,60℃ 30 s退火,72 ℃30 s延伸,重复40个循环。每个样品设置3个复孔,用2-△△Ct法计算基因表达量,实验重复3次。
1.2.4 质粒构建
以全基因合成法分别合成s h-c i r c(5'GTTAACATGCAGGCGAGGATTAAATTC AAGAGATTTAATCCTCGCCTGCATTT TTTTCTCGAG3')和sh-nc(5'-TTCTCCGAACG TGTCACGTTCAAGAGACGTGACACG TTCGGAGAATTTTTT-3'),分别在5'端加入HpaI酶切位点,3'端加入XhoI酶切位点,目的片段双酶切后连接入pLL3.7载体中。载体构建完成后经测序鉴定。
1.2.5 CCK-8和EdU实验检测细胞增殖
细胞转染48 h后,将各组细胞制成密度为1×104/mL的细胞悬液,每孔100 μL接种到96孔板中,在温箱内37 ℃、CO2体积分数为5%的条件下培养24、48、72和96 h后每孔加入10 μL CCK-8溶液并混匀,再将细胞放入温箱温育2 h,用酶标仪测定450 nm处的吸光度(D)值,每组设置3个复孔。根据Cell-LightTMEdU Apollo567In VitroKit试剂盒说明书对细胞进行固定、Apollo染色及DNA染色,最后在荧光显微镜下拍照。
1.2.6 划痕实验检测细胞迁移
细胞转染48 h后,待各组细胞融合度达到95%左右时,用200 µL的枪头进行划痕,换无血清培养基培养24 h后于倒置显微镜下观察,0 h划痕距离与24 h划痕距离的差值即为细胞的相对迁移能力。
1.2.7 Transwell小室实验检测细胞侵袭
将BD基质胶与不含血清的DMEM培养基按1∶8进行稀释,取50 µL基质胶稀释液包被Transwell小室的上室面,4 ℃风干过夜。用不含血清的DMEM培养基将转染48 h后的各组细胞制成密度为2.5×105/mL的细胞悬液,每孔200 µL接种到Transwell小室的上室中,下室加入500 µL含10%FBS的DMEM培养基。常规培养24 h后,用棉签轻轻擦去基质胶和上室中的细胞,甲醇固定20 min,0.1%结晶紫染色10 min,光镜下随机选取3个视野进行细胞计数。
1.2.8 流式细胞术检测细胞凋亡
收集转染48 h的各组细胞,用PBS洗3次,以1 000 r/min离心5 min后弃上清,用Annexin结合液重悬细胞,加入10 µL的Annexin V-PE室温避光温育15 min,使用流式细胞仪检测细胞凋亡。
1.2.9 流式细胞术检测细胞周期
收集转染48 h的各组细胞,PBS洗3次,用70%的乙醇于4 ℃固定过夜。以1 000 r/min离心5 min后吸除乙醇,加入PBS洗涤,再加入0.5 mL的聚酰亚胺溶液(50 µg/mL)室温避光温育30 min,使用流式细胞仪检测细胞周期分布。
1.2.10 蛋白质印迹法(Western blot)检测蛋白表达
细胞转染48 h后,收集各组细胞,加入RIPA裂解液后提取各组细胞总蛋白,然后每孔按30 µg进行上样,经12%聚丙烯酰胺凝胶恒压80 V电泳分离后恒流250 mA转移至PVDF膜上,然后用5%脱脂奶粉常温慢摇封闭2 h,4 ℃下温育一抗(兔抗GAPDH 1∶5 000,CCNE1 1∶1 000,CDK2 1∶1 000)过夜,37 ℃下温育羊抗兔二抗(1∶5 000)2 h,ECL化学发光显色,Bio-Rad凝胶成像仪内拍照,并用Quantity One对图像进行分析。
1.3 统计学处理
采用SPSS 19.0和GraphPad Prism 5.0进行数据分析和作图,两样本均数比较采用t检验,多组均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 hsa_circ_0058514在TNBC组织和TNBC细胞中高表达
应用RNA-seq对4对TNBC组织和癌旁组织进行测序并做差异表达分析,发现47个环状RNA的表达上调,307个环状RNA表达下调。其中hsa_circ_0058514在TNBC中上调倍数最高,上调倍数为15.04倍(图1)。RTFQ-PCR检测20对TNBC组织和癌旁组织以及正常人乳腺上皮细胞MCF-10A和TNBC细胞MDA-MB-231和BT-549中hsa_circ_0058514的表达,结果显示,hsa_circ_0058514在TNBC组织中的表达(5.15±2.15)显著高于癌旁组织(2.26±1.49)(P<0.0 5,图2 A),其在T N B C细胞MDA-MB-231和BT-549中的表达分别为7.35±0.86和5.04±0.54,均明显高于正常乳腺上皮细胞MCF-10A(1.00±0.03)中的表达(P<0.001,图2B)。
2.2 hsa_circ_0058514干扰质粒效率验证
pLL3.7-sh-circ和pLL3.7-sh-nc质粒构建后经测序鉴定,结果显示,测序峰图正常,序列吻合,表明sh-circ和sh-nc的序列成功插入pLL3.7载体中(图3A)。将pLL3.7-sh-circ和pLL3.7-sh-nc转染MDA-MB-231和BT-549细胞后,RTFQ-PCR检测细胞中hsa_circ_0058514的表达量,结果显示,转染pLL3.7-sh-circ的细胞中hsa_circ_0058514的表达量显著低于对照组(P<0.001,图3B)。
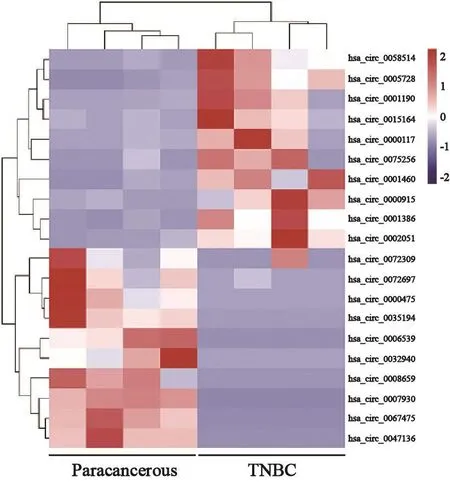
图 1 TNBC组织和癌旁组织中部分差异表达的circRNA热图Fig. 1 Heat map of differentially expressed circRNAs in TNBC tissues and paracancerous tissues
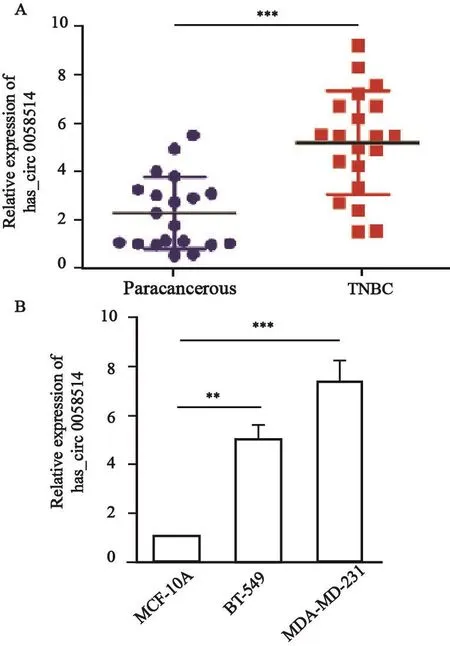
图 2 RTFQ-PCR检测hsa_circ_0058514在TNBC组织和TNBC细胞中的表达Fig. 2 The relative expression of hsa_circ_0058514 in TNBC tissues (A) and cells (B) was detected by RTFQ-PCR**: P<0.01; ***: P<0.001
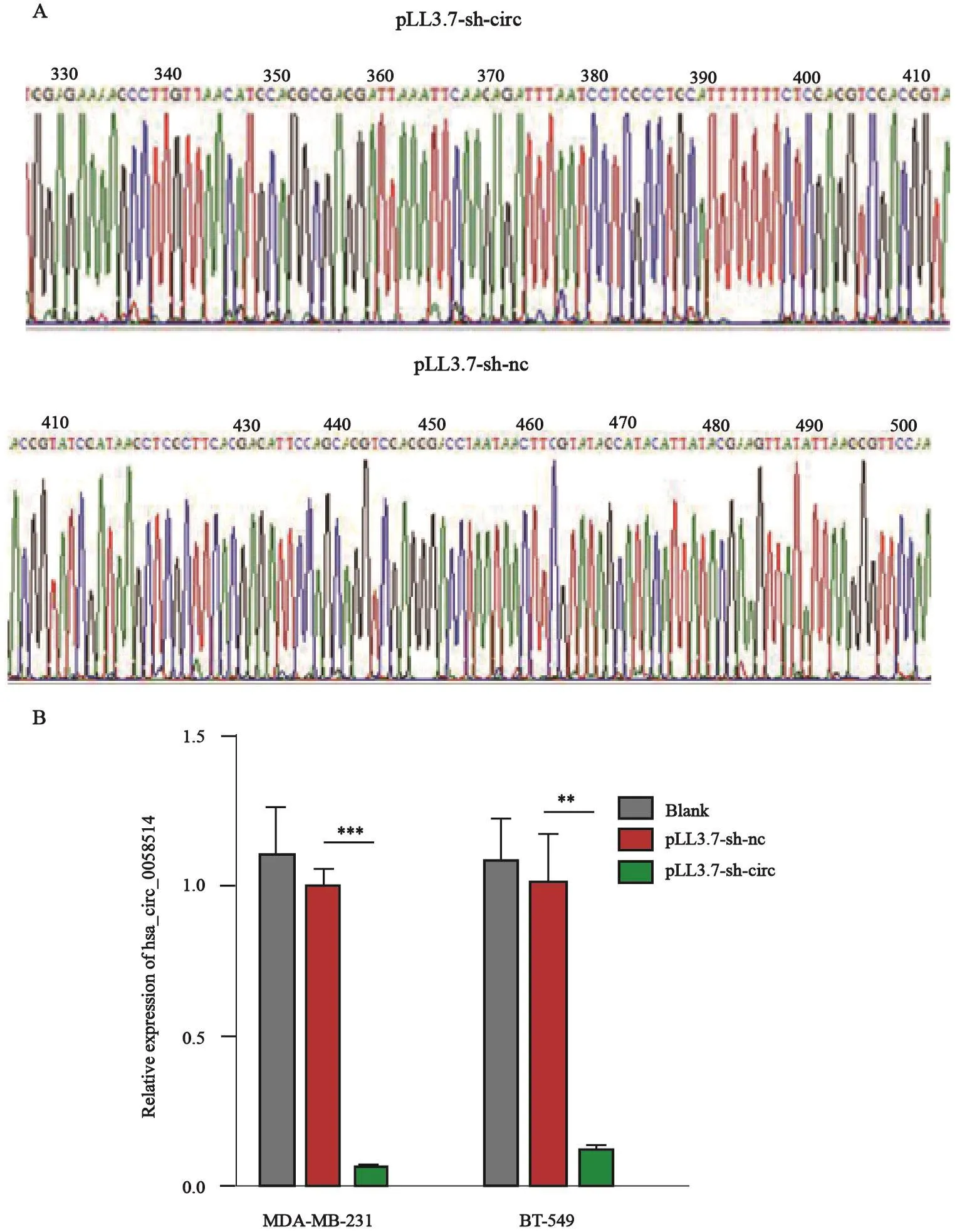
图 3 质粒鉴定及效率验证Fig. 3 Plasmid identification and efficiency verification
2.3 下调hsa_circ_0058514对TNBC细胞增殖的影响
将pLL3.7-sh-nc和pLL3.7-sh-circ转染MDA-MB-231和BT-549细胞后,采用CCK-8和EdU实验分别检测其增殖能力。CCK-8实验结果显示,连续观察96 h后,MDA-MB-231干扰组细胞D450为0.87±0.01,对照组D450为1.25±0.02,BT-549干扰组细胞D450为1.22±0.07,对照组D450为1.65±0.09(图4A),提示下调hsa_circ_0058514显著抑制TNBC细胞增殖。EdU实验结果显示,MDA-MB-231干扰组细胞增殖率为37.17±2.52,对照组细胞增殖率为52.13±4.21,BT-549干扰组细胞增殖率为30.05±2.90,对照组细胞增殖率为58.88±3.18(图4B、C),表明下调hsa_circ_0058514后,TNBC细胞的增殖能力明显降低。

图 4 下调hsa_circ_0058514对TNBC细胞增殖能力的影响Fig. 4 Effects of down regulation of hsa_circ_0058514 on the proliferation of triple-negative breast cancer cells
2.4 下调hsa_circ_0058514对TNBC细胞迁移及侵袭能力的影响
将pLL3.7-sh-nc和pLL3.7-sh-circ转染MDAMB-231和BT-549后,利用划痕和Transwell小室实验分别检测其迁移和侵袭能力。划痕实验结果显示,MDA-MB-231细胞转染pLL3.7-sh-circ后,迁移距离为(2.87±0.35)mm,而对照组细胞迁移距离为(1.70±0.26)mm,BT-549细胞转染pLL3.7-sh-circ后,迁移距离为(2.20±0.40)mm,对照组细胞迁移距离为(3.13±0.35)mm(图5A、B),表明下调hsa_circ_0058514能够显著抑制细胞迁移能力。Transwell小室实验结果显示,MDA-MB-231干扰组细胞穿膜数量为(64.67±12.22)个/视野,而对照组细胞穿膜数量为(30.67±5.51)个/视野,BT-549干扰组细胞穿膜数量为(44.33±10.07)个/视野,对照组细胞穿膜数量为(104.00±8.54)个/视野(图5C、D),说明下调hsa_circ_0058514能够显著抑制细胞的侵袭能力。

图 5 下调hsa_circ_0058514对TNBC细胞迁移及侵袭能力的影响Fig. 5 Effects of downregulation of hsa_circ_0058514 on the migration and invasion of triple-negative breast cancer cells
2.5 下调hsa_circ_0058514对TNBC细胞凋亡的影响
TNBC细胞MDA-MB-231分别转染pLL3.7-sh-nc和pLL3.7-sh-circ后,采用流式细胞术对两组细胞的凋亡率进行检测。结果显示,干扰组细胞凋亡率为10.35%±1.39%,而对照组凋亡率为3.60%±0.80%,差异有统计学意义(P<0.01,图6),表明下调hsa_circ_0058514可促进细胞凋亡。
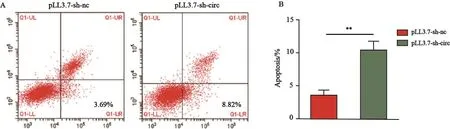
图 6 下调hsa_circ_0058514对TNBC细胞凋亡的影响Fig. 6 Effects of downregulation of hsa_circ_0058514 on apoptosis of triple-negative breast cancer cells
2.6 下调hsa_circ_0058514对TNBC细胞周期的影响
T N B C细胞M D A-M B-2 3 1分别转染pLL3.7-sh-nc和pLL3.7-sh-circ后,应用流式细胞术分析细胞周期分布。结果显示,干扰组细胞G1期为73.93%±1.24%,对照组细胞G1期为63.97%±3.19%。干扰组细胞S期为19.61%±1.07%,而对照组细胞S期为28.13%±2.77%,表明下调hsa_circ_0058514将细胞周期阻滞于G1期(P<0.05,图7)。
2.7 下调hsa_circ_0058514对CCNE1和CDK2蛋白表达的影响
将pLL3.7-sh-nc和pLL3.7-sh-circ转染MDA-MB-231和BT-549细胞48h后提取蛋白,用Western blot检测CCNE1和CDK2蛋白水平。结果显示,与对照组相比,下调hsa_circ_0058514后,CCNE1和CDK2蛋白水平均显著下调(P<0.05,P<0.001,图8)。
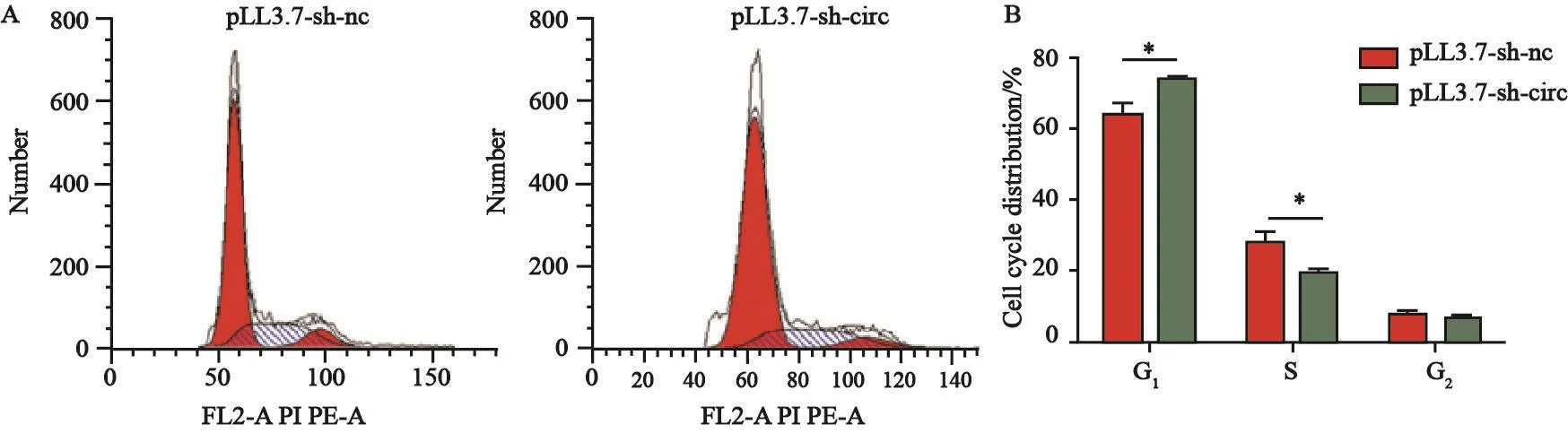
图 7 下调hsa_circ_0058514对TNBC细胞MDA-MB-231细胞周期的影响Fig. 7 Effects of downregulation of hsa_circ_0058514 on cell cycle of triple-negative breast cancer cells MDA-MB-231
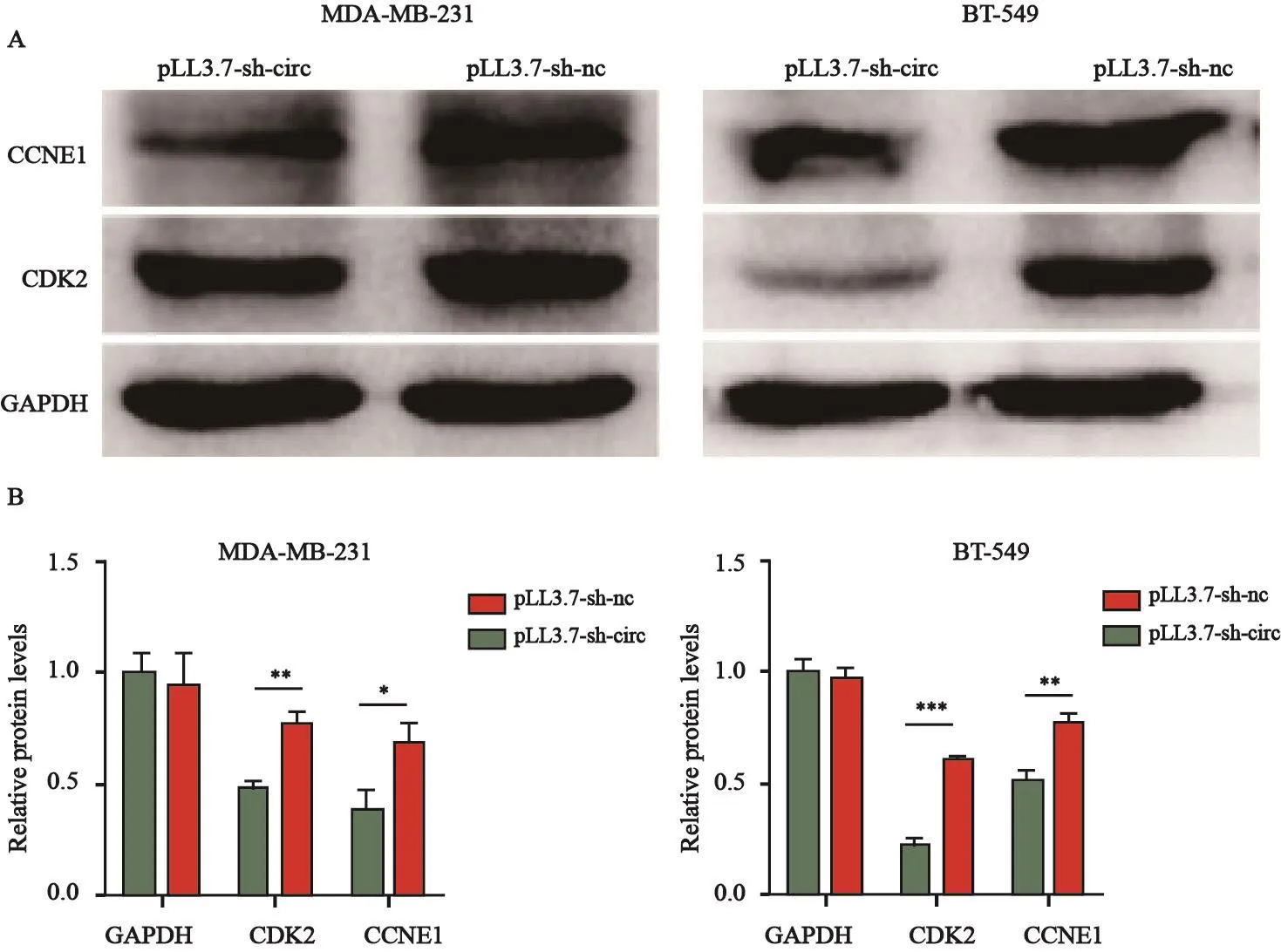
图 8 下调hsa_circ_0058514对TNBC细胞蛋白表达的影响Fig. 8 Effects of downregulation of hsa_circ_0058514 on protein levels of triple-negative breast cancer cells
3 讨 论
TNBC作为乳腺癌的一个独特的亚型,具有更高的复发率、转移率及死亡率。由于不表达ER、PR和HER2,TNBC患者不能从抗HER2靶向治疗和内分泌治疗中获益,化疗是临床上常用的治疗手段[6],与其他亚型的乳腺癌相比,虽然TNBC对化疗更加敏感,但是由于耐药性,化疗的应用也受到限制。因此,寻找诊断和治疗TNBC的新的生物标志具有重要意义。
ncRNA在肿瘤的发生、发展中具有重要作用。近年来随着生物信息学和RNA-seq技术的发展和应用,circRNA作为ncRNA家族的新成员出现在研究者的视线中。由于其特殊的环状结构,使环状RNA具有较高的稳定性,研究还发现环状RNA广泛存在于真核生物的细胞内,并且其表达具有细胞和组织特异性以及时空特异性[7-8],因此,circRNA的研究具有非常重要的意义。有研究报道,circRNA与多种肿瘤密切相关,如肝癌、肺腺癌、膀胱癌、胃癌及乳腺癌等[9-13]。Tang等[14]采用芯片技术得到了乳腺癌组织和癌旁组织中差异表达的circRNA,用RTFQ-PCR证实了circRNA hsa_circ_0001982在乳腺癌组织中高表达,通过系列功能实验证明hsa_circ_0001982能够促进乳腺癌的发生、发展。还有研究发现,circRNA-000911在乳腺癌中低表达,过表达circRNA-000911后能够显著抑制乳腺癌细胞增殖,提示circRNA-000911有望成为乳腺癌诊断和治疗的靶点[15]。
在本研究中,我们首先利用RNA高通量测序分析了4对TNBC组织及癌旁组织,获得了circRNA的差异表达谱,并进一步利用RTFQ-PCR技术证实了circRNA hsa_circ_0058514在TNBC组织和TNBC细胞中均呈高表达。然后我们针对hsa_circ_0058514成功构建了干扰质粒,接着通过一系列的体外实验表明,下调hsa_circ_0058514后,能够显著降低TNBC细胞的增殖、迁移及侵袭能力,并促进细胞凋亡。同时,转染干扰质粒的TNBC细胞与对照组相比,干扰组细胞G1期百分率明显上升,而S期百分率显著下降,表明下调hsa_circ_0058514可使细胞周期阻滞在G1期,从而降低了细胞分裂的速度。最后通过Western blot证明,hsa_circ_0058514可以调节CCNE1和CDK2蛋白的表达。众所周知,CCNE1通过与CDK2形成复合体发挥作用,CCNE1-CDK2复合物在G1/S期转导中具有重要作用。研究表明,CCNE1的过度表达与多种肿瘤的发生密切相关,包括肺癌、膀胱癌、皮肤癌及乳腺癌等[16],并且CCNE1是乳腺癌预后的一个标志物,其表达量与肿瘤的分级和分期呈正相关[17]。在本研究中,下调hsa_circ_005814后,CCNE1和CDK2蛋白表达显著下调,表明hsa_circ_0058514可影响CCNE1-CDK2的表达来调节细胞周期进程,进而调控TNBC的发生、发展。
综上所述,circRNA hsa_circ_0058514下调后能够抑制TNBC细胞增殖、迁移及侵袭,并促进细胞凋亡,导致细胞周期阻滞,提示hsa_circ_0058514有望成为TNBC治疗的新靶点。
——一道江苏高考题的奥秘解读和拓展

