AJCC第7版与第8版分期对乳腺癌患者预后预测的比较分析
张凤春,左 丽,马 越,刘照南,闫宁宁,徐海燕,徐迎春
1.上海交通大学医学院附属苏州九龙医院肿瘤科,江苏 苏州 215021;
2.上海交通大学医学院附属瑞金医院肿瘤科,上海 200025;
3.复旦大学附属肿瘤医院闵行分院肿瘤科,上海 200240;
4.上海交通大学医学院附属仁济医院肿瘤科,上海 200127
乳腺癌是女性最常见的肿瘤,在女性癌症相关性死亡中占第2位[1]。合理的分期是临床治疗方案选择和预后判断的基础,2016年10月6日美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版癌症分期系统更新出版,并确定于2018年1月1日在全球启动执行,相对于第7版肿瘤(tumor,T)、淋巴结(node,N)、转移(metastasis,M)的TNM分期,新版乳腺癌分期在解剖学信息基础上首次建立预后分期理念,即结合肿瘤组织学分级(histologic grade,G)、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子-2(human epidermal growth factor receptor-2,HER-2)和21-基因(Oncotype Dx®)等的多基因检测,对预后进行评价。预后分期是本次分期系统更新最重要的亮点[2](表1)。本研究通过回顾性分析222例复发转移性乳腺癌患者初诊时的临床病理资料,比较AJCC第7版和第8版预后分期的不同及其对预后的预测能力,验证其在中国乳腺癌患者中的预后评估价值。
1 资料和方法
1.1 临床资料
收集上海交通大学医学院附属仁济医院肿瘤科2017年1月—2017年12月收治的临床及病理资料完整的复发转移性乳腺癌病例,按下列标准选取研究对象: ① 经组织病理学诊断为乳腺癌;② 行乳腺癌原发病灶根治性切除手术+前哨淋巴结活检或淋巴结清扫;③ 术后经过规范的系统性治疗后出现局部复发或远处转移。排除标准:① 没有完整临床和病理资料;② 围手术期死亡;③ 术前应用新辅助治疗;④ 无确切复发转移时间。组织学分级采用改良的Nottingham分级系统;ER、PR表达状态免疫组织化学测量≥1%细胞染色为阳性;HER-2表达状态参照2013年美国临床肿瘤学会/美国病理学家协会指南。最终222例乳腺癌患者纳入本研究,其中患者初诊时中位年龄为(51.77±10.77)岁(26~82岁);≤35岁11例,>35岁211例;绝经前123例,绝经后99例。按照手术方式分类,乳腺扩大根治术4例,标准根治术27例,改良根治术170例,保乳手术21例。按照病理类型分类,浸润性导管癌202例,浸润性小叶癌10例,黏液癌2例,神经内分泌癌、化生性鳞状细胞癌、腺样囊性癌和浸润性筛状癌各1例,另有混合癌4例(浸润性导管癌+黏液癌2例;浸润性导管癌+浸润性小叶癌2例)。组织学分级为高分化G1组7例,中分化G2组103例,低分化G3组112例。肿瘤大小T1期85例,T2期115例,T3期17例,T4期5例;无淋巴结转移者80例,有淋巴结转移患者中,N1期61例,N2期41例,N3期40例。ER阳性126例,PR阳性113例,HER-2阳性71例,Ki-67阳性143例。中位随访时间为46.43个月。208例患者接受以蒽环±紫杉醇类为基础的辅助化疗,98例患者接受辅助放疗,106例患者接受辅助内分泌治疗,31例患者接受曲妥珠单抗辅助靶向治疗。全部患者经术后系统性辅助治疗后出现复发转移,骨及软组织转移127例,内脏转移48例,兼有软组织及内脏转移者47例。
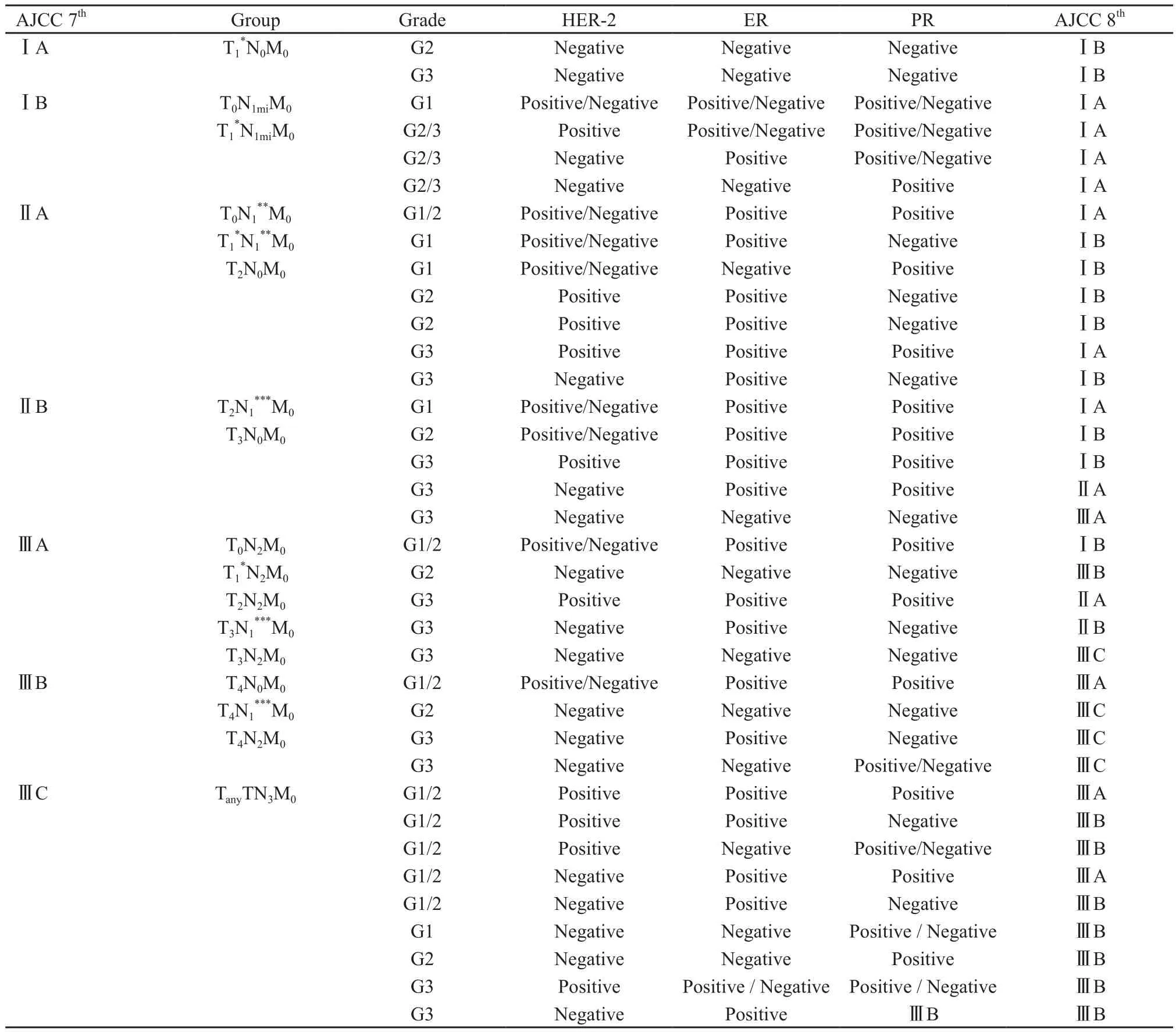
表 1 AJCC第7版解剖分期与第8版预后分期的差异Tab. 1 The difference between the pathologic anatomic staging system of AJCC 7th edition and the pathologic prognostic staging groups of AJCC 8th edition
1.2 研究方法
将222例乳腺癌患者按照AJCC第7版和第8版预后分期进行重新分期,分别计算两版各期占比及第7版分期向第8版分期变化,通过生存分析进行各分期与无病生存期(disease-free survival,DFS)比较。
1.3 统计学处理
采用SPSS 19.0软件进行统计分析。计数资料采用χ2检验,生存分析采用Kaplan-Meier生存曲线,log-rank检验进行组间生存率比较。P<0.05为差异有统计学意义。
2 结 果
2.1 第7版和第8版TNM分期及改变
按照AJCC第7版病理解剖分期标准,ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB和ⅢC期患者分别为34例(15.3%)、0例(0.0%)、73例(32.9%)、26例(11.7%)、45例(20.3%)、4例(1.8%)和40例(18.0%);按照AJCC第8版病理预后分期标准,ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB和ⅢC期的患者分别为47例(21.2%)、35例(15.8%)、55例(24.8%)、17例(7.7%)、25例(11.3%)、30例(13.5%)和13例(5.9%),构成变化明显,差异有统计学意义(P=0.000,表2)。
分期变化主要有:第7版Ⅰ期34例,结合分级、ER、PR和HER-2,细分为第8版ⅠA期27例和ⅠB期7例,上调20.6%;第7版ⅡA期73例细分为第8版ⅠA期19例、ⅠB期9例和ⅡA期45例,下调38.3%;ⅡB期26例细分为第8版ⅠA期1例、ⅠB期6例、ⅡA期6例、ⅡB期10例和ⅢA期3例,上调11.5%,下调50.0%;第7版ⅢA期45例细分为第8版ⅠB期13例、ⅡA期4例、ⅡB期7例、ⅢA期14例、ⅢB期4例和ⅢC期3例,上调15.6%,下调53.4%;第7版ⅢB期细分为第8版ⅢA期1例、ⅢB期2例和ⅢC期1例,上调和下调均为25.0%。第7版ⅢC期40例细分为第8版ⅢA期7例、ⅢB期24例和ⅢC期9例,下调77.5%。分期上调18例(8.1%),下调97例(43.7%),上调比例最高为ⅢB期,下调比例最高为ⅢC期77.5%(表2)。
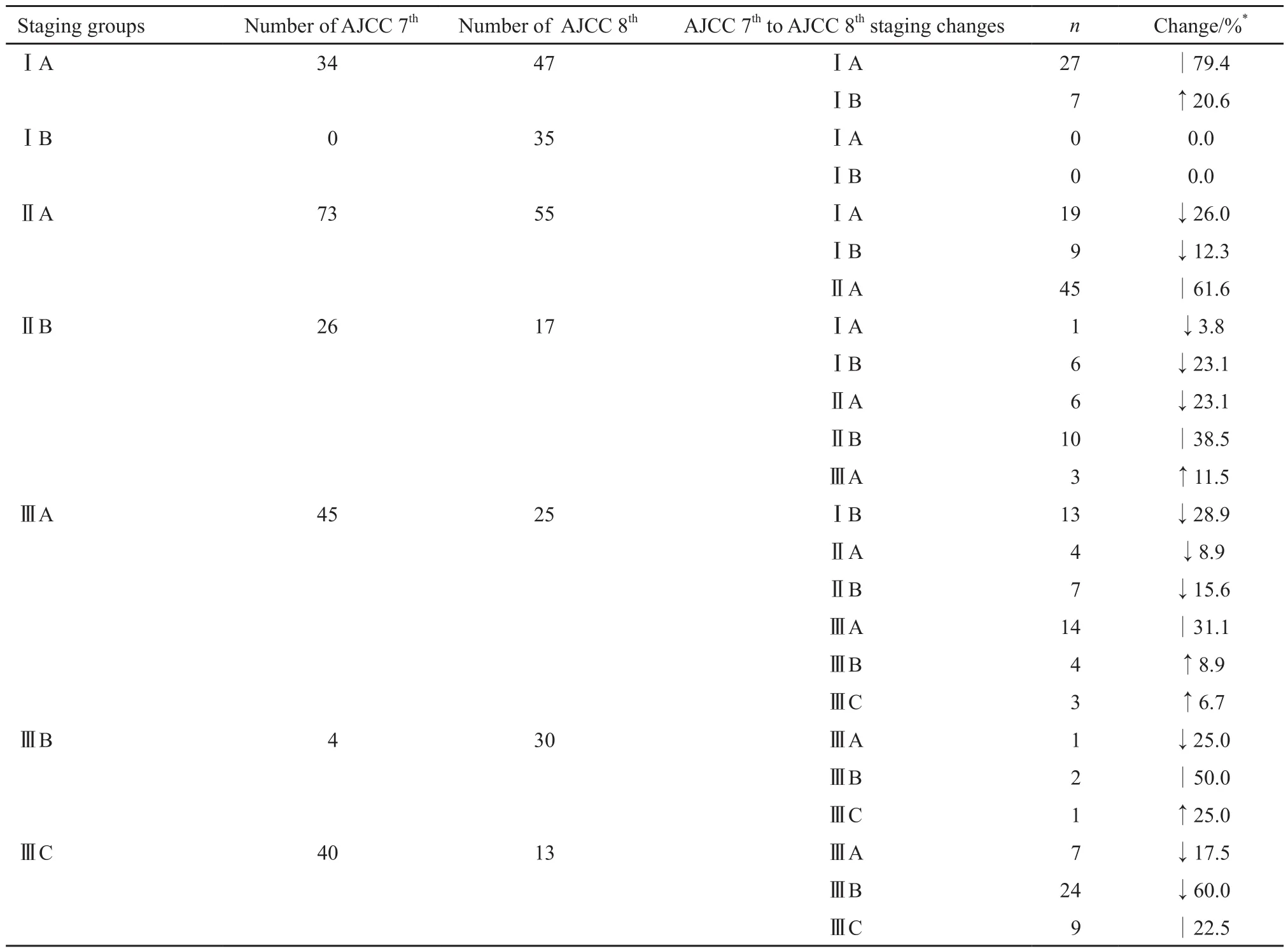
表 2 AJCC第7版分期经预后标志物调整后向第8版分期迁移变化(N=222)Tab. 2 Changes of staging groups from AJCC 7th edition anatomic staging system to AJCC 8th edition pathologic prognostic staging system(N=222)
2.2 生存分析
第7版TNM分期和第8版预后分期的生存分析见表3和图1。单因素分析结果显示,无论参考第7版TNM分期还是第8版预后分期,分期均与DFS显著相关,高分期的亚组DFS明显缩短(P<0.050);第8版预后分期Ⅲ期组内DFS更加精确,ⅢB期的DFS高于ⅢC期组,而第7版Ⅲ期组内比较ⅢB期的DFS反而低于ⅢC期组,明显与实际状况不相符,故第8版TNM预后分期组内评估更为准确。

表 3 AJCC第7版和第8版分期分布及DFS比较Tab. 3 The DFS according to the distribution of the 7th and 8th edition of AJCC TNM staging systems
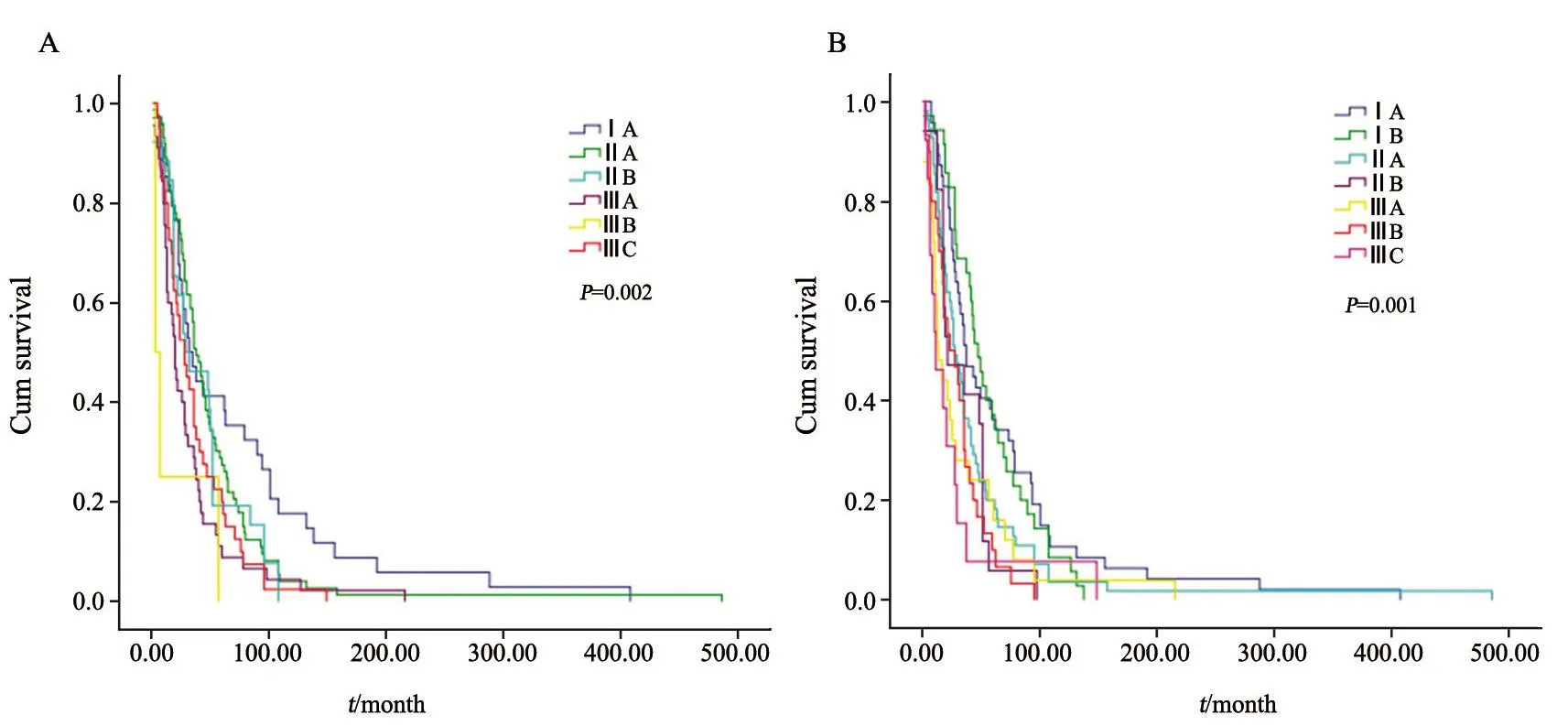
图 1 AJCC第7版和第8版分期DFS生存曲线差异Fig. 1 Survival curves of DFS according to AJCC 7th and 8th staging systems
3 讨 论
AJCC癌症分期系统是目前世界范围内恶性肿瘤临床诊治及研究的重要参考,是以解剖学TNM为基础的分期体系。然而生物学标志物和多基因检测对于乳腺癌具有极其重要的临床意义,相同临床分期的乳腺癌患者预后可能截然不同。AJCC第8版乳腺癌分期系统大篇幅增加结合肿瘤生物学信息的非解剖学信息内容,提出解剖学和预后分期概念,前者是依据肿瘤解剖范围定义进行的TNM分期系统;后者为基于生物标志物(HER-2、ER和PR)表达情况及多基因检测在内的分期系统;并提出首选预后分期,只在没有条件获取生物标志物信息的地区,仍采用解剖学分期作为分期标准[3]。故预后分期是在传统解剖学分期基础上的完善和补充,具体涉及分期调整的标准参照表1。本组患者以AJCC第7版和第8版预后分期为依据,比较了在中国乳腺癌患者中两个版本分期在实际临床工作中可能带来的差异和临床意义。
文献复习发现,与解剖学分期相比,预后分期所增加的生物学信息使细化分期成为可能,也会导致各个分期比例明显变化。Wang等[4]研究发现,74%的局部晚期乳腺癌分期改变,其中60.4%分级为3级和68.3%的三阴性乳腺癌分期上调,而57.1%的ER、PR双阳性患者分期下调。美国学者Weiss等[5]的研究提示预后分期与解剖分期相比,预后分期变化率高达57.6%,29.5%~31.0%的患者的分期上调,20.6%~28.1%的患者分期比例下调;国内学者Hu等[6]收集了784例乳腺癌术后患者的临床资料,解剖学Ⅰ、Ⅱ和Ⅲ期占比依次为24.0%、51.0%和22.5%;预后分期变化率高达64.4%,其中解剖学Ⅰ、Ⅱ和Ⅲ期迁移至预后分期变化率分别为33.5%、73.8%和72.7%。Zhou等[7]收集了170例HER-2过表达乳腺癌患者,预后分期变化率高达68.8%,其中68.2%分期上调,下调比例为0.6%。笔者以AJCC第7版及第8版对本组乳腺癌解剖学分期和预后分期进行对比分析,重新分期后各亚分期构成变化明显,差异有统计学意义(P=0.000);222例患者中,解剖学Ⅰ、Ⅱ和Ⅲ期占比依次为15.3%、44.6%和40.1%,预后分期总体变化率51.8%,与美国学者报道相近,低于国内学者报告,考虑可能与入组患者人群解剖学分期差异有关,本组患者Ⅲ期比例明显高于文献报道。总体而言,本组上调分期18例(8.1%),下调97例(43.7%),例如针对T1N0M0、组织学分级2~3分及三阴性乳腺癌,其预后分期升级评价为ⅠB期,所以第7版IA期34例细分为第8版ⅠA期27例和ⅠB期7例,分期上调了20.6%;Ⅱ期患者中变化最大为ⅡB期,上调比例为11.5%,下调比例为50.0%;再例如全部患者中,上调比例最高为ⅢB期的25.0%,下调比例最高为ⅢC期的77.5%,均出现于Ⅲ期亚组;解剖学Ⅰ、Ⅱ和Ⅲ期组内迁移变化率与既往报道相符,提示不同的分期系统对于同一组患者评价确实存在显著差异。
来源于美国国立癌症研究所监测、流行病学和结果数据库(Surveillance, Epidemiology, and End Results,SEER)研究资料显示,第8版TNM预后分期之间生存率差异有统计学意义[4]。Xu等[8]研究入组了796例乳腺癌患者,49例随访获得DFS终点数据,研究结果提示解剖学和预后分期均具有预测价值,在Ⅲ期亚组中预后分期改变与DFS相关。本研究中,按照第7版解剖分期、8版病理预后分期DFS差异有统计学意义(P=0.000),与既往报道相符,但相邻两个亚期比较,DFS差异无统计学意义,但对Ⅲ期组内患者的DFS进行分析发现,预后分期纠正了7版ⅢB期的DFS反而低于ⅢC期组的明显与事实不符合状况;提示上述解剖学分期向预后分期的迁移变化充分体现生物学标志物对于预后分析的重要地位,并为临床医师选择治疗方案提供了新的参考。这是国内首次运用复发转移乳腺癌患者的初诊数据,按照第8版病理预后分期系统进行中国乳腺癌患者的临床分期的回顾性研究,以DFS作为预后分析终点,全部222例患者均达到研究终点,提示新的预后分期与生存关系更为紧密。需要注意的是由于国内多数患者未进行靶向治疗,而AJCC第8版预后分期系统对于HER-2评价的前提是在患者接受靶向治疗基础上进行的,与我们国情存在差异,所以其确切临床应用价值,仍期待后续应用预后分期具体指导临床实践的前瞻性研究进一步揭示。
乳腺癌的临床生物学、病理学及治疗反应等存在很大不同,是最早按照分子分型进行个体化治疗的实体肿瘤。在乳腺癌的研究中,最有代表性的是基因表达谱技术的应用。本版分期系统正式纳入了包括最有代表性的21基因检测、MammaPrint、EndoPredict、PAM-50及Breast Cancer Index在内的5种多基因检测预后分析技术[3],有助于在激素受体阳性、HER-2阴性及腋窝淋巴结阴性患者中进一步筛选出预后良好的低危患者,其代表的临床和生物学意义远大于基因检测本身。遗憾的是在我国尚未全面实现多基因检测,无论是检测技术标准化,还是规范化,都有待认证和完善,尚需临床医师的理性认知。由于本组患者无多基因检测数据,故本研究进行再分期评价时仅结合了病理学生物标志物,期待国内尽早建立多基因复发风险评估基因检测平台,使分期能够与国际接轨。
综上所述,第8版预后分期比第7版TNM解剖分期更加详细,能提供贴近临床的预后判断信息,是乳腺癌治疗的进步,可以更加准确地指导不同期患者的个体化治疗。

