卵巢癌中核因子-κB与血管内皮生长因子及IL-2的表达
罗浩,刘四清
(川北医学院附属第二医院妇产科,绵阳 621000)
卵巢癌是女性生殖器官常见的恶性肿瘤之一,卵巢癌的病死率在各类妇科肿瘤中较高。核因子-κB(NF-κB)是核转录调节因子,它在调控细胞增殖与凋亡的过程中发挥着重要作用,一般情况下,NF-κB在细胞胞浆中没有活性,当化疗药物、射线等因素刺激时,即发生磷酸化、泛素化,NF-κB随之活化并转位入核,调节靶基因的转录。目前,已有学者[1,2]提出 NF-κB及其信号通路是肿瘤治疗的一个策略。为此,本研究拟探讨NF-κB通道的激活及其与肿瘤血管形成的关系,现报道如下。
1 资料与方法
1.1 临床资料
收集本院2008年~2014年卵巢癌患者47例,年龄25~75岁。患者均接受了卵巢切除术,且均为首次发病,未接受过化疗、放疗及药物治疗。患者术后行病理检测,Ⅰ期组12例,Ⅱ期组20例,Ⅲ/Ⅳ期组15例,另选正常卵巢20例为对照组。所有患者在我院手术室切取标本后,立即在肿瘤组织处取1 cm×1cm×1cm大小组织块。
1.2 实验试剂与器材
NF-κB抗体、IL-2抗体、血管内皮生长因子(VEGF)抗体、SABC免疫组化染色试剂盒和DAB显色试剂盒等(所有试剂均购于上海研卉生物科技有限公司),Olympus光学显微镜、光学显微镜照相系统和Image-Pro Plus图像分析系统等。
1.3 免疫组织化学方法(SABC)测定 NF-κB、IL-2和VEGF的表达
采用SABC法,步骤简述如下:1)切片常规脱蜡至水,3%H2O2室温孵育5~10min,以消除内源性过氧化物酶的活性;2)蒸馏水冲洗,PBS浸泡5 min;3)用山羊血清封闭液封闭,室温孵育10min,倒去血清,0.02%PBS漂洗5min×3次;4)滴加一抗,其中P-JAK2(1∶500)、P-STAT3(1∶350)于4℃冰箱过夜,0.02%PBS漂洗5min×3次,再用PBS取代一抗用作空白对照;5)加入二抗,室温孵育20min,0.02%PBS漂洗5min×3次;6)滴加试剂SABC(1∶100),室温孵育2h,0.02%PBS漂洗5min×3次;7)DAB染色;8)自来水冲洗,苏木素轻度复染,然后进行脱水、透明和封片。
1.4 统计学方法
采用Image-Pro Plus 5.0软件分析 NF-κB、IL-2和VEGF蛋白阳性表达的累积光密度值(IOD),并计算平均值,以均数±标准差(±s)表示。采用SPSS 19.0统计软件进行统计分析,组间均数两两比较采用独立样本的t检验,取检验水准α=0.05。
2 结果
2.1 卵巢癌组织中 NF-κB、VEGF和IL-2蛋白的表达
对照组可见少量NF-κB、VEGF和IL-2蛋白的表达;与对照组比较,Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组NF-κB、VEGF和IL-2表达均增多(P<0.05);与Ⅰ期组比较,Ⅱ期组和Ⅲ/Ⅳ期组NF-κB、VEGF表达均增多(P<0.05),IL-2表达均减少(P<0.05);与Ⅱ期组比较,Ⅲ/Ⅳ期组NF-κB、VEGF表达增多(P<0.05),IL-2表达均减少(P<0.05)(见表1、图1)。
表1 各组NF-κB、VEGF和IL-2蛋白的表达(±s)
与对照组比较,▲P<0.05;与Ⅰ期组比较,★P<0.05;与Ⅱ期组比较,●P<0.05
20 0.75±0.14 1.47±0.69 0.62±0.29Ⅰ期组 12 35.79±1.99▲ 30.92±2.07▲ 54.39±2.63▲Ⅱ期组 20 64.94±1.09▲★ 48.20±4.31▲★ 41.84±2.29▲★Ⅲ/Ⅳ期组 15 85.08±1.39▲★● 65.67±3.12▲★● 20.51±1.65 B VEGF IL-2对照组分组 n NF-κ▲★●
2.2 Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组NF-κB与VEGF、IL-2表达的相关分析
Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组NF-κB与VEGF呈正相关(r=0.845,r=0.763,r=0.819,P<0.05),与IL-2呈负相关(r=-0.634,r=-0.781,r=-0.598,P<0.05)。
3 讨论
NF-κB是由大鼠B淋巴细胞核提取的一种能与免疫球蛋白K轻链增强子κB序列(GGGACTTTCC)特异性结合的核蛋白因子,它由NF-κB1(p50)、NF-κB2(p52)、RelB、RelA(p65)和c-Rel(Rel)组 成,其 中 NF-κB1 基 因 编 码 NF-κB1(p50),NF-κB2基因编码 NF-κB2(p52),RelA 基因编码 RelA(p65),REL基因编码c-Rel。NF-κB家族可分为两类:1)含转录激活的区域,它可正向调节基因的表达,包括p65(RelA)、c-Rel(Rel)、RelB;2)不含转录激活的区域,它的二聚体可抑制转录,包括NF-κB1(p50)、NF-κB2(p52)。NF-κB 转录调节因子在细胞的生存、增殖、分化和凋亡,蛋白酶的降解,免疫反应、炎症反应和应激反应以及氧化还原反应等方面 有转录 调节作 用[3-6]。通 常情况下,NF-κB与IκB或DNA结合为二聚体而存在,当多种因素刺激时,如细胞因子、病毒、双链ANA、氧化剂、细菌脂多糖、多种抗原和紫外线照射等,通过信号转导途径使IκB磷酸化,然后通过蛋白水解酶作用发生降解,使NF-κB活化发挥调控作用[7]。本实验研究结果显示:Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组NF-κB的表达均较对照组增多(P<0.05),说明卵巢癌患者瘤组织内NF-κB通道被激活;Ⅱ期组和Ⅲ/Ⅳ期组NF-κB的表达均较Ⅰ期组增多(P<0.05),Ⅲ/Ⅳ期组NF-κB的表达较Ⅱ期组增多(P<0.05),说明卵巢癌患者越到后期,NF-κB通道的表达越活跃。
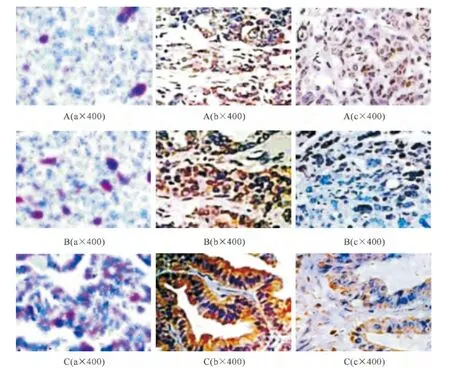
图1 免疫组化法检测 NF-κB、VEGF、IL-2蛋白的表达
国内外学 者[8,9]研究表 明,NF-κB 对血管 的 形成有重要调节作用。常见的血管生长因子有碱性成纤维母细胞生长因子(bFGF)、酸性成纤维母细胞生长因子、VEGF、血管生成素、转化生长因子α和β、肿瘤坏死因子α、血小板来源的内皮细胞生长因子、粒细胞集落刺激因子、胎盘生长因子、白细胞介素-8、肝细胞生长因子和增殖素等。血管抑制因子有血管抑素、内皮抑素、血小板因子-4、凝血栓蛋白、金属蛋白酶组织抑制剂、转化生长因子β、干扰素、胎盘增殖素相关蛋白、催乳素、bFGF溶解性受体蛋白、IL-2和可容性 VEGF受体(flt-1)等[10]。本实验研究表明:1)Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组的VEGF、IL-2表达较对照组均增多(P<0.05),说明卵巢癌组织中有血管的形成。2)Ⅱ期组和Ⅲ/Ⅳ期组VEGF的表达均较Ⅰ期组增多(P<0.05),IL-2的表达较Ⅰ期组均减少(P<0.05);Ⅲ/Ⅳ期组VEGF的表达较Ⅱ期组增多(P<0.05),IL-2的表达较Ⅱ期组均减少(P<0.05),说明卵巢癌组织中血管生长因子越到后期表达越多,而血管抑制因子越到后期表达越少。3)Ⅰ期组、Ⅱ期组和Ⅲ/Ⅳ期组NF-κB与 VEGF呈正相关(P<0.05),与IL-2呈负相关(P<0.05),说明卵巢癌相关蛋白 NF-κB可通过上调VEGF的表达及下调IL-2的表达共同调节肿瘤血管的生成。
[1]Davoudi Z,Akbarzadeh A,Rahmatiyamchi M,etal.Molecular Target Therapy of AKT and NF-κB Signaling Pathways and Multidrug Resistance by Specific Cell Penetrating Inhibitor Peptides in HL-60Cells[J].Asian Pac J Cancer Prev,2014,15(10):4353-4358.
[2]琚玲丽,刘惠宁.核转录因子NF-κB与妇科恶性肿瘤相关性的研究进展[J].现代妇产科进展,2013,22(2):157-159.
[3]Xu Y,Kong X,Zhou H,etal.oxLDL/β2GPI/anti-β2GPI complex induced macrophage differentiation to foam cell involving TLR4/NF-kappa B signal transduction pathway[J].Thromb Res,2014,5(20):3842-3848.
[4]Zhao Y,Wang CL,Li RM,etal.Wnt5aPromotes Inflammatory Responses Via Nuclear Factor kB(NF-κB)and Mitogen-activated Protein Kinase (MAPK)Pathways in Human Dental Pulp Cells[J].J Biol Chem,2014,6(2):466-470.
[5]宋思幽,吴英杰,李冬华.Raf激酶抑制蛋白、NF-κBp65及VEGF-C在卵巢上皮性肿瘤中的表达及相关性[J].中国临床研究,2013,26(6):525-528.
[6]Chuang YW,Chang WM,Chen KH,etal.Lysophosphatidic Acid Enhanced the Angiogenic Capability of Human Chondrocytes by Regulating Gi/NF-κB-Dependent Angiogenic Factor Expression[J].PLoS One,2014,9(5):95180-95185.
[7]Li J,Yan M,Wang Z,etal.Effects of Canonical NF-κB Signaling Pathway on the Proliferation and Odonto/Osteogenic Differentiation of Human Stem Cells from Apical Papilla[J].Biomed Res Int,2014,20(4):3196-3200.
[8]周勇,姚昶,高峰,等.黄芪多糖胶原干预周围组织中核因子κB与血管内皮细胞生长因子表达而促进毛细血管新生[J].中国组织工程研究,2012,16(7):1184-1187.
[9]Jegaskanda S,Ahn SH,Skinner N,etal.Down-regulation of IL-18mediated cell signalling and IFN-γexpression by the hepatitis B virus e antigen[J].J Virol,2014,5 (28):3556-3560.
[10]Jegaskanda S,Ahn SH,Skinner N,etal.Down-regulation of IL-18mediated cell signalling and IFN-γexpression by the hepatitis B virus e antigen[J].J Virol,2014,5 (28):3556-3560.

