宫颈癌微创和开腹根治性子宫切除术比较的前瞻性、多中心、随机对照临床试验
——LACC研究解读
【简评】
LACC研究是针对宫颈癌微创手术的一项大型前瞻性随机对照临床试验,由美国M.D.Anderson癌症中心牵头,全球共33家医疗机构参与了该试验,其中中国有3个中心,包括中山大学附属第一医院、浙江省肿瘤医院及温州医科大学附属第一医院,共同参与了这一国际多中心的临床试验。该研究显示,对于早期的宫颈癌患者(ⅠA1脉管阳性、ⅠA2及ⅠB1期),与开腹根治性子宫切除术相比,接受微创根治性子宫切除术的患者无病生存率(disease-free survival,DFS)和总生存率(overall survival,OS)均较低,局部区域复发率较高。
宫颈癌传统的手术方式是开腹根治性子宫切除术,至今已有100余年的历史。宫颈癌的微创手术从20世纪90年代开展至今,已有几十年的历史。既往的文献报道认为宫颈癌微创手术的肿瘤学结局与开腹手术无差异,但手术创伤小、恢复快。但本研究结果与既往研究结果完全不同。除了肿瘤学预后开腹组优于微创组之外,研究小组在2018国际妇科肿瘤学会(International Gynecologic Cancer Society,IGCS)会议上初步报道,开腹组和微创组的手术并发症和手术1周后的生活质量也并无差别。
目前认为微创手术预后较差的可能因素包括举宫器的使用、腔镜下环切阴道及术中CO2气腹的使用等,但具体是何种原因需要进一步的研究证实。
值得注意的是,本研究中,91.9%的患者都是ⅠB1期,只有不到10%的患者是ⅠA期。因此,作者在文中强调,本研究的结果不能直接推广到“低危”宫颈癌患者(肿瘤大小<2 cm;无淋巴脉管浸润;浸润深度<10 mm;无淋巴结受累)中。因此,国内有学者认为,目前对于ⅠA期和肿瘤大小<2 cm的ⅠB1期患者仍可以考虑行微创手术,但需要告知患者目前已有的研究结果并签署知情同意书。
基于LACC的研究结果,目前美国M.D.Anderson癌症中心已全面停止对宫颈癌患者提供微创手术。但是我们也不能就此完全否定微创手术在宫颈癌治疗中的价值,应当积极开展前瞻性的随机对照临床研究,进一步探索微创手术的利和弊,以及微创手术带来风险的可能原因。
本期分享的是2018年10月31日发表在N Engl J Med上的治疗宫颈癌的腹腔镜方法试验(LACC研究),旨在比较腹腔镜或机器人辅助根治性子宫切除术(微创手术)对比开腹根治性子宫切除术治疗早期宫颈癌的疗效与安全性[1]。
1 背景
对于早期宫颈癌患者,联合盆腔淋巴结清扫术的根治性子宫切除术是标准的治疗方式。美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)和欧洲妇科肿瘤学会(European Society of Gynecological Oncology,ESGO)指南均表明,开腹手术或腹腔镜手术(使用常规或机器人技术进行的微创手术)均是早期宫颈癌患者根治性子宫切除术可选择的手术方式[2-3]。
针对早期宫颈癌患者的回顾性Meta分析结果显示,与开腹根治性子宫切除术相比,腹腔镜根治性子宫切除术术中出血量较少,住院时间较短,且术后并发症的发生风险较低[4-5]。但Meta分析纳入的研究大部分没有生存数据报道,难以进行生存相关分析。此外,有回顾性研究表明,两种手术方法的复发率和生存率无明显差异[6-7]。
关于早期宫颈癌患者行腹腔镜或机器人辅助根治性子宫切除术(微创手术)后的生存结局是否与行开腹根治性子宫切除术相似这一问题,目前仅有来自回顾性研究的有限证据。
2 研究设计概况
本研究是全球首个前瞻性、Ⅲ期、国际多中心探讨腹腔镜或机器人辅助根治性子宫切除术(微创手术)是否非劣效于开腹根治性子宫切除术的研究。研究对象纳入标准包括:① ⅠA1脉管阳性、ⅠA2及ⅠB1期;② 子宫颈鳞状上皮癌、腺癌及腺鳞癌;③ ECOG评分0~1。研究对象排除标准包括:① 子宫长度>12 cm;② 腹部或盆腔放疗史,转移;③ 不能耐受手术或不能耐受手术标准体位。该研究前瞻性地将患者随机分配至接受微创(常规腹腔镜或机器人)或开腹根治性子宫切除术,比较两组患者的DFS、复发率和OS,主要研究终点是4.5年DFS。
研究实施计划分为2个阶段(图1)。第1个阶段纳入100例患者进行随机,每组50例进行微创手术或开腹手术,随机分层因素包括疾病分期和中心两个因素。第1阶段的目的之一是对入组和干预的可行性评估,同时关注生活质量。
在100例手术结束后,综合临床、经济可行性及参与中心的意愿,决定第2阶段如何进行。提供2种选择:选择1是继续随机入组,每组320例,总共740例;选择2是终止入组,对前50例微创组患者继续随访4.5年以上,并收集所有患者的DFS。终止入组的情况包括:年入组患者数<30例,或<75%的患者能保持随访,或微创组出现不可接受的并发症发生率(>8%)。
关于阶段2中选择1的样本量估计,基于主要研究终点4.5年DFS,考虑微创组为84%,开腹组90%,可认为二者疗效相当;同时考虑入组4.5年、最后1例患者入组后随访4.5年,共需要纳入740例患者。参考以上条件,我们也可以通过样本量计算软件(PASS)中的非劣效设计模块对样本量进行复核:同样考虑开腹组4.5年DFS为90%,采用非劣效界值7.2%,即绝对值82.8%,由此估计的样本量与研究计划中提到的数量相当,为746例。
3 统计分析计划
该研究统计分析计划特别提到了数据成熟度的考虑,主要从三个维度来看:一是中位随访时间,根据反向Kaplan-Meier曲线计算;二是4.5年时随访数据完整率;三是入组资料的可用性。
针对主要研究终点DFS,非劣效检验的目标是微创组与开腹组的疗效差异的单侧97.5%CI下限不低于-7.2%;若非劣效终点达到,将进一步进行优效性检验。主要结果以意向性分析集(intention-to-treat,ITT)为主,以符合方案集(per-protocol,PP)作为灵敏度分析结果;另外进行调整重要基线变量的多因素分析及基于肿瘤大小(<2 cmvs≥2 cm)的亚组分析等。
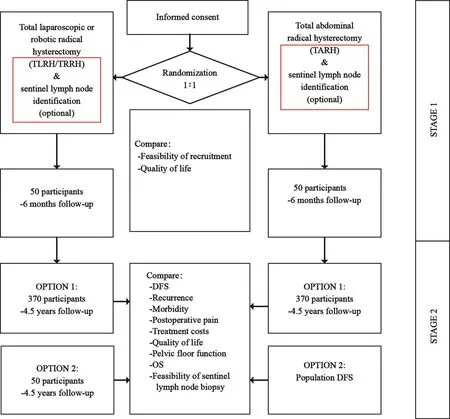
图 1 研究设计概要Fig. 1 Schema of the study design
研究预先设置了提前终止条件:考虑到微创手术可能存在的严重不良事件增加,预设在微创组入组达50、100、200和300例4个时间点,由试验安全委员会根据手术相关死亡数决定是否提前终止研究,但结果未报道手术相关死亡数。研究预设入组740例,实际在入组631例时提前终止,主要原因是组间死亡数严重不平衡(肿瘤死亡:2vs14;总死亡:3vs19)。
4 研究结果
2008年6月—2017年6月,全球共33家研究中心参与试验招募患者,共纳入631例患者,其中319例患者随机分配至微创组,312例患者随机分配至开腹组。
91.9 %的患者为ⅠB1期宫颈癌(表1)[1]。共有68例患者(微创组30例,开腹组38例)实际未接受相应手术,其中31例在手术前退出,27例手术中止,10例在术前转组(8例由开腹手术转为微创手术,2例由微创手术转为开腹手术)。在按照分组接受微创手术的患者中,84.4%的患者接受腹腔镜手术,15.6%的患者接受机器人辅助手术。
患者术后病理方面,组织学亚型、Ⅲ级肿瘤、肿瘤大小≥2 cm、淋巴血管浸润、宫旁侵犯及淋巴结受累等特征在两组之间差异均无统计学意义。在微创组中,浅表浸润性肿瘤发生率较高(28.5%,开腹组为21.6%)。
安全性方面,微创组和开腹组的术中并发症发生率分别为11.4%和10.5%,早期术后并发症(术后<6周)发生率分别为25.3%和25.7%。
术后辅助治疗方面,两组治疗比例相似(表2)[1]。辅助化疗和放疗的总发生率(微创组为18.8%,开腹组为18.1%)和至任何辅助治疗开始时间(微创组中位41 d,范围31~57 d;开腹组中位46 d,范围33~70 d)在两组间差异均无统计学意义。

表 1 入组患者基线特征Tab. 1 Baseline characteristics of all patients

表 2 辅助治疗Tab. 2 Adjuvant therapy[n(%)]
在中位随访时间2.5年(0.0~6.3年)后,对于4.5年DFS终点可获得59.7%的生存信息,能够提供84%的统计学效能。结果显示,共34例患者发生复发(微创组27例,开腹组7例),大多数发生在阴道穹隆或骨盆(微创组为41%,开腹组为43%)。开腹组阴道穹隆复发的比例较高(43%,微创组为15%),而所有非阴道穹隆的骨盆复发均发生在微创组中。两组复发患者的肿瘤大小分布相似,33家研究中心中有14家出现复发。共记录死亡22例,包括微创组19例和开腹组3例。
主要生存结局见图2[1]。I T T分析显示,微创组和开腹组4.5年DFS分别为86.0%和95.6%(差值-10.6%;95%CI:-16.4%~-4.7%;P=0.87),95%CI下限包含非劣效性界值-7.2%,因此未能证明非劣效。PP集分析结果相似,微创组和开腹组4.5年DFS分别为87.1%和97.6%(差值-10.5%;95%CI:-16%~-5%;P=0.88)。该阴性结果在接受机器人辅助手术的45例患者(组间差异-10.4%;95%CI:-24.7%~3.9%)和接受腹腔镜手术的244例患者(组间差异-10.6%;95%CI:-16.4%~-4.7%)的亚组分析中也是一致的。
微创组3年DFS低于开腹组(91.2%vs97.1%;HR=3.74,95%CI:1.63~8.58)(图2B)[1],用年龄、体质指数、疾病分期、淋巴血管浸润、淋巴结受累和ECOG体能评分校正后,差异仍然存在。
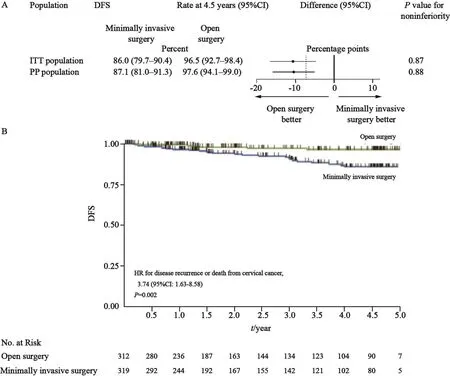
图 2 DFS估计Fig. 2 Estimates of DFS
与开腹组相比,微创组的OS较低(3年OS:93.8%vs99.0%,全因死亡HR=6.00,95%CI:1.77~20.30,图3A)[1];宫颈癌死亡率较高(3年宫颈癌死亡率:4.4%vs0.6%,HR=6.56,95%CI:1.48~29.00,图3B)[1];局部区域复发率较高(3年无局部区域复发生存率:94.3%vs98.3%,HR=4.26,95%CI:1.44~12.60,图3C)[1]。
5 讨论与思考
本研究发现,对于早期宫颈癌患者(ⅠA1脉管阳性、ⅠA2及ⅠB1期),相比开腹根治性子宫切除术,接受微创根治性子宫切除术的患者DFS和OS均较低,局部区域复发率较高。
既往文献报道认为微创根治性子宫切除术的肿瘤学结局与开腹手术无差异。本研究结果对既往回顾性研究及Meta分析结果提出了质疑。关于本研究结论的颠覆性,研究者也给出相应解释:① 以往Meta分析纳入的研究随访时间短,缺乏生存相关信息;② 回顾性研究多为历史对照比较,开腹组患者接受治疗时间早,且早期根治性子宫切除术适应证较广(ⅠB2期患者多),术后辅助化疗和(或)放疗建议未明确。
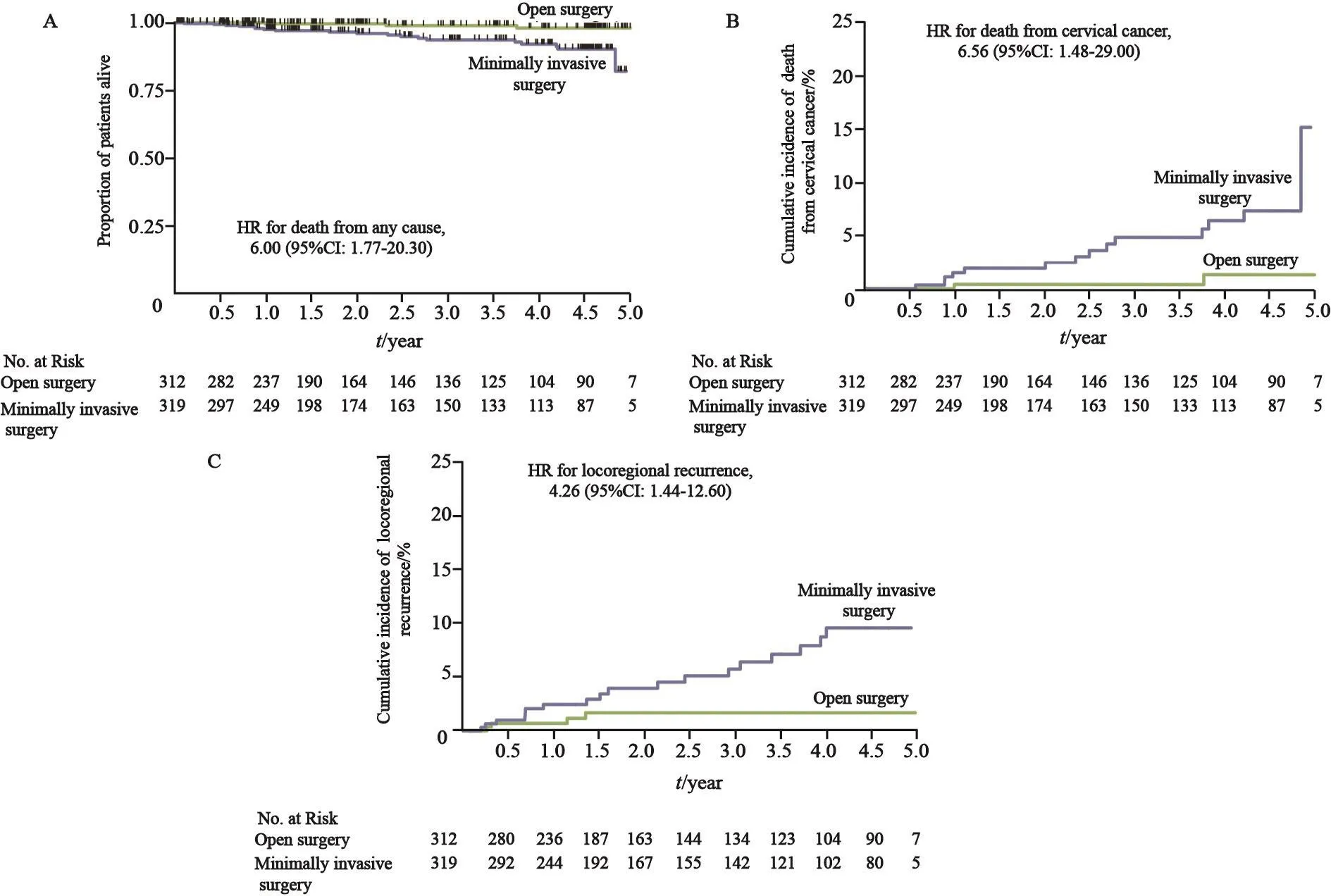
图 3 OS、疾病特异性生存期和局部区域复发的Kaplan-Meier估计Fig. 3 Kaplan-Meier estimates of OS, disease-specific survival and locoregional recurrence
本研究中微创手术结局较差可能受到以下因素影响:微创手术中在阴道顶端及肿瘤局部的挤压和摩擦可能增加肿瘤细胞脱落、种植及播散的概率;术中注入CO2,可能影响肿瘤细胞生长或蔓延[8]。既往研究报道CO2气腹可以促进肿瘤的生长,可能是微创手术中不能避免的危险因素之一[9]。然而,在GOG LAP2和LACE两项关于子宫内膜癌的随机对照临床试验中,微创组与开腹组并未提示生存差异,同样作为生殖系统肿瘤,这样的差异难以仅从CO2气腹的角度来解释[10-11]。另一个方面,本研究入组时间长达9年,2008—2017年,腹腔镜手术器械精准度大大提高,病理诊断准确性也有提高,更为重要的是,微创手术者需要较长的学习曲线和实践频率,手术者的技术进步很可能使患者更大程度获益。希望研究者提供进一步根据入组时间早晚进行亚组分析,深入剖析研究的结果。作者也在讨论部分特别说明,该临床试验不是设计用于回答微创手术结局较差的原因;因此,关于微创手术结局的影响因素探讨仍需未来更多研究。
也有人认为该试验未能证明微创手术的非劣效性,可能是由于开腹组DFS较高。历史研究DFS低于该研究的,有的纳入了盆腔淋巴结阳性、切缘阳性或盆腔侵犯阳性的患者[12],还有的并未接受标准术后辅助放疗或化疗[13]。近来有研究报道,接受开放根治性子宫切除术患者的5年DFS为93.3%~94.4%,与该试验中4.5年DFS为96.5%相符[6-7,14]。另一种理解是,本研究开腹手术组DFS与既往文献的差异也可能源于主刀医师微创手术和开腹手术经验与技巧的差异。
同期在N Engl J Med发表的另一篇回顾性研究,同样探讨了微创手术和开腹手术在早期宫颈癌中的预后差异,研究对象针对早期宫颈癌(ⅠA2、ⅠB1期),基于NCDB和SEER两大数据库分别进行了个体倾向性匹配分析和群体分析。
根据NCDB数据库进行2010—2013年的个体分析,经排除标准后,两组各纳入1 236和1 225例。无论是直接分析结果,还是倾向性评分匹配结果,微创组死亡率都高于开腹组,4年死亡率分别为9.1%和5.3%,中位随访时间45个月,较本研究更长。
由于NCDB数据库2010年之前的资料不全,研究者又根据S E E R数据库进行了2000—2010年的群体分析。又因为SEER数据库缺乏AJCC或FIGO分期,故以localized、regional代替。采用4年相对生存率作为主要指标,以排除非肿瘤死亡的影响。结果显示,微创手术应用前(2000—2006年)生存率呈稳定上升趋势;微创手术应用后(2006—2010年)呈下降趋势,平均每年下降0.8%(图4)[15]。而微创手术在2006年占1.8%,之后逐年增加,到2010年占31.1%。总体趋势为:随着时间推移,微创手术占比越大,不分手术方式的宫颈癌患者总体生存率越低。
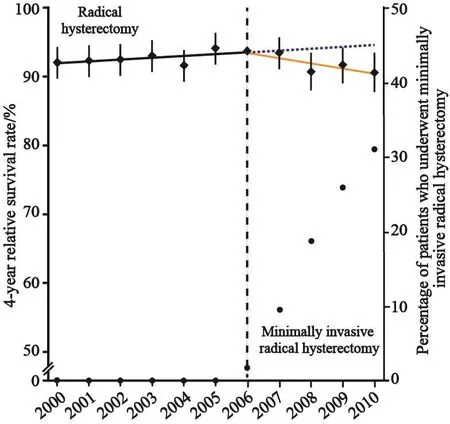
图 4 宫颈癌微创根治性手术4年相对生存率的间断时间序列评价Fig. 4 Interrupted time-series evaluation of the effect of adoption of minimally invasive radical hysterectomy on 4-year relative survival rate
综合前瞻性研究与回顾性研究结果,从统计学角度来看,这项颠覆性结果的可信度到底有多大呢?支持该结果的证据包括:① 研究者对ITT集和PP集都进行了报道,结果一致;总脱落率不高(10.8%),从ITT到PP集交叉较少,影响较小。② 同期同主题基于NCDB和SEER两大数据库的大样本回顾性研究结果相似。③ 也是最重要的,既往文献报道生存率差异无统计学意义,并不能代表二者相似。相反,也有一些证据可能支持微创手术:① 本研究时间跨度长达9年,结果未根据时间因素调整,可能有潜在偏倚影响。② 中位随访时间仅2.5年,而4.5年数据成熟度不足60%,这意味着40%以上的患者是在近4.5年内入组的,间接说明该结果主要基于早期入组患者的生存数据,进一步提示时间因素影响的可能性大。③ 复发事件集中在1/3的中心,手术质量差异是否也存在影响?但鉴于研究已经对中心进行了分层,还规定了手术视频质控方法,因此该影响应该不大。综上,笔者认为支持证据的可信度更高。
当然,我们不能仅仅因为两篇文章就完全否定微创手术在宫颈癌治疗中的价值。每个研究都有一定的局限性,作者在文中强调,本研究的结果不能直接推广到“低危”宫颈癌患者(肿瘤大小<2 cm;无淋巴脉管浸润;浸润深度<10 mm;无淋巴结受累)中,因为统计学效能不足以评估两种手术方法在该亚组患者中的肿瘤学结局。
LACC研究结果引发对微创手术的反思,给未来临床实践提供许多启示:要加强对腹腔镜手术的监管和准入,选择合适的患者,由有资质的医师进行手术以提高患者的受益。同时,要重视患者的知情同意权,选择手术方式时需详细告知该领域研究现状。另外,两项研究均未报道微创手术与开腹手术在生活质量方面的比较,尤其是早期宫颈癌的生育功能保留方面,哪种术式更优仍值得进一步探究。总之,关于微创手术的应用价值,仍需更多研究验证。

