血清HER2-ECD水平在乳腺癌新辅助化疗中的应用价值分析
孙佳俊,卢仁泉,郑 慧,陆 立,郭 林
复旦大学附属肿瘤医院检验科,复旦大学上海医学院肿瘤学系,上海 200032
人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)是一种相对分子质量为185×103的酪氨酸激酶受体蛋白,属于人表皮生长因子受体家族的一员。其蛋白包含3个结构域,分别为105×103的胞外段(extracellular domain,ECD)、拥有酪氨酸激酶活性的胞内段及跨膜区[1]。15%~30%的乳腺癌高表达HER2,其具有恶性程度高、转移复发早的临床特点,与患者的无进展生存期(progression-free survival,PFS)和总体生存率(overall survival,OS)的下降息息相关[2-3]。同时,HER2还是曲妥珠单抗(trastuzumab)的治疗靶点,HER2阳性的乳腺癌患者在接受曲妥珠单抗的治疗后,比对照组的PFS和OS显著提高[4-5]。
根据美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)和美国病理学家协会(College of American Pathologists,CAP)指南,目前临床上检测患者HER2表达水平的方法为免疫组织化学染色和荧光原位杂交(fuorescencein situhybridization,FISH)[6],但由于其主观性、滞后性及难以取材的局限性,越来越多的研究者开始对血清HER2-ECD进行研究。Reix等[7]发现,在转移性乳腺癌中,与血清HER2-ECD水平较低(<15 ng/mL)的患者相比,血清HER2-ECD水平较高(≥15 ng/mL)的患者DFS较短,而在Wang等[8]对血清HER-ECD在治疗中的动态变化监测发现,治疗后下降>20%的患者预后更佳。本文旨在讨论乳腺癌患者血清HER2-ECD的影响因素及其在新辅助化疗中监测的应用价值探究。
1 资料和方法
1.1 研究对象
所有研究对象来自于复旦大学附属肿瘤医院2015年7月—2017年8月经手术或乳腺空芯针穿刺证实的浸润性导管癌患者共507例,中位年龄48岁(24~87岁)。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)TNM分期标准,Ⅰ期20例,Ⅱ期263例,Ⅲ期177例,Ⅳ期47例。所有病例在入组时均未行化疗、放疗及内分泌治疗。48例新辅助化疗随访病例均行单周PC+H方案化疗(P:紫杉醇,C:卡柏,H:赫赛汀),3周为1个周期,持续6个周期,新辅助化疗后按照实体瘤疗效评价标准(Response Evaluation Criteria In Solid Tumors,RECIST)进行评估,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)[9]。
1.2 血清学检测
所有血液样本通过离心10 min进行分离(1 200×g),取血清储存在-80 ℃直到使用。HER2-ECD的定量检测试剂盒及仪器均购自西门子(中国)有限公司,检测系统为ADVIA Centaur CP全自动化学发光免疫分析仪,根据说明书,以血清HER2-ECD>15 ng/mL作为阳性评判标准。
1.3 免疫组织化学染色与结果判定
免疫组织化学染色由复旦大学附属肿瘤医院病理科完成。用于染色的组织切片均来自于未经过放化疗或内分泌治疗的初治患者,按照ASCO/CAP推荐的标准染色步骤对ER、PR、HER2和Ki-67进行染色。ER和PR的阳性判别标准是大于1%的细胞表达阳性。HER2的阳性判定标准为:组织化学染色3+或经过FISH确证的2+。而Ki-67的结果用1 000个细胞中的阳性细胞数量百分比来表示[6]。
1.4 统计学处理
数据采用SPSS 19.0软件进行分析。计量资料以中位数及四分位数表示,检验方式为中位数检验,计数资料以百分比或率表示,检验方式为χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血清HER2-ECD与患者临床特征的关系
在507例乳腺癌患者中,血清HER2-ECD阳性197例,阴性310例,阳性率为38.9%。通过对血清HER2-ECD在不同年龄、TMN分期、组织雌激素受体、孕激素受体、Ki-67及HER2中的表达情况进行比较发现,血清HER2-ECD的升高与上述因素都相关,年龄>50岁、Ⅲ~Ⅳ期、ER(-)、PR(-)、Ki-67>20%及HER2(+)的患者中血清HER2-ECD的阳性率较高(P均<0.05,表1)。
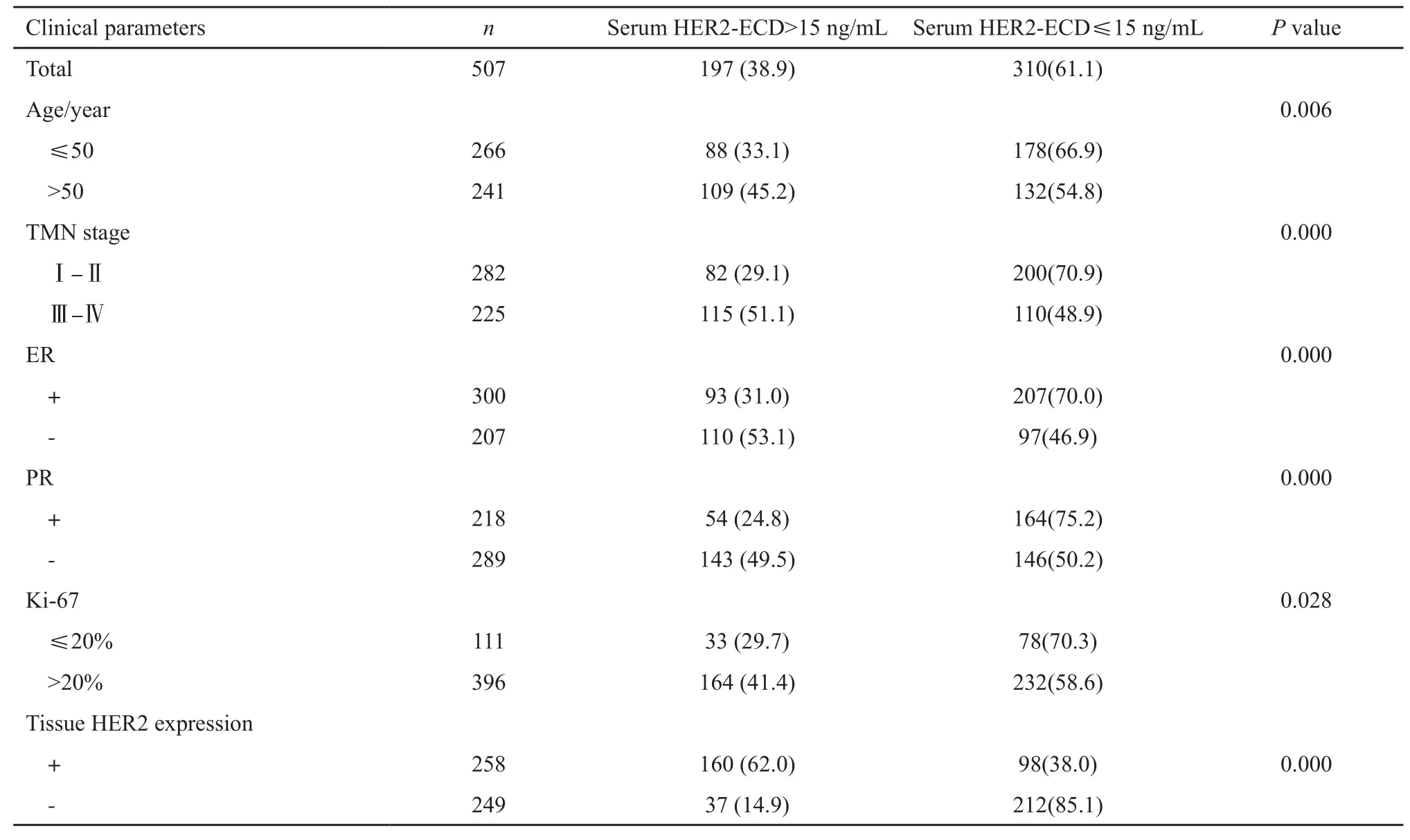
表 1 血清HER2-ECD与患者临床特征的关系Tab. 1 Relationship of serum HER2-ECD and the clinical characteristics of patients
2.2 血清HER2-ECD新辅助化疗前后变化的临床意义
2.2.1 血清HER2-ECD在新辅助化疗中的变化情况
对其中48例组织HER2阳性的乳腺癌患者进行随访,收集患者新辅助化疗前后的血清,化疗前、化疗2、4、6个周期后的血清HER2-ECD的变化情况见图1。与治疗前相比,经过2个疗程的新辅助化疗后,患者血清HER2-ECD明显下降,从18.10 ng/mL(13.20~28.95 ng/mL)降低到11.20 ng/mL(9.80~12.75 ng/mL),而经过4、6个疗程的新辅助化疗后,血清HER2-ECD水平进一步下降,分别为10.80 ng/mL(9.80~12.30 ng/mL)和10.70 ng/mL(9.80~12.25 ng/mL)。经过单因素分析发现,治疗前血清HER2-ECD与2、4、6个周期后的血清HER2-ECD差异均有统计学意义(P均<0.01),而2、4和6个周期之间的变化差异无统计学意义(P>0.05)。
2.2.2 血清HER2-ECD的变化与新辅助化疗疗效的关系
经过2个周期的新辅助化疗后,血清HER2-ECD出现了不同程度的下降,48例患者中有10例血清HER2-ECD仍然为阳性,38例下降为阴性,结果见表2。在血清HER2-ECD阳性患者中,分别有2例、4例、2例、2例患者化疗后评估为CR、PR、SD、PD。而在阴性患者中,分别有13例、23例、2例评估为CR、PR、SD,没有患者被评估为PD,在新辅助化疗2个周期后血清HER2-ECD阴性患者的客观缓解率(objective response rate,ORR)显著高于阳性患者,差异有统计学意义(P<0.05)。

图 1 血清HER2-ECD在新辅助化疗后的变化Fig. 1 Serum HER2-ECD levels before and after neoadjuvant chemotherapy
2.2.3 4例典型患者血清HER2-ECD在新辅助化疗过程中的变化
4例乳腺癌患者经过新辅助化疗后,疗效评估达到CR、PR、SD及PD的典型变化情况见图2。患者A初始血清HER2-ECD为23.6 ng/mL,2个周期后即刻转阴,降低到9.8 ng/mL,并维持始终,其新辅助化疗疗效评估为CR;患者B经过2个周期的新辅助化疗后,血清HER2-ECD从初始的108.4 ng/mL降低到19.6 ng/mL,依然为阳性,直到4个周期才转为阴性,新辅助化疗评估为PR;患者C的血清HER2-ECD水平经过2~6个周期的治疗后,依然保持阳性,表明疗效不佳,临床疗效评估为SD;患者D经过2个周期的新辅助化疗后从103.6 ng/mL降低到18.4 ng/mL,并始终保持阳性,直到第6个周期血清HER2-ECD上升到125.2 ng/mL,此时影像学检查也显示肿瘤出现转移,疗效评估为PD。
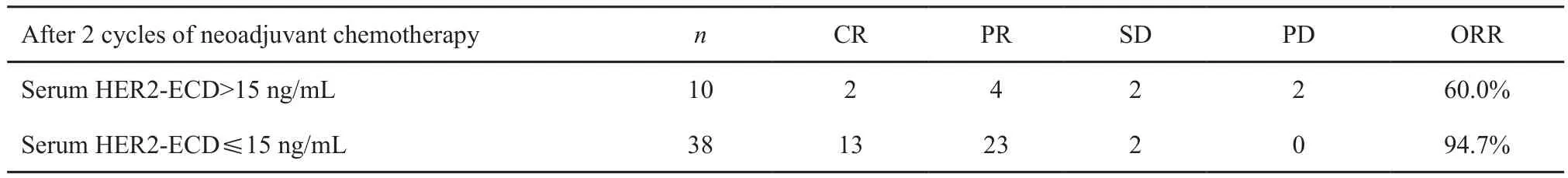
表 2 2个周期新辅助化疗后血清HER2-ECD的水平变化与疗效Tab. 2 The serum HER-ECD level after 2 cycles of neoadjuvant chemotherapy and treatment effect

图 2 4例典型患者的血清HER2-ECD在新辅助化疗中的变化情况Fig. 2 The change of serum HER2-ECD level in four typical patients
3 讨 论
组织HER2的状态是乳腺癌预后的独立危险因子,在乳腺癌的临床诊治中有着显著的价值[10]。HER2蛋白或基因过表达的乳腺癌患者因其对各化疗药物的敏感性较低而预后较差。而随着HER2蛋白的单克隆抗体-曲妥珠单抗的临床应用,组织中HER2基因过表达的患者治疗效果有了显著提升。因此,准确筛选出能够因此获益的患者显得尤为重要。
血清HER2-ECD早在2005年便已被美国食品药品管理局(Food and Drug Administration,FDA)批准应用于转移性乳腺癌治疗的检测,对于血清HER2-ECD始终>15 ng/mL的患者治疗的成功率显著低于血清HER2-ECD<15 ng/mL的患者。由于肿瘤的异质性与癌症治疗的复杂性,血清HER2在乳腺癌中是否能够用于监测新辅助化疗的疗效一直尚未明确。有文献表明,在对乳腺癌新辅助化疗监测的过程中发现,在第1、3和6周时血清HER2-ECD出现降低,并且这部分患者的化疗疗效较好[11-12]。而Leary等[13]的Meta分析认为,患者初始血清HER2-ECD与新辅助化疗的疗效无关。
本研究对血清HER2-ECD与患者的病例特征进行比较,发现其升高与患者年龄>50岁、分期Ⅲ~Ⅳ期、ER阴性、PR阴性、Ki-67>20%及组织HER2阳性相关,这一结果与张毅敏等[14]的结果类似,由此可见血清HER2-ECD的升高与恶性程度高的乳腺癌相关,预后较差。
为研究血清HER2-ECD在新辅助化疗监测中的作用,我们又对其中48例Ⅱ~Ⅲ期进行新辅助化疗的乳腺癌患者进行动态监测,结果表明,经过2个周期新辅助化疗后,其血清HER2-ECD的水平显著降低,血清HER2-ECD中位数从18.1 ng/mL降低到11.2 ng/mL,这一结果与Wang等[8]的结果一致。经过2个周期新辅助化疗后,血清HER2-ECD转阴组的ORR显著高于非转阴组,结果表明,如果患者经过2个周期的新辅助化疗后,血清HER2-ECD水平持续增高,患者的化疗疗效不佳,或将为临床治疗方案变更提供依据。多项研究表明,治疗前HER2-ECD的水平与患者对新辅助化疗的反应性相关,其治疗前HER2-ECD水平越高,患者对新辅助化疗的反应性越差,PFS和OS也越短[15-16],这与本研究的结果相同。
血清HER2-ECD作为一种血清标志物,具有无创、简便、快速及实时等优点,在组织HER2阳性的患者新辅助化疗中具有相当重要的价值,对血清HER2-ECD进行监测可以为临床患者治疗方案的选择提供依据,并且有助于医师整体把握患者的治疗情况,使患者能够最大获益。

