雷公藤红素对人胰腺癌细胞PANC-1增殖、侵袭和迁移的抑制作用
高 琦,郭 艳,魏小娟
新乡市中心医院消化内科,河南 新乡 453000
胰腺癌是常见的恶性肿瘤之一,是导致发达国家癌症患者死亡的第4大原因,并且预计到2050年,胰腺癌将成为导致美国癌症患者死亡的首要原因[1-2]。胰腺癌在中国同样属于高发疾病,据统计,2015年中国约有90 100例胰腺癌新发病例,并有7 9400人死于胰腺癌[3]。研究表明,胰腺癌具有较高的侵袭和转移能力,约有超过85%的胰腺癌患者在初次诊断时就已经出现癌细胞的局部浸润或远处转移[4]。胰腺癌患者的中位存活时间也仅有5~6个月,5年内存活率低于5%[5]。虽然目前对于胰腺癌的治疗取得了一定的进展,但由于胰腺癌细胞容易形成放化疗抵抗而导致胰腺癌患者死亡率难以降低。因此,寻找治疗胰腺癌的新药物是降低胰腺癌患者死亡率的关键。雷公藤红素(celastrol)是提取自中药雷公藤的一类三萜类化合物,研究发现,celastrol具有较强的抗癌活性,能抑制前列腺癌、食管癌及胃癌等多种癌症的发展,并且对癌症的转移也具有显著的抑制作用[6-8]。Zhao等[9]研究发现,celastrol还能诱导胰腺癌细胞凋亡,但对胰腺癌细胞侵袭及迁移能力的影响还少见报道。本研究以人胰腺癌细胞PANC-1为研究对象,探究celastrol对胰腺癌细胞侵袭及迁移能力的影响。
1 材料和方法
1.1 主要试剂
RPMI-1640细胞培养液和胎牛血清由美国Gibco公司提供,celastrol购自美国Sigma公司,RIPA裂解液、BCA试剂盒及细胞计数试剂盒(cell counting kit-8,CCK-8)由美国Pierce公司提供。Matrigel购自美国Millipore公司,Ki-67、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)一抗购自美国Santa Cruz公司,HRP标记山羊抗小鼠和HRP标记山羊抗兔二抗购自北京博奥森生物技术有限公司。
1.2 细胞培养
人胰腺癌细胞PANC-1购自美国ATCC公司。用含有10%胎牛血清的RPMI-1640培养液将PANC-1细胞培养于37 ℃、CO2体积分数为5%的恒温培养箱中,隔天换液1次,2~3天进行传代培养,细胞传代的密度为2×104个/mL。
1.3 试剂配置
用微量的二甲基亚砜将celastrol全部溶解,使二甲基亚砜终浓度不超过0.1%,随后加入无血清培养液的celastrol配制为1 mmol/L的储存液储存于-20 ℃冰箱中,临用前用含10%胎牛血清的RPMI-1640培养液将celastrol储存液稀释到实验所需浓度。
1.4 细胞分组及处理方法
将人胰腺癌PANC-1细胞分为PANC-1组、celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组,分别用0、5、10和20 μmol/L的celastrol处理PANC-1细胞,进行后续检测。
1.5 CCK-8检测细胞活性
将PANC-1细胞接种于96孔板中,并用0、0.05、0.1、0.2、0.5、1、2、5、10、20、50、100、200和500 μmol/L的celastrol处理PANC-1细胞24 h,每个浓度6个复孔。每孔分别加入10 μL的CCK-8试剂,于37 ℃继续温育4 h后用酶标仪检测细胞活性。
按照上述方法检测PANC-1组、celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组的细胞活性,计算细胞增殖倍数。
1.6 Transwell检测细胞侵袭能力
用Matrigel对Transwell小室进行预包被处理,即将Matrigel置于4 ℃溶化后,加入适量Matrigel覆盖Transwell小室底部,将Transwell小室放于培养箱中待Matrigel凝固后取出备用。将PANC-1细胞以2×105个/mL的密度接种于小室上层,并加入含有0、5、10和20 μmol/L celastrol的无血清培养液处理细胞24 h,小室下层加入完全培养液。24 h后用无菌棉签擦去上层未迁移细胞,用结晶紫对迁移细胞染色并计数统计。
1.7 划痕实验检测细胞迁移能力
用无菌的记号笔于6孔板背面划5条平行直线后备用。将PANC-1细胞接种于准备好的6孔板中,种板密度为5×105个/mL。第2天用10 μL的枪头垂直于培养板背面的直线划痕,并用PBS洗去被划下的细胞,记录0 h时各组细胞划痕宽度,并将细胞按照1.4的方法处理24 h后记录各组细胞划痕宽度,计算细胞的划痕闭合率。
1.8 蛋白质印迹法(Western blot)检测蛋白表达
将细胞按照1.4的方法进行处理后,用RIPA裂解液提取各组细胞蛋白,并用二喹啉甲酸(bicinchoninic acid disodium,BCA)试剂盒检测蛋白浓度后调平。每组分别取40 μg的蛋白用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)进行分离,采用半干法将分离后的目标蛋白转移到PVDF膜,用5%的脱脂奶粉室温封闭蛋白质2 h,2 h后加入适宜浓度的一抗(Ki-67:1∶1 000;VEGF:1∶1 000;MMP-9:1∶800)于4 ℃温育过夜。第2天取出PVDF膜,洗去膜上未结合一抗,加入二抗37 ℃温育1 h后,滴加化学发光显色液进行曝光显影。
1.9 统计学处理
所有实验结果均用统计学软件SPSS 19.0进行分析,组间差异分析采用单因素方差分析,实验结果以表示,P<0.05为差异有统计学意义。
2 结 果
2.1 对PANC-1细胞增殖的影响
预实验结果表明,当celastrol浓度高于50 μmol/L时,胰腺癌PANC-1细胞的细胞活性降至80%以下(图1)。因此,选择5、10和20 μmol/L 3个浓度的celastrol进行后续实验。与PANC-1组相比,celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组的胰腺癌PANC-1细胞的增殖倍数明显降低,差异有统计学意义(P<0.01,图2),并具有量效关系;同时,celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组细胞增殖相关蛋白Ki-67的蛋白表达水平与PANC-1组比较明显降低,差异有统计学意义(P<0.01,图3)。
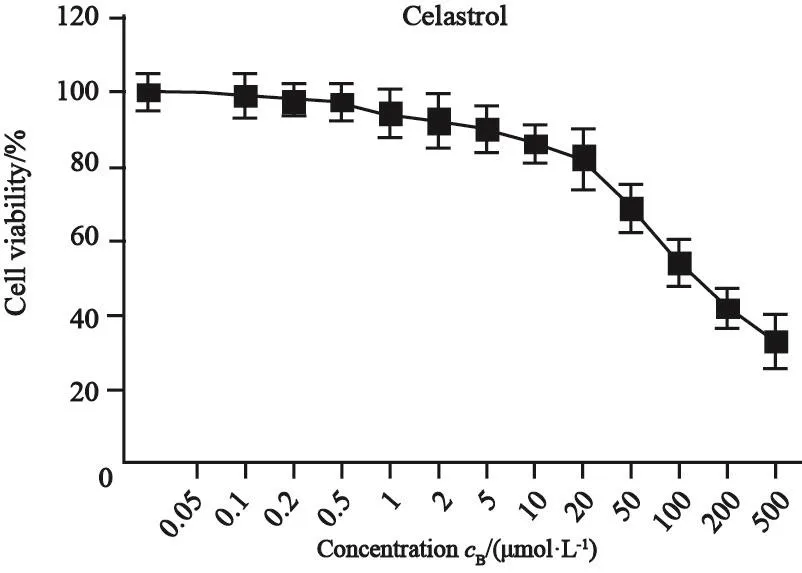
图 1 Celastrol对PANC-1细胞活性的影响Fig. 1 The effect of celastrol on cell viability of PANC-1 cells
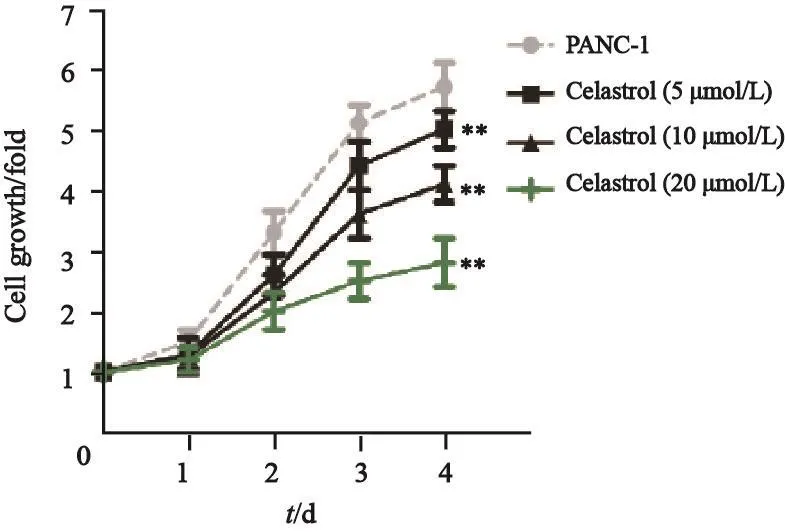
图 2 Celastrol对PANC-1细胞增殖的影响Fig. 2 The effect of celastrol on proliferation of PANC-1 cells
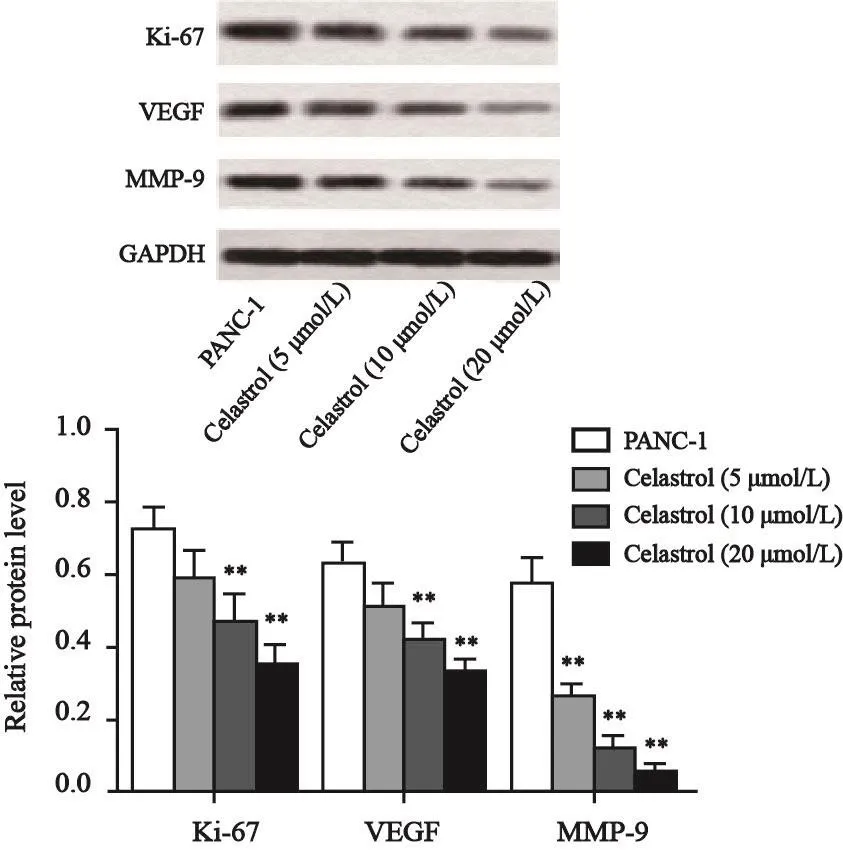
图 3 Celastrol对PANC-1细胞Ki-67、VEGF和MMP-9蛋白的影响Fig. 3 The effect of celastrol on the expressions of Ki-67, VEGF and MMP-9 in PANC-1 cells
2.2 Celastrol对PANC-1细胞侵袭能力的影响
与PANC-1组相比,celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组侵袭的胰腺癌PANC-1细胞明显减少,差异有统计学意义(P<0.01,图4),并具有量效关系。
2.3 Celastrol对PANC-1细胞迁移能力的影响
划痕实验结果表明,与PANC-1组相比,celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组24和48 h PANC-1细胞的划痕闭合率显著降低,差异有统计学意义(P<0.01,图5),并具有量效关系;同时,celastrol(5 μmol/L)组、celastrol(10 μmol/L)组和celastrol(20 μmol/L)组PANC-1细胞侵袭迁移相关蛋白VEGF和MMP-9的蛋白表达水平与PANC-1组相比明显降低,差异有统计学意义(P<0.01,图3)。
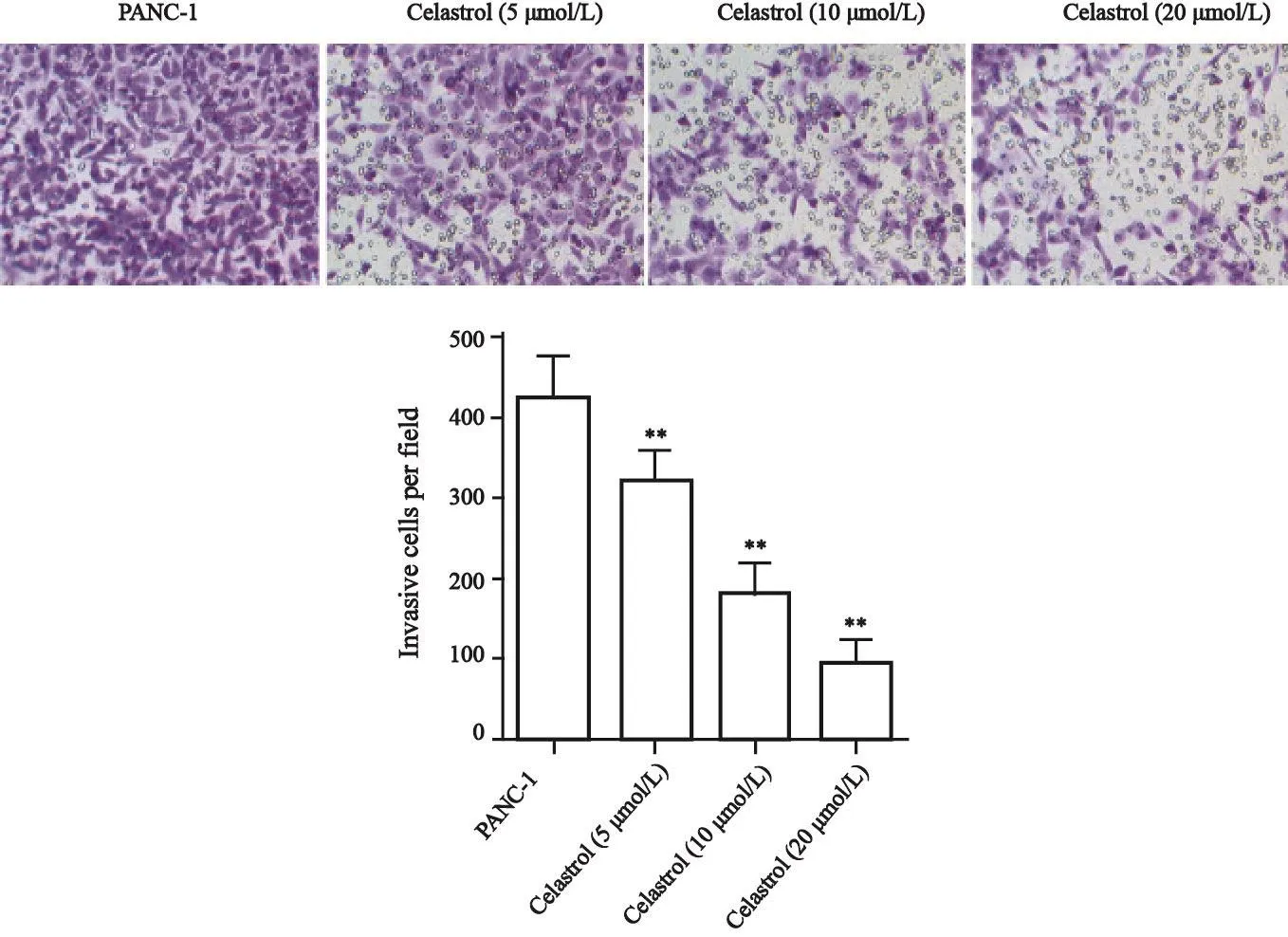
图 4 Celastrol对PANC-1细胞侵袭能力的影响Fig. 4 The effect of celastrol on invasion ability of PANC-1 cells
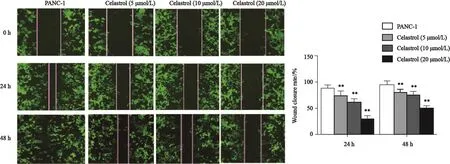
图 5 Celastrol对PANC-1细胞迁移能力的影响Fig. 5 The effect of celastrol on migration ability of PANC-1 cells
3 讨 论
胰腺癌是常见的恶性肿瘤之一,胰腺癌患者通常预后较差、生存时间较短,并且通常易复发,易出现淋巴及肝脏转移[10]。目前对于胰腺癌的治疗方法及药物并不明显影响胰腺癌患者的预后[11]。因此,寻找治疗胰腺癌的新方法及药物是提高胰腺癌患者预后的关键。Celastrol是中药雷公藤中的主要活性成分,研究发现,celastrol具有较强的抗炎、抗氧化及免疫调节作用,能通过抑制血管新生、抑制蛋白酶体活性从而抑制癌症发展、诱导癌细胞凋亡[12-13]。Lee等[14]研究表明,celastrol可通过诱导细胞凋亡和自噬抑制胃癌细胞生长。Celastrol还能通过调控Akt信号通路的激活和整合素的表达抑制肺癌细胞的生长和转移[15]。此外,celastrol还能诱导胰腺癌细胞凋亡,其作用机制与抑制elF4E结合蛋白4E-BP1的表达有关[16]。为进一步探究celastrol对胰腺癌细胞生长及转移的作用,为雷公藤应用于胰腺癌的食疗提供更多理论依据,本研究探讨celastrol对胰腺癌PANC-1细胞增殖、侵袭及迁移能力的影响。
首先,本研究采用浓度梯度的celastrol处理人胰腺癌PANC-1细胞并发现,当celastrol浓度≥50 μmol/L时,PANC-1细胞的活性降至80%以下,表明其浓度达到50 μmol/L及以上时,对PANC-1细胞具有明显的毒性,并且随着celastrol浓度的增大,对PANC-1细胞活性的抑制作用越强。因此选择了5、10和20 μmol/L 3个浓度进行后续实验。用不同浓度的celastrol处理细胞4 d后,PANC-1细胞的增殖倍数与正常培养的PANC-1细胞比较明显降低,并且具有量效关系。进一步表明celastrol能抑制胰腺癌PANC-1细胞增殖,从而抑制胰腺癌的发展。
癌细胞侵袭和转移是导致患者癌症性死亡的最主要原因,抑制癌细胞的侵袭及转移能减缓癌症发展进程,但目前临床上并无针对癌细胞转移的药物被应用于癌症的治疗[17]。已有研究表明,celastrol对癌细胞的侵袭和迁移具有明显的抑制作用[18-20]。Yu等[18]研究发现,celastrol能通过下调PI3K/Akt/NF-κB信号通路活性减弱人骨肉瘤细胞的侵袭和转移能力。Celastrol还能通过抑制NF-κB通路的激活抑制卵巢癌细胞迁移和侵袭,抑制卵巢癌细胞生长[19]。此外,celastrol还能通过抑制MMP-9的表达抑制乳腺癌细胞侵袭[20]。本研究发现,celastrol能显著减少侵袭的胰腺癌PANC-1细胞数、降低PANC-1细胞的划痕闭合率,并随浓度升高作用逐渐增强,表明celastrol能抑制胰腺癌PANC-1细胞侵袭和迁移。此外,celastrol还能抑制PANC-1细胞侵袭及迁移相关蛋白VEGF和MMP-9的表达。细胞外基质的降解是癌症转移的关键,MMP-9在促进细胞外基质降解过程中发挥着重要作用[21]。VEGF是促进血管新生的关键因子,也能通过促进细胞外基质的降解促进癌细胞的侵袭和迁移[22]。结合实验结果进一步表明,celastrol能抑制胰腺癌PANC-1细胞侵袭和迁移。
综上所述,celastrol能降低人胰腺癌PANC-1细胞增殖倍数,并能抑制Ki-67的表达,同时还能减少PANC-1细胞侵袭,降低PANC-1细胞的划痕闭合率,并降低VEGF和MMP-9的蛋白表达水平,表明celastrol能抑制人胰腺癌PANC-1细胞增殖,并减弱癌细胞的侵袭和迁移能力。本研究仅探讨了celastrol对胰腺癌PANC-1细胞增殖、侵袭和迁移的作用,对作用机制的研究还未涉及,因此后期还需要对其作用机制进行进一步探究。

