4 个鲜食葡萄品种组培快繁体系的建立
蔡文博 段 虹 王 军 朱元娣
(1中国农业大学园艺学院,北京 100193;2中国农业大学食品科学与营养学院,北京 100083)
中国是世界葡萄(Vitis vinifera L.)生产大国,自2011年起鲜食葡萄产量已位居世界首位,2014年起葡萄栽培面积跃居世界第2 位[1],截至2015年底,栽培面积达79.9 万hm2,产量达1 366.9 万t。 我国葡萄生产以鲜食葡萄为主,占80%左右,葡萄苗木标准化生产是产业发展的基础[2-3]。 葡萄可以通过扦插或嫁接等方法进行无性繁殖,但周期长且易积累病害。 植物组织培养技术能够不受季节的限制,快速繁殖优质的葡萄苗木,同时降低成本[4-6]。 因此,建立有效的鲜食葡萄品种组培快繁体系,不仅可以满足优质苗木的商业化生产需求,还能为优质葡萄市场提供技术参考。
常规的组培快繁体系包括无菌外植体的建立、启动培养、继代培养和驯化移栽四个环节[7]。 外植体的选择是葡萄组培快繁的第一步。 选取长新梢(10 cm)作为外植体,有利于诱导不定芽的发生[8-9]。 培养基成分与配比能够影响外植体的启动培养和繁殖体的增殖效率[10]。 研究表明,添加2 mg·L-16-苄氨基腺嘌呤(6-benzylamino purine,6-BA)和0.2 mg·L-1萘乙酸(1-naphthlcetic acid, NAA)的MS 培养基作为巨峰的初代培养基,2.0 ~5.0 cm 新梢为外植体,萌芽率达到71.1%[11];MS 培养基添加0.2 mg·L-13-吲哚丁酸(3-indolebutyric acid, IBA)、1.0 mg·L-16-BA 和0.5 mg·L-16-糠氨基嘌呤(kinetin, KT)启动培养酿酒葡萄茎段外植体,萌芽率达73%以上,侧芽萌发生长状况良好[12]。 继代过程中,繁殖体在不同培养基上的生长情况不同,1/2 MS 培养基有利于Dixie 和Fry 葡萄茎段的增殖增长[8-9,13];木本植物培养基(woody plant medium,WPM)促使葡萄砧木3309 和SO4 生长良好,生根率近100%[14],但圆叶葡萄品种如Carlos 和Fry在WPM 培养基上长势较差,表现出严重的玻璃化现象[15-16]。 培养基中附加的激素如3 - 吲哚乙酸(3-indoleacetic acid, IAA)、IBA、6-BA、苯基噻二唑基脲(thidiazuron, TDZ)和KT 等影响葡萄组培苗的增殖和生根[10,16]。 利用添加0.2 mg·L-1IBA 的改良B5培养基作为无核白和弗莱姆的继代培养基,增殖与生根培养可同时进行,减少了操作[10,17]。 组培苗驯化移栽是最终的重要环节,不同炼苗方式影响组培苗移栽成活率。 光培法是驯化葡萄组培苗的常规方法,但成活率不高,为60%以上,这主要是由于在炼苗过程中,易产生大量霉菌,组培苗的根系易受伤害[6,12,18]。 但光培炼苗后进行沙培炼苗,成活率可达到90%以上[10]。利用水培炼苗的方法驯化苹果组培苗,将组培苗放入改良的霍格兰德半营养液中,能够极大提高苹果组培苗移栽成活率[19-20]。
目前,已建立的多个葡萄品种的组培快速繁殖体系间存在差异,但可用于不同葡萄品种的组培快繁体系较少,不利于将组培快繁技术转化制葡萄苗木繁殖的商业化生产中。 本研究以4 个鲜食品种夏黑、红地球、巨峰和玫瑰香为试验材料,通过探索无菌外植体接种、启动培养、增殖生根培养和驯化移栽环节的关键技术,建立适用于不同鲜食葡萄品种的组培快繁体系,以期为鲜食葡萄苗木繁育和商品化生产提供理论依据。
1 材料与方法
1.1 试验材料
于2015年11月在中国农业大学上庄实验站采集夏黑、红地球、巨峰和玫瑰香4 个鲜食葡萄品种的冬季休眠枝条作为建立鲜食葡萄快繁体系的试验材料。
1.2 试验设计与方法
1.2.1 外植体消毒及启动培养 冬季采集葡萄休眠枝条,45℃恒温水浴处理不同时间(1.5、3 和4 h),每种处理包含40 个枝条;然后在室温下(21±2℃),水培促进冬芽萌发,每隔3~4 d 换一次水,待新梢生长至长度为10~15 cm 时采样,剪切约10 cm 茎段作为外植体,进行表面消毒;用加入洗涤灵的水充分清洗后,于超净台内进行表面消毒。 分别进行2 个消毒处理过程:1)高浓度(3%)次氯酸钠处理:用70%酒精消毒10~30 s(幼嫩外植体消毒时间短),无菌水冲洗2~3 次,3%次氯酸钠消毒10 min,无菌水冲洗4~5 遍,最后用灭菌的滤纸吸去茎段表面多余水分,为接种备用;2)低浓度(0.3%~0.5%)氯酸钠处理:用70%酒精消毒10~30 s(幼嫩外植体消毒时间短),无菌水冲洗2~3 次,0.3%~0.5%次氯酸钠消毒15 min,无菌水冲洗4~5 遍,最后用灭菌的滤纸吸去茎段表面多余水分,为接种备用。
每个葡萄品种选择13 个茎段,分别经过上述2 个消毒处理过程。 消毒后的茎段,分别剪去新梢顶端和切口部位,以避免消毒剂对茎段的剪切口的影响。 以幼嫩的和半木质化的茎段为外植体,接种于MS+0.2 mg·L-1IBA +1.0 mg·L-16-BA +0.5 mg·L-1KT +4.0 mg·L-1腺嘌呤+30 g·L-1蔗糖+ 8.2 g·L-1琼脂培养基上。 培养环境如下:光照强度为30~40 μmol·m-2·s-1,光照时间为14 h·d-1,培养温度为25±2℃,15 d 后观察茎段生长状况,并统计萌芽率。
1.2.2 增殖与生根培养 单芽长度为5~6 cm 时,进行继代培养。 剪成单芽茎段(长10 ~15 mm),每瓶接种3~4 个茎段。 设置不同成分配比的培养基(分别记作T1、T2、T3),以筛选适用于4 个鲜食葡萄品种增殖生根的培养基,培养基成分如下:T1 ∶1/2MS + 0.1 mg·L-1IBA +1.0 mg·L-1KT +30 g·L-1蔗糖+8.2 g·L-1琼脂,pH 值5.8;T2 ∶1/2MS +0.2 mg·L-1IBA + 1.0 mg·L-1KT+30 g·L-1蔗糖+8.2 g·L-1琼脂,pH 值5.8;T3:WPM +0.2 mg·L-1IBA+30 g·L-1蔗糖+8.2 g·L-1琼脂,pH 值5.8。 每个葡萄品种选择经过启动培养萌发的新芽(梢)≥10 个,接种在上述3 种培养基上,记为第1 代。 每45 d 继代一次,记录前3 代的繁殖体增殖系数和生根率。 继代增殖系数是以每个茎段作为一个繁殖体,继代一次可获得多个用于繁殖下一代的茎段(繁殖体),上下两代之间繁殖体数量之比值,取平均值。 生根率是统计每个繁殖体是否发生不定根,每代发生不定根的繁殖体数与总繁殖体数之比值,按百分率计算,取平均值。 培养环境:光照强度为30 ~40 μmol·m-2·s-1,光照时间为14 h·d-1,培养温度为25±2℃。
1.2.3 驯化移栽 选择继代培养45 d 生长健壮的组培苗,水清洗根部残留的培养基,放入装有改良的霍格兰德半营养液(霍格兰德营养液的大量元素用量减半)的广口瓶中,室内自然光下覆膜培养2 周,再用全霍格兰德营养液练苗(去膜)1~2 周(去膜时注意观察组培苗是否萎蔫,若2h 后仍不萎蔫则去膜培养),每周更换营养液。
水培炼苗结束后,移栽至营养钵(直径6.5 cm)中,营养土和蛭石按1 ∶1(v ∶v)混合。 搭建小拱棚,保温(25± 2℃)保湿(相对湿度100%),注意通风换气。移栽后第4 周即可去掉覆盖物[12]。 统计移栽后组培苗的成活率。
1.3 数据处理
采用Microsoft Excel 2013 进行数据处理和作图。
2 结果与分析
2.1 恒温水浴处理时间对葡萄休眠枝条萌发的影响
45℃恒温水浴处理葡萄休眠枝条,在约2 周开始萌发新芽,3 周后新芽长至10 ~15 cm 长度,可以作为无菌接种的外植体。 不同水浴处理时间,休眠枝条的萌芽率不同,其中以处理1.5 h 的萌芽率最高(97.62%),处理3 h 的萌芽率次之(95.12%),处理4 h 的萌芽率最低(86.21%)。 结果表明,45℃恒温水浴处理1.5 h 可以有效打破葡萄枝条休眠。
2.2 不同浓度次氯酸钠溶液消毒对葡萄外植体成活的影响
高浓度(3%)次氯酸钠表面消毒处理,外植体在消毒后逐步出现红褐化现象,有时褐化延展至新萌芽的腋芽,使茎段上的腋芽不能正常萌发(图1-A);而减少消毒时间,外植体褐化程度有所降低,但污染率高,接种成活率低。 低浓度(0.3%~0.5%)次氯酸钠进行较长时间消毒,外植体能够保持正常绿色,幼嫩的茎段不出现褐化,外植体污染率低,且萌发的芽体生长良好(图1-B)。 夏黑葡萄外植体在高浓度和低浓度次氯酸钠消毒处理的接种成活率分别60.0%和100.0%,红地球分别为50.0%和88.7%,巨峰分别为57.1%和87.5%,玫瑰香分别为52.0%和93.9%。 结果表明,低浓度次氯酸钠消毒效果好。
2.3 不同培养基对葡萄茎段增殖生根培养的影响
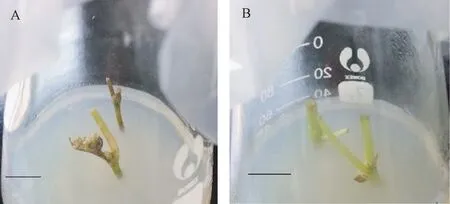
图1 不同浓度次氯酸钠消毒处理对夏黑葡萄外植体接种成活的影响Fig.1 Effect of different concentrations of sodium hypochlorite on survival of Summer Black grape explants

图2 4 个葡萄品种在不同培养基上的生长状态(40 d)Fig.2 Growth status of plantlets of four table grape cultivars on different mediums for 40 days
增殖生根培养过程中,3 种培养基均能促进葡萄茎段腋芽萌发和生长,但长势存在差异。 由图2、图3可知,T1 和T2 培养基中,葡萄茎段上的腋芽萌发率低、新梢生长瘦弱、叶片皱缩下垂、培养后期易出现玻璃化和褐化现象,不定根发生量少,且生长不良,不利于葡萄组培苗的扩繁;T3 培养基中的茎段腋芽萌发率高、新梢生长健壮、继代增殖系数相对较高,根系生长正常,不定根生长良好,侧根数量多。 继代40 d 后,随机选取T3 培养基上培养的9 株生长健壮、生根良好的组培苗,统计叶片数、平均株高、主根数量及平均根长。由表1 可知,夏黑和巨峰生根情况相对较好,红地球和玫瑰香植株长势相对良好,红地球的生根率相对较低。结果表明,T3 培养基为最佳培养基。
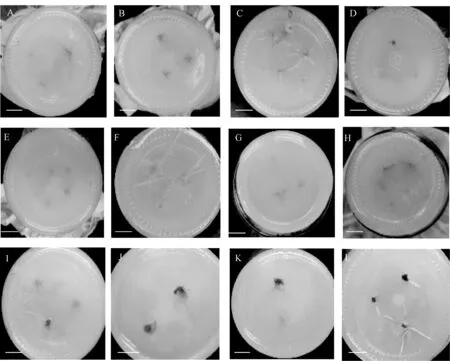
图3 4 个葡萄品种在不同培养基上的不定根生长状态(40 d)Fig.3 Growth status of adventitious roots of four table grape cultivars on different mediums for 40 days
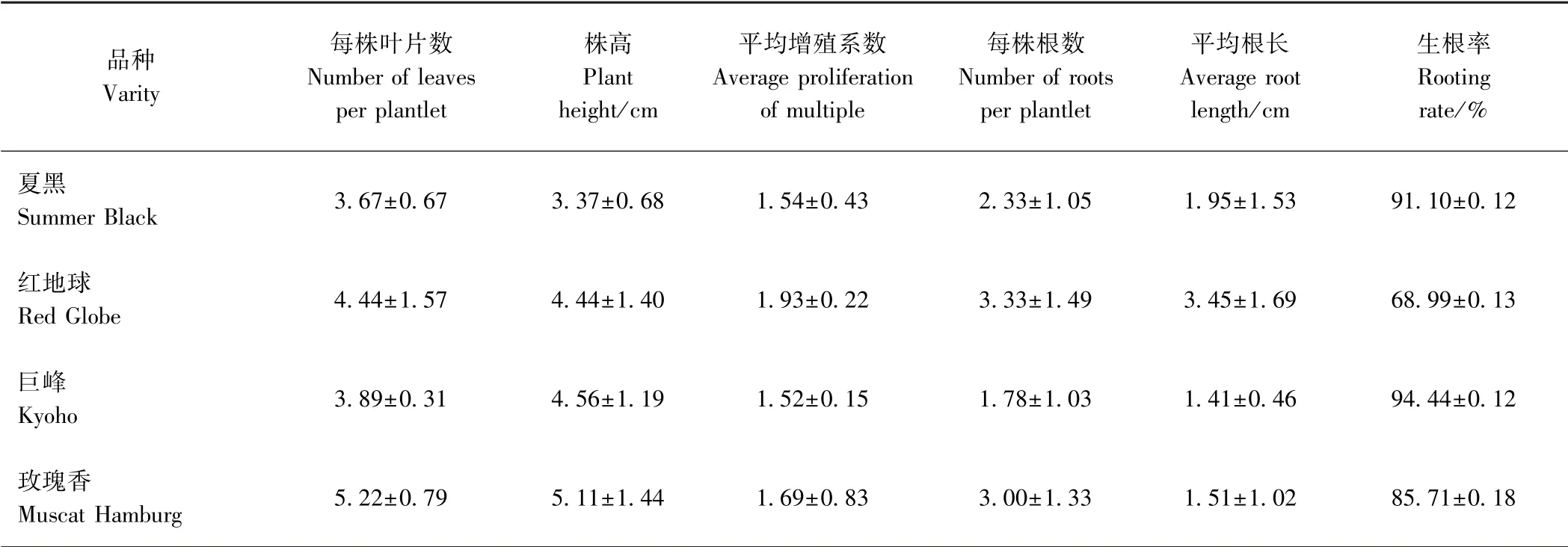
表1 4 个葡萄品种在T3 培养基上的继代培养Table 1 Subculture of plantlets of four grape cultivars on T3 medium
2.4 4 个鲜食葡萄驯化移栽情况
选取继代45 d 后的组培苗,水清洗根部残留的培养基,半营养液水培炼苗2 周后,生长健壮,根系生长良好(图4)。 利用全营养液继续培养1 周后移栽至温室内,4 周后统计移栽成活率,4 个品种的成活率均达100%(表2)。 结果表明,水培驯化适用于4 个鲜食葡萄品种,能有效的提高移栽成活率。
3 讨论
本试验通过对无菌外植体建立、启动培养、增殖培养和驯化移栽4 个关键技术的研究,建立了鲜食葡萄组培快繁体系。 将田间采集的冬季休眠葡萄枝条放入45℃恒温水浴处理1.5 h,可有效打破枝条休眠,低于1.5 h 处理效果还有待进一步探究。 选用葡萄长新梢(10 cm)、半木质化茎段为外植体,低浓度(0.3%~0.5%)次氯酸钠溶液长时间消毒,接种培养污染率较低,外植体萌芽率较高,尽管以升汞作消毒剂的污染率和褐化率均较低,但升汞具有毒性,对研究人员的身体健康有一定影响,而次氯酸钠溶液无毒,是葡萄组培的理想消毒方式[21-22]。 长新梢作为外植体消毒,伤口面少,消毒后再剪短茎段接种,可以减少褐化,有利于诱导腋芽萌发[9]。
培养基的成分对葡萄组培苗增殖和生根影响显著。 本研究中,添加0.2 mg·L-1IBA 的WPM 培养基中4 个葡萄品种的茎段增殖和生根效果均较好,而在1/2MS 培养基中,组培苗长势弱、生根较困难,这与前人研究[15-16,23]结果不同,可能与培养基中物质成分的种类(如盐离子、有机成分、激素等)、含量不同或品种基因型有关。 与1/2MS 培养基相比,WPM 培养基中不含铵态氮、硝态氮含量降低、钙离子含量增加,更适合葡萄组培苗的扩增。 植物组织培养继代过程中,可以通过腋芽产生不定芽(丛生芽)和腋芽萌发成新梢2种方式扩繁,生长素类物质在2 种方式中均是必需的,而细胞分裂素类物质在促发丛生芽的方式中是必需的[24-25],但在腋芽萌发成新梢的中不是必需的[8-9];生长素类物质与细胞分类素类物质浓度比例高,可以促进生根[26]。 本研究中,4 个鲜食葡萄品种以腋芽萌发成新梢的方式进行扩繁,不产生丛生芽,继代增殖系数相对较低[27-28],但新梢生长与生根同时进行,组培苗生长健壮,多次继代培养后无玻璃、褐化现象,同时简化了操作步骤。 红地球生根率相对较低,尽管随着继代次数的增多,生根率有所提高,但仍不及其他3 个品种,这可能与培养基成分、激素种类和比例不同有关[29],可通过调整生长素类物质和细胞分裂素类物质的种类及比例做进一步优化。
驯化移栽过程中,选择长势良好、根系发达的组培苗,水培炼苗3 周后移栽在适宜的环境条件中,4 个品种组培苗的移栽成活率均达到100%,较传统方法有明显提高[6,10]。 水培驯化使用的营养液中含有大量元素和微量元素,有利于组培苗的生长,提高组培苗的光合能力、根系吸水能力和环境适应能力,进而提高移栽成活率[20]。 该方法应用于葡萄苗木生产中可有效提高苗木生产速率。 葡萄组培苗水培驯化期间可能存在叶片长霉菌的现象,当发生此现象时应及时剪掉带菌叶片,以免影响该植株及其周围植株的生长;驯化时间可以根据组培苗的生长状态进行调整,植株根系发达且在去膜条件下也可正常生长,即可进行移栽。
4 结论
本研究建立了4 个鲜食葡萄品种组培快繁体系。以冬眠枝条恒温水浴1.5 h 促发萌芽效果最好;最佳消毒方式为0.3%~0.5%次氯酸钠消毒15 min;适宜的启动培养基为MS+0.2 mg·L-1IBA + 1.0 mg·L-16-BA +0.5 mg·L-1KT +4.0 mg·L-1腺嘌呤+30 g·L-1蔗糖+8.2 g·L-1琼脂;采用只添加0.2 mg·L-1IBA 的WPM培养基作为继代增殖兼生根培养基,有利于茎段上腋芽的萌发与根系的生长,但增殖系数相对较低,且红地球生根率较低;水培驯化为有效的驯化方式,有利于大规模生产。 整个组培繁殖体系基本适用于4 个鲜食葡萄品种的繁育,为其商业化生产提供了理论参考。

