大豆发状根乙醇诱导表达系统的建立及验证
洪冰杰 许 鑫 侯文胜 于丽杰 韩天富,∗
(1哈尔滨师范大学生命科学与技术学院,黑龙江哈尔滨 150025;2 中国农业科学院作物科学研究所/农业部北京大豆生物学重点实验室, 北京 100081)
大豆[Glycine max (L.) Merr.]是世界上最重要的油料作物和高蛋白粮食作物之一,也是转基因品种比例最高、种植面积最大的作物[1]。 目前,大豆全基因组测序工作已经完成,据估计,大豆中可编码蛋白的基因数量约5 万个[2],对数量如此庞大的基因进行功能验证是大豆生物技术和遗传育种工作者的研究重点。目前,已建立了多种基因表达研究系统,主要包括组成型、组织特异性型和化学诱导型三类[3-4],其中,花椰菜花叶病毒启动子(CaMV35S)是应用最广泛的组成型启动子,研究表明,该启动子可驱动外源基因在任何组织、器官内进行持续、高效的表达[5],但过量表达外源基因可能会对植株的生长发育造成不利影响,并影响对试验结果的判断。 当需要在特定组织、器官和特定发育阶段表达目的基因时,组成型启动子并不适合[6]。 为了能在时间和空间上实现对目的基因表达的人工调控,研究者常采用组织特异型启动子,该类启动子可在特定组织、器官内启动目的基因表达,但由于基因表达限定在少数类型的细胞和组织内,且无法对表达时期加以控制,使其在基因功能研究中的应用受到限制[7-8]。 与上述两类启动子相比,化学诱导型启动子可在诱导剂存在的条件下调节基因表达的开启和关闭,且基因表达量与诱导强度存在一定的剂量关系,能真正实现对基因表达的精准调控[6]。 目前,已建立了多种化学诱导系统[8],包括杀虫剂诱导表达系统[9]、类固醇诱导表达系统[10-11]、四环素诱导表达系统[12]、铜离子诱导表达系统[13]和乙醇诱导表达系统[14]等。 其中,乙醇诱导表达系统具有本底表达低、诱导效率高(少量的乙醇即可对基因表达产生显著影响)及诱导剂安全无毒等优势,具有较大的研究价值和生产应用潜力[15]。 该系统已在拟南芥[14]、甘蔗[16]、水稻[17]、烟草[18]、番茄[19]、油菜[20]和长春花[21]等植物中得到成功应用,但在大豆中尚鲜见报道。
大豆是典型的短日照作物,光周期反应敏感[22]。在大豆开花控制途径中,GmFT2a 是整合开花信号的关键基因,该基因的过量表达可使开花期明显提前[23-24]。 本研究采用发状根农杆菌(Agrobacterium rhizogenes)介导的根系转化体系,在大豆根系中建立目的基因表达可控的化学诱导表达系统,并以报告基因GUS 和目的基因GmFT2a 为例,研究乙醇诱导表达系统在大豆发状根中的诱导效率,以期为大豆基因功能研究和大豆开花期、成熟期的人工调控提供新的技术手段。
1 材料与方法
1.1 材料
pALCA 启动子和转录因子ALCR 的克隆载体由美国Syngenta Biotechnology 公司Martha M. Dunn 博士馈赠。 表达载体骨架pGFPGUSg 由pGFPGUSplus[25]改造而来,其中的潮霉素基因被置换成GFP 基因。 试验过程中使用的载体及菌种均由中国农业科学院作物科学研究所大豆分子育种实验室保存。
大豆品种为自贡冬豆,该品种原产于四川省自贡市,为光周期反应敏感的晚熟品种,具有开花逆转现象,是大豆光周期反应研究的模式材料[26]。
1.2 载体构建
1.2.1 诱导启动子克隆 参照Caddick 等[27]的方法构建载体,引物详见表1。 从ALCA 克隆载体SYN15中克隆TATA box 及其上游的246 bp 片段,与mini35S进行同源重组,融合为完整的启动子片段,命名为ALCA-mini35S。 mini35S 序列为TCTATATAAGGAAGT TCATTTCATTTGGAGAGAACACGGGGGACT。 参照北京全式金生物技术有限公司(TransGen Biotech)提供的pEASY-Uni Seamless Cloning and Assembly Kit 试剂盒说明书进行片段同源重组。
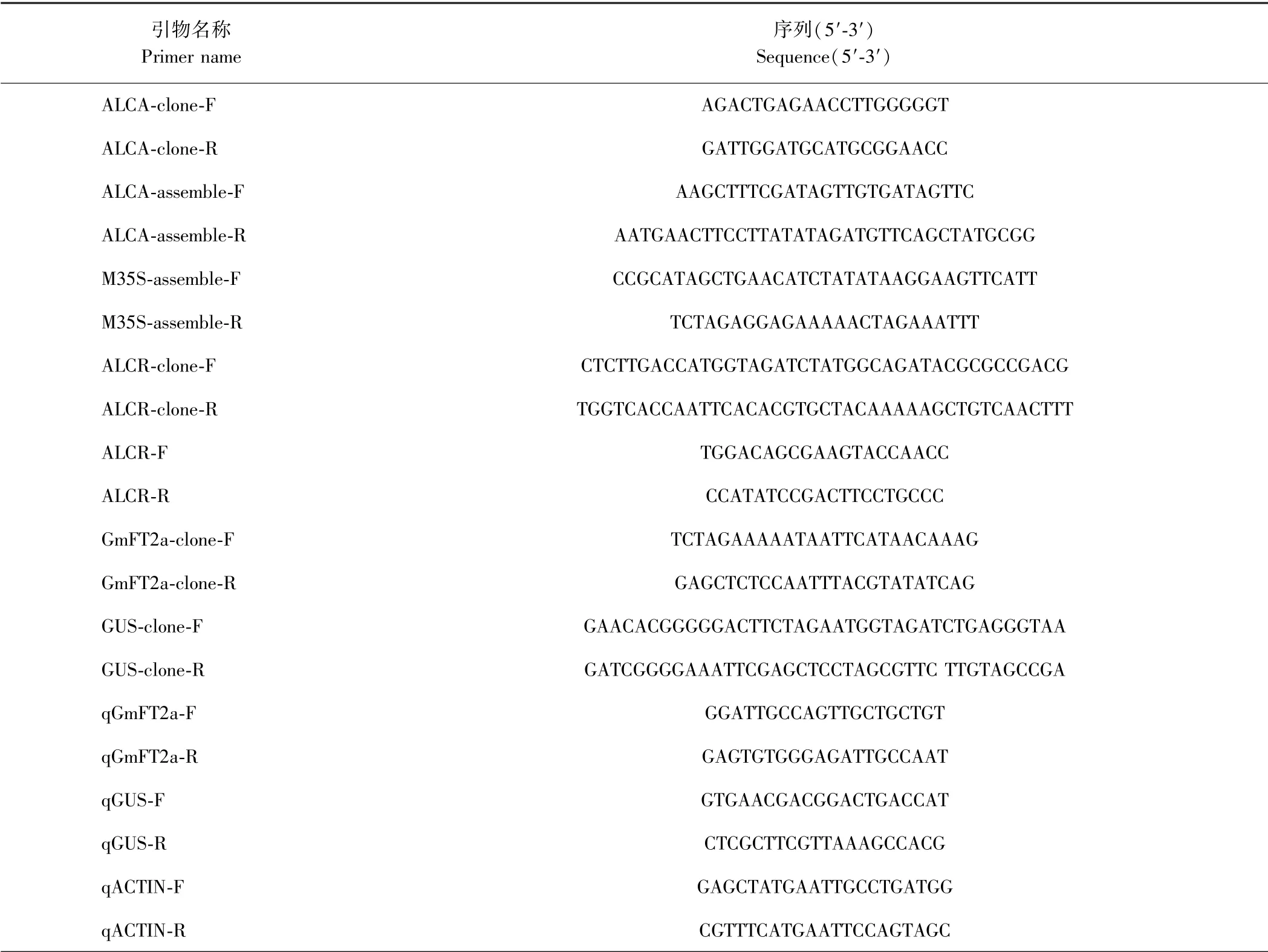
表1 引物序列表Table 1 Sequences of primers used in this study
1.2.2 表达载体构建 乙醇诱导表达载体的部分结构见图1。 载体T-DNA 区包含3 个转录单元,分别为35S 启动子驱动ALCR 表达的转录单元,ALCA-mini35S诱导启动子驱动目的基因表达的转录单元和35S 启动子驱动标记基因GFP 表达的转录单元。
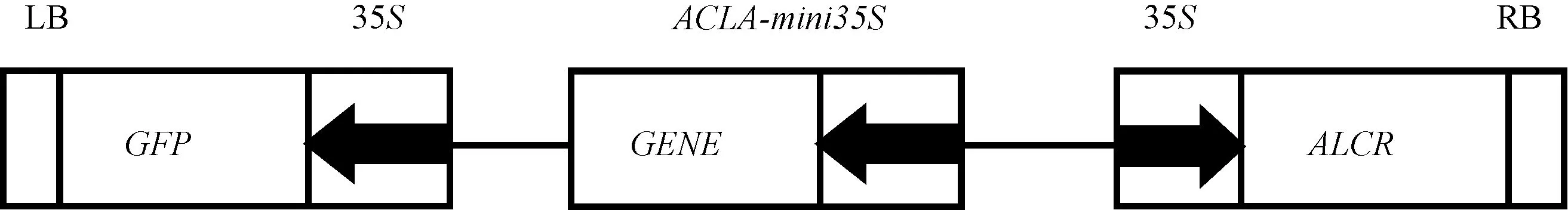
图1 乙醇诱导表达系统载体T-DNA 区结构示意图Fig.1 The T-DNA schematic diagram of ethanol inducible expression system
构建GUS 表达载体时先用Hind Ⅲ和Xba Ⅰ酶切ALCA-mini35S 片 段 和 pGFPGUSg 载 体, 将 ALCAmini35S 片段连接至pGFPGUSg 上,形成过渡载体1;利用XbaⅠ和SacⅠ将GUS 与过渡载体1 骨架连接得到过渡载体2;从SYNp17516 载体克隆ALCR 片段,用Pml Ⅰ和Bgl Ⅱ酶切过渡载体2,利用片段同源重组将ALCR 片段与过渡载体2 骨架连接,形成完整的GUS表达载体。
GmFT2a 表 达 载 体(ALCA-mini35S-GmFT2a) 与GUS 表达载体的构建流程基本相似,区别仅在于目的基因为GmFT2a。
1.3 转基因发状根的获得和鉴定
用电击法将转化载体转入发状根农杆菌K599中,经PCR 鉴定后保留阳性菌落。 以自贡冬豆为试验材料,通过K599 菌株介导的根系转化体系转化得到转基因发状根[28]。 当转基因发状根生长至13 ~15 d时,借助绿色荧光蛋白(green fluorescent protein,GFP)的显色特征,利用装有荧光激发模块的SMZ1500 体视显微镜(Nikon,日本)鉴定转基因阳性发状根。
1.4 cDNA 的获得和基因表达测定
将发状根用液氮研磨成粉末后,按照TransZol Up试剂盒(北京全式金生物技术有限公司)说明书提取总RNA。 然后按照EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix 试剂盒说明书(北京全式金生物技术有限公司)获得cDNA,稀释10 倍后保存。实时荧光定量PCR(RT-qPCR)按照KAPASYBR FAST qPCR Kit Master Mix 说明书操作,以GmActin 为内参基因[29],每个样本设3 次重复。 RT-qPCR 引物序列见表1。
1.5 GUS 酶活测定
采用荧光分析法测定GUS 酶活性。 将植物样品用液氮研磨成粉末,加入1 mL GUS 提取液,混匀1 min,15 000 r·min-1、4℃条件下离心10 min,吸取10 μL 上清液于新的离心管中,加入90 μL GUS 反应液,37℃反应1 h,加入900 μL 终止液终止反应。 溶液配制参照Chen 等[30]的方法,其中1 mg·mL-1牛血清蛋白(bovine serum albumin,BSA)标准溶液为Bradford 蛋白质定量试剂盒自带。 每个样品设置1 个反应时间为0 min 的空白对照,测定其在激发光365 nm、发射光455 nm 下的荧光光度值[31],平行测量3 次。
采用GUS 组织化学染色法[32]对发状根进行染色。 将组织浸入GUS 染液中放置过夜,染色完成后,将组织依次用50%、70%和90%乙醇脱色,最后用70%乙醇浸泡过夜。
1.6 不同浓度乙醇处理下发状根中GUS 相对表达量及GUS 酶活性的测定
将ALCA-mini35S-GUS 发状根及非转基因发状根分别浸入含设定浓度乙醇的1/2 MS 液体培养基中。经不同浓度乙醇诱导24 h 后取样,测定GUS 相对表达量和GUS 酶活性。 每1 条主根及其上着生的侧根为1个转化事件,统计为1 个样本。
1.7 不同诱导时段发状根中GUS 相对表达量及GUS 酶活性的测定
将ALCA-mini35S-GUS 发状根与非转基因发状根分别浸入含0.05%乙醇和不含乙醇的1/2 MS 液体培养基中。 处理期间分期取样,测定GUS 相对表达量和GUS酶活性。 测定时将同一处理的发状根随机分为3 组,每一组混合连续取样为一个生物学重复,共3 次重复。
1.8 乙醇诱导处理下转基因发状根中GmFT2a 的表达量测定
将ALCA-mini35S-GmFT2a 发状根分为2 组,一组用含0. 05%乙醇的1/2 MS 液体培养基处理,另一组用不含乙醇的1/2 MS 液体培养基处理,72 h后同时取样。 以非转基因发状根为对照。 每1 条主根及其上着生的侧根为1 个转化事件,统计为1个样本。
2 结果与分析
2.1 转基因发状根的鉴定
由图2 可知,转基因发状根中带有35S 启动子驱动报告基因GFP 表达的转录单元,在激发光照射下,GFP 蛋白可发出绿色荧光,说明载体导入大豆发状根,并将T-DNA 区插入转基因发状根中。
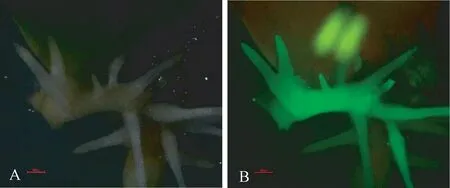
图2 转基因发状根的鉴定Fig.2 Identification of transgenic hairy root
2.2 不同浓度乙醇处理下GUS 的表达分析
2.2.1 非转基因发状根中GUS 的表达分析 由表2可知,不同浓度乙醇处理下非转基因发状根中GUS 表达量极低,差异不显著,说明乙醇未能促进非转基因大豆发状根中GUS 的表达。 由表3 可知,不同浓度乙醇处理下GUS 酶活差异也不显著。 由图3 可知,非转基因根在不添加乙醇处理(CK) 和添加乙醇处理(0.05%)下均未染色,说明乙醇不能诱导发状根中GUS 的本底表达。
2.2.2 不同浓度乙醇处理下转ALCA-mini35S-GUS 发状根中GUS 的表达分析 由表4 可知,不同浓度乙醇处理下转基因发状根中GUS 的表达量均上调,为CK的3.29 ~8.04 倍。 乙醇浓度为0.01%和0.05%时,GUS 的表达量与CK 差异极显著(P<0.01),且乙醇浓度为0.05%时GUS 表达量最高,变异范围为0.03 ~39.06。 由表5 可知,与CK 相比,不同浓度乙醇处理下GUS 酶活均增加,为CK 的1.81 ~3.58 倍。 乙醇浓度为0.01%和0.05%时,GUS 酶活与CK 差异极显著(P<0.01),且在乙醇浓度为0.05%时最高,变异范围为7.57~201.24。 样本间GUS 表达量和GUS 酶活差异明显,其原因可能是不同样本(发状根)为独立的转化事件,GUS 表达量受插入位置、拷贝数等因素的影响较大。
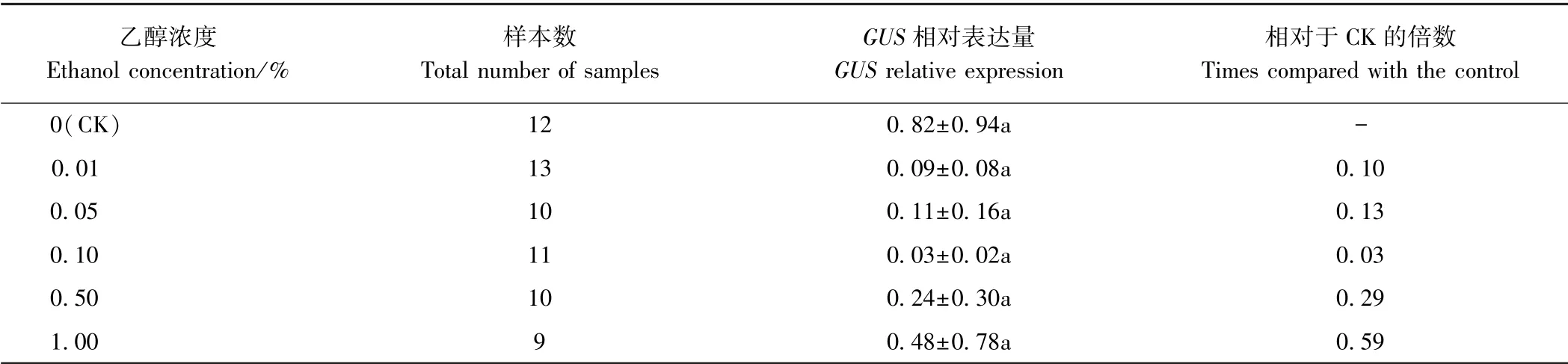
表2 不同浓度乙醇诱导下非转基因发状根中GUS 相对表达量Table 2 Relative expression level of GUS in non-transgenic hairy root treated with different ethanol concentrations
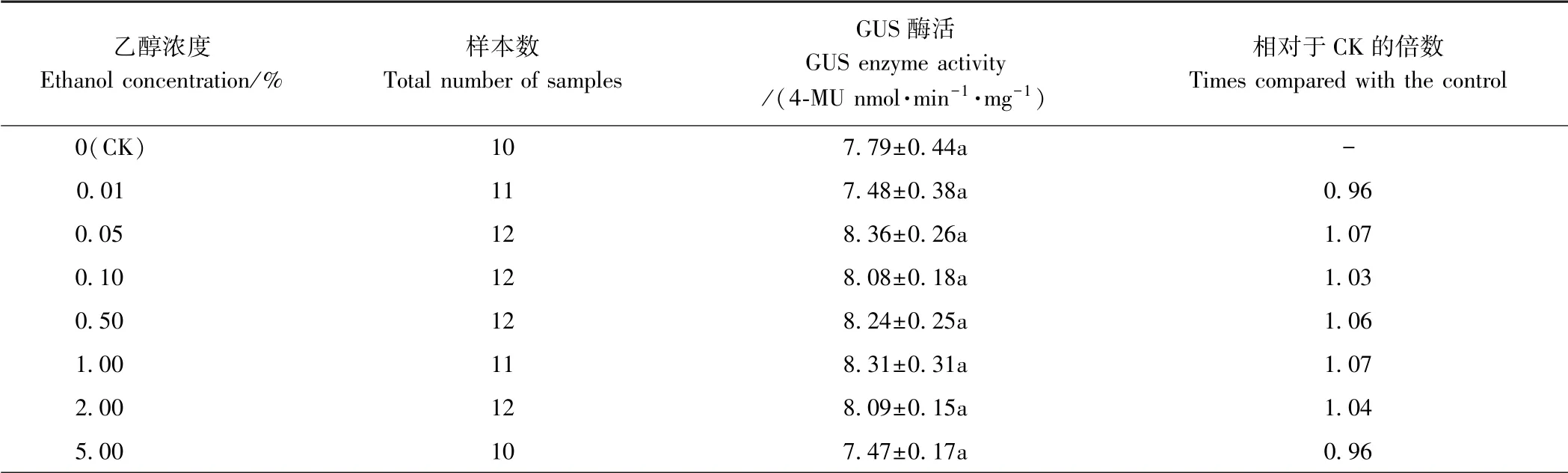
表3 不同浓度乙醇处理下非转基因发状根中GUS 酶活Table 3 GUS enzyme activity in non-transgenic hairy root treated with different ethanol concentrations
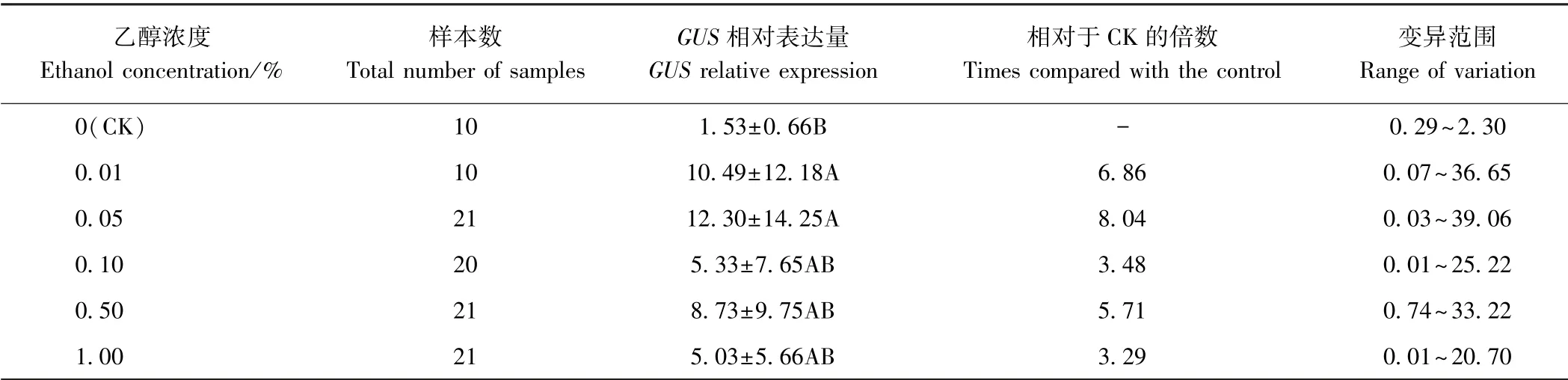
表4 不同浓度乙醇诱导下转基因发状根中GUS 相对表达量Table 4 Relative expression level of GUS in transgenic hairy root treated with different ethanol concentrations
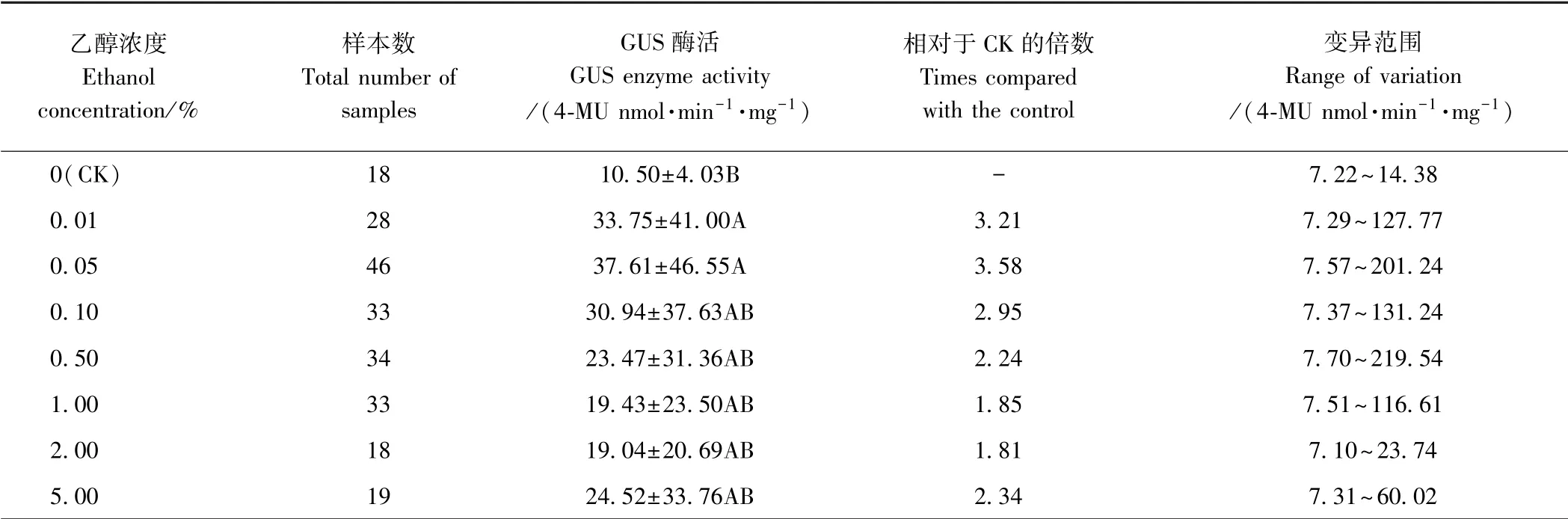
表5 不同浓度乙醇处理下转基因发状根中GUS 酶活Table 5 GUS activity in transgenic hairy root treated with different ethanol concentrations
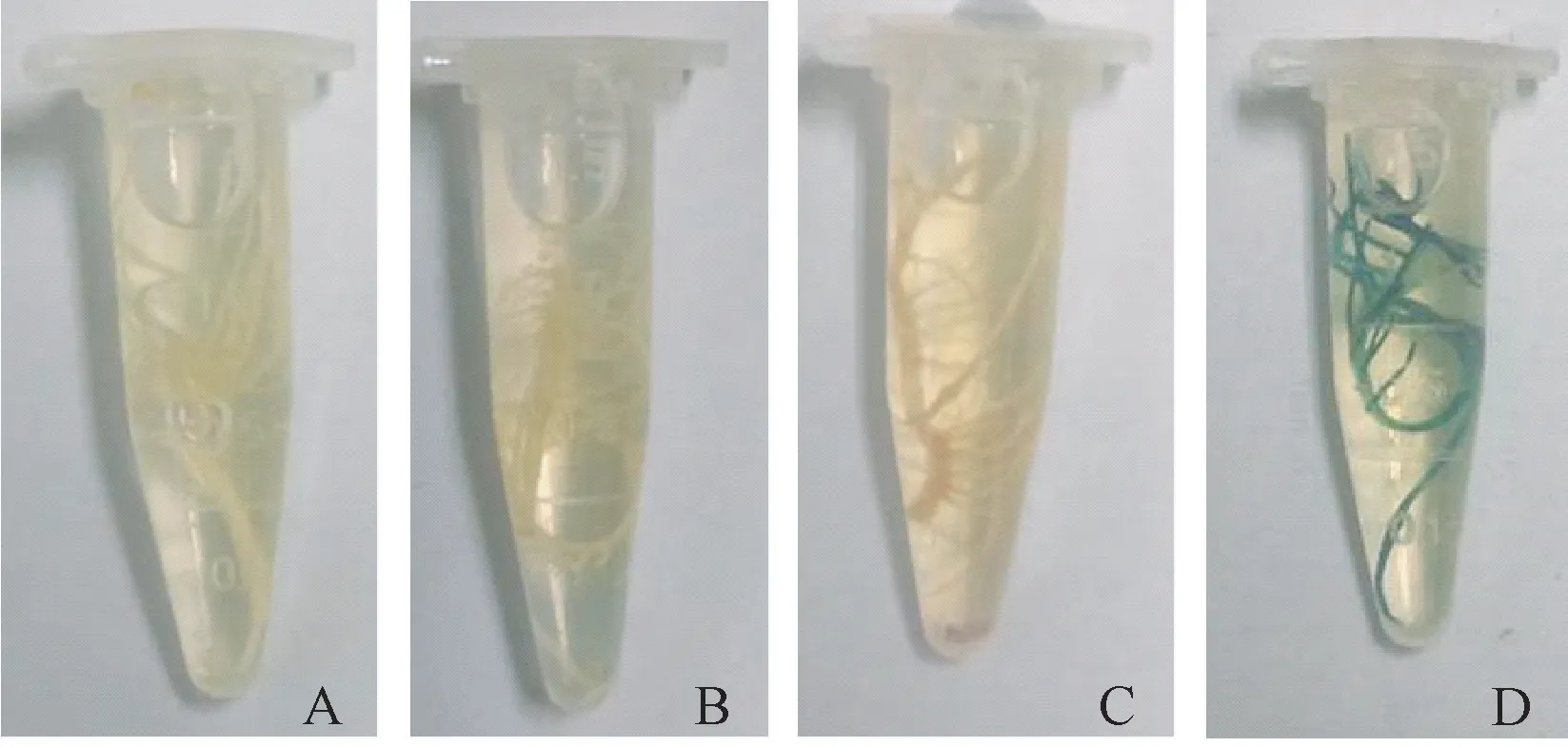
图3 转基因和非转基因发状根GUS 染色结果Fig.3 GUS staining of transgenic and non-transgenic soybean hairy roots
2.3 不同诱导时段转ALCA-mini35S-GUS 发状根中GUS 表达及GUS 酶活分析
由图4 可知,ALCA-mini35S-GUS 发状根中GUS 的表达量随着处理时间的增加呈先上升后下降的趋势。0.05%乙醇处理1 h 后,GUS 的表达量明显升高;当处理60 h 时,GUS 表达量达到最高值。 由图5 可知,GUS酶活随着处理时间的增加也呈先上升后下降的趋势,诱导2 h 时GUS 酶活略微升高,72 h 时GUS 酶活达到最大值。 上述结果表明,GUS 酶活达到最高值的时间晚于GUS 表达量,表明GUS 表达一段时间后GUS 蛋白的合成量才达到最高值。
2.4 乙醇诱导后ALCA-mini35S-GmFT2a 发状根中GmFT2a 表达分析
由表6 可知,TE 的GmFT2a 的相对表达量由TN的0.49 上调到75.67,增加了约150 倍,极大值为196.22,大约相当于初始值的400 倍。 NN 的GmFT2a的表达量由0 增加到NE 的0.33,差异不显著。 RTPCR 结果显示,0.05% 乙醇处理后ALCA-mini35SGmFT2a 发状根(TE)中能够检测到GmFT2a mRNA,而在0%乙醇处理72 h 的ALCA-mini35S-GmFT2a 发状根(TN)、0.05%乙醇处理72 h 的非转基因发状根(NE)和0%乙醇处理72 h 的非转基因发状根(NN)中均未检测到GmFT2a mRNA(图6),表明0.05%乙醇处理ALCA-mini35S-GmFT2a 发状根, 能够显著提高GmFT2a 的表达量。
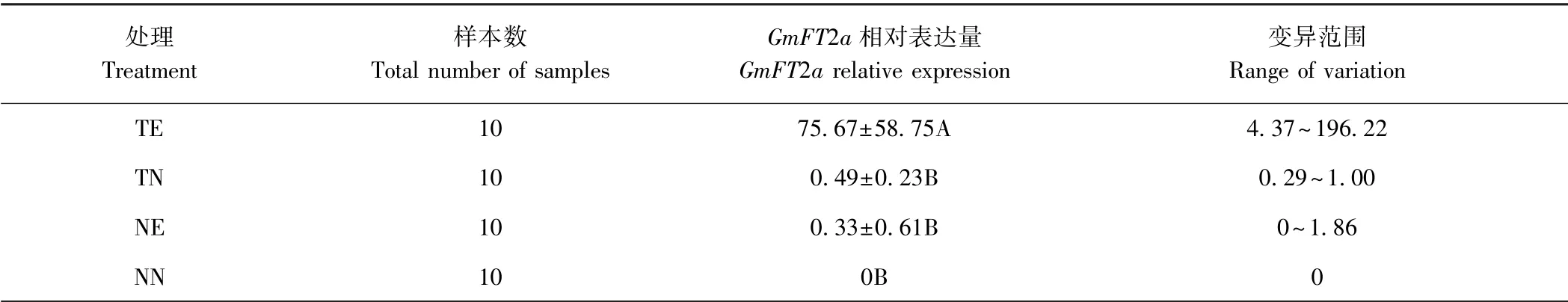
表6 乙醇诱导后转基因发状根中GmFT2a 相对表达量Table 6 Relative expression level of GmFT2a in transgenic hairy roots treated with ethanol
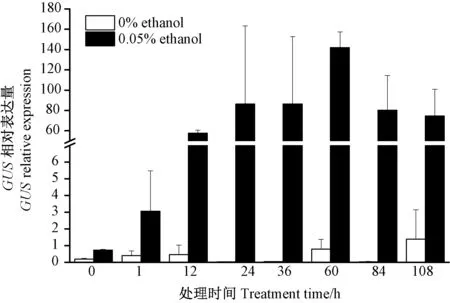
图4 不同诱导时段转基因发状根中GUS 相对表达量Fig.4 Relative expression level of GUS in transgenic hairy root treated under different inducing time
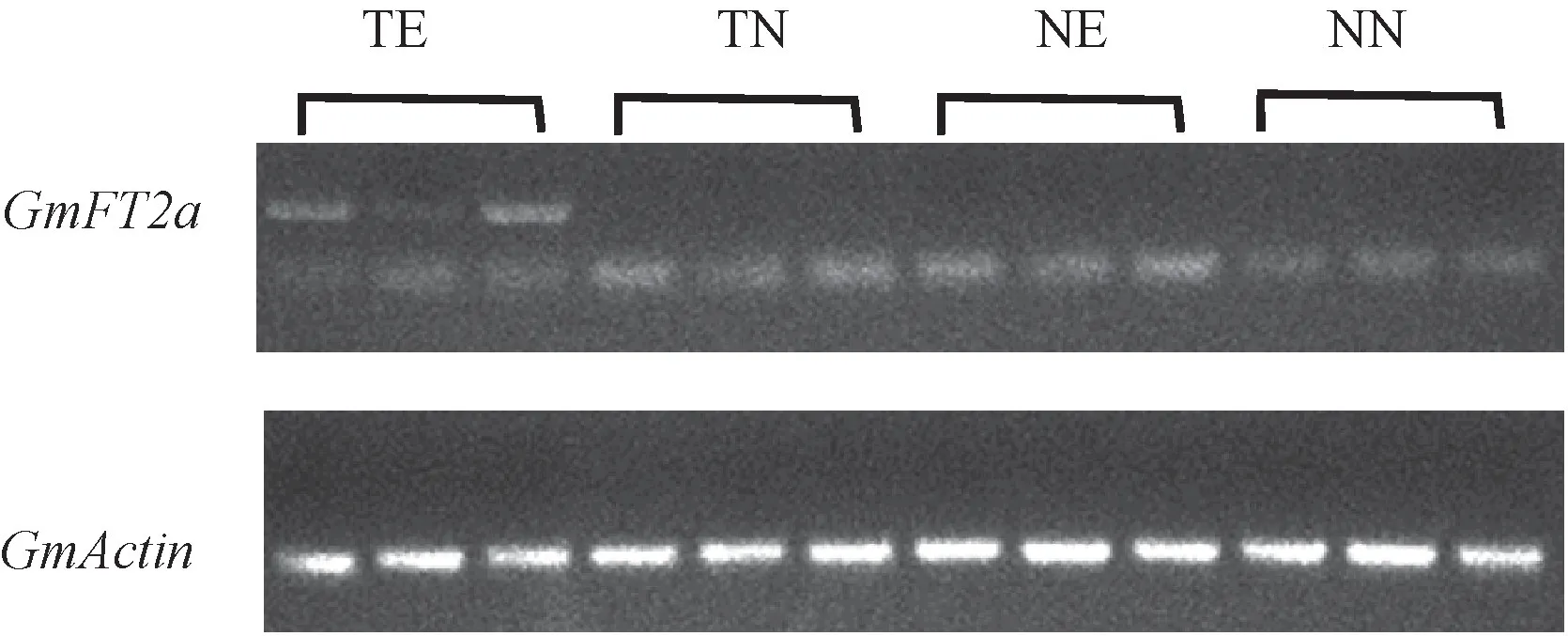
图6 乙醇诱导后转基因和非转基因发状根中GmFT2a 表达量Fig.6 GmFT2a expression in transgenic and non-transgenic hairy roots treated with ethanol
3 讨论
化学诱导表达系统可对外源基因进行定时、定位、定量表达,实现对基因表达的精准调控[4-6]。 本研究采用发状根农杆菌介导的根系转化体系,在大豆中建立了乙醇诱导表达系统,实现了对报告基因GUS 和目的基因GmFT2a 表达的人工调控,结果表明,乙醇诱导目的基因表达的水平与诱导剂乙醇在培养基中的浓度相关,当乙醇浓度为0.05%时,GUS 表达量和GUS 酶活最高。 与前人研究相比,本试验的大豆最佳乙醇诱导浓度低于拟南芥(2%)[14]、番茄(0.1%)[19]及胡杨(2%)[33],这可能与本研究采用培养皿诱导有关。 在组织培养条件下,将乙醇添加到液体培养基中与发状根充分接触,同时培养皿的封闭环境也最大程度地减少了乙醇蒸发,保证了其浓度的稳定。 0.05%乙醇处理1 h 后GUS 的表达量开始升高,GUS 酶活在2 h 后明显上升,表明乙醇诱导表达系统在大豆发状根中具有快速响应的特点,这与在拟南芥中的研究结果相近[14]。
本试验结果表明,乙醇诱导表达系统对目的基因的诱导效率较高。 该系统可应用于基因功能的快速鉴定,并在以根系为受体的生物反应器构建中具有潜在利用价值。 此外,目前大豆根系转化材料尚不能通过植株再生途径进行繁殖,如何在可遗传的整株材料中实现大豆基因的化学诱导表达仍是今后研究的重点。
在本研究中,同一处理下转基因样本之间报告基因GUS 和目的基因GmFT2a 的表达量差异较大,原因可能是每个样本(发状根)均由1 个受到转化的单细胞发育而来,是独立的转化事件,外源基因的插入位点和拷贝数等内在因素均可导致基因表达量出现差异[34]。
4 结论
本研究构建了驱动报告基因GUS 和目的基因GmFT2a 表达的乙醇诱导表达载体并转入大豆发状根,成功实现了外源基因在大豆中的乙醇诱导表达。该系统具有快速诱导和高效率表达的特性。 本研究结果为大豆基因功能研究和转基因育种提供了新的技术手段。

