不结球白菜游离小孢子培养及植株再生研究
黄天虹 张 娅 梁超凡 侯喜林 李 英
(南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业部华东地区园艺作物生物学与种质创新重点实验室,江苏 南京 210095)
游离小孢子培养(isolated microspore culture,IMC)是在无菌条件下,通过一定的机械操作和胁迫处理,阻断花蕾小孢子的固有发育途径,从而转向孢子体发生途径,经过诱导和培养,发育成为完整可育植株过程的技术[1]。 不结球白菜(Brassica campestris ssp. chinensis Makino)为异花授粉植物,自交不亲和性强,纯合较困难,而遗传稳定的纯合品系是植物杂种优势利用必需的育种材料。 传统自交育种技术耗时长且成本高[2],而游离小孢子培养可以在1 ~2年内获得纯合的双单倍体(doubled haploid,DH),缩短了育种周期,为育种工作者提供了性状优良的品种,扩大了不结球白菜的种质资源,满足了市场需求[3]。
Licher[4]于1982年首次通过游离小孢子培养在甘蓝型油菜(Brassica napus)中获得了胚状体。 近年来绝大多数芸薹属作物通过游离小孢子培养均已成功培养出小孢子再生植株[5-7]。 与传统育种技术相比,游离小孢子培养能够快速获得双倍体系,可直接用于培育新品种或作为优良亲本间接应用于品种改良[8]。 双倍体系在育种中不仅能用于快速获得新品种,还是研究数量性状遗传基础的重要工具,包括复杂性状的遗传图谱,如产量或质量性状、最具农艺价值的性状等[9]。 目前游离小孢子培养在芸薹属作物育种中已经培育出了许多具有高品质、非生物胁迫耐性及抗病的品种[10-12]。 此外,小孢子培养技术还可以用于转基因研究[13]、突变体育种[14]、生物化学和生理学研究[15-16]。
游离小孢子培养技术在不结球白菜上虽然已经进行了多年的育种研究和应用[17-22],但尚未形成一个完整高效的体系。 本研究通过比较不同处理下不结球白菜游离小孢子培养的出胚率,探讨不结球白菜游离小孢子培养的影响因素,同时对不结球游离小孢子发育及植株再生过程进行观察和倍性鉴定,以期为不结球白菜游离小孢子培养技术体系的优化提供技术支撑。
1 材料与方法
1.1 试验材料
以20 个基因型的不结球白菜为试验材料,由南京农业大学园艺学院白菜系统生物学实验室提供(表1)。 2015年9月,对不结球白菜种子低温春化处理,并播种于穴盘内,11月中旬定植于江苏省农业职业技术学院(句容)温室大棚,植株生长期间同常规温室管理。 2016年2月,植株开始抽薹现蕾开花,从初花期开始,整个植株的开花期间,都可以选取合适长度的花蕾进行游离小孢子培养。
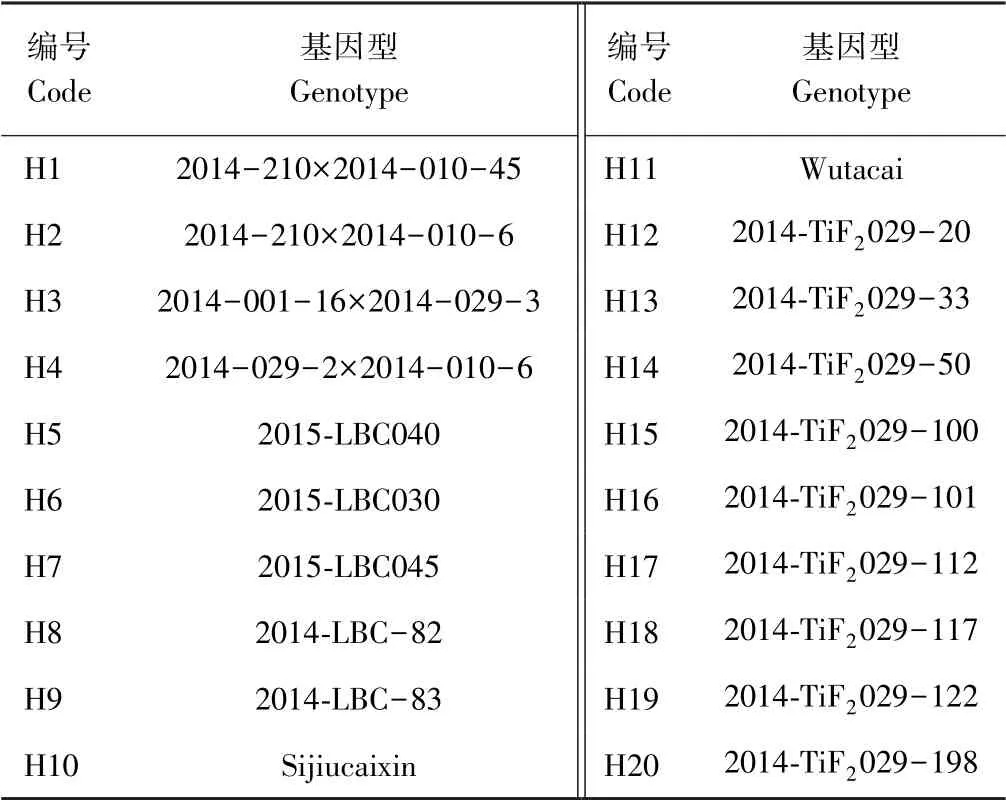
表1 供体植株编号及基因型Table 1 Donor plant code and genotype
1.2 试验方法
1.2.1 取样与观察 于天气晴朗的9:00-11:00 对无病虫害、长势健壮的植株花蕾进行取样,为减少环境误差,每个基因型从不同植株上取样,花蕾于4℃贮存备用。 将花蕾置于光学显微镜下,随机选取10 个视野观察小孢子的形态结构,并统计视野内单核晚期的小孢子所占比例。 对花瓣/花药(petal/anther,P/A)的长度比值进行比较,确定适合的花蕾大小,备用。
1.2.2 游离小孢子培养试验 参照张振超等[23]的方法,并略作改进。 将采集的花蕾样本用5.6%次氯酸钠溶液消毒18 min,无菌水冲洗3 min,并重复操作3次,然后将花蕾转移到100 mL 小烧杯中,加入2 mL B5 培养基(pH 值6.0),先用玻璃棒轻轻挤压,然后充分研磨成匀浆,过滤后转移至50 mL 离心管中,添加B5 培养基至7.5 mL,1 000 r·min-1离心5 min,保留沉淀,并添加B5 培养基至7.5 mL,1 000 r·min-1离心5 min,重复上述操作2 次。 于沉淀中加1/2 NLN 培养基(pH 值6.0)至40 mL,然后加入100 μL 活性炭溶液,最后将小孢子悬浮液分装至大小为60 mm×15 mm 的无菌塑料培养皿中,每皿4 mL,用Parafilm 膜对培养皿进行封口处理,并进行33℃热激处理1 d,然后转移至25℃无菌培养室内进行暗培养。 2 ~3 周后,当透明无污染的培养皿中出现肉眼可见的白色小颗粒时,将其转入60 r·min-1的摇床振荡暗培养。 3 ~4 周后统计小孢子胚的数目,计算出胚率。
1.2.3 不同基因型对游离小孢子培养的影响 按照1.2.2 所述方法,对20 个基因型的不结球白菜进行游离小孢子培养,每个处理设3 次重复,每重复培养10个皿,每皿40 个花蕾。 探究不同基因型对不结球白菜胚胎发生的影响。
1.2.4 低温胁迫处理对游离小孢子培养的影响 选取H1、H18、H19 和H20 4 个具有代表性基因型的不结球白菜并对其进行低温胁迫处理。 采集到的花蕾经4℃低温胁迫处理0、1、2 d 后进行游离小孢子培养,培养步骤同1.2.2。 每个处理设3 次重复,每重复培养10 个皿,每皿40 个花蕾。
1.2.5 头孢噻胯处理对游离小孢子胚胎培养的影响选取H1、H16 和H18 3 个具有代表性基因型的不结球白菜进行试验。 游离小孢子培养步骤同1.2.2。 最后1 次离心结束后,将游离小孢子分别在添加0(CK)、25、50、100、200 mg·L-1头孢噻胯的1/2 NLN 培养基中进行悬浮培养试验。 30 d 后统计游离小孢子胚状体数量。 每个处理设3 次重复,每重复培养10 个皿,每皿40 个花蕾。
1.2.6 游离小孢子植株再生及倍性鉴定试验 植株再生培养参照刘环环[22]的方法,并略作改进。 在VS-1 300L-U 超净工作台(苏静安泰,苏州)上将发育良好的子叶胚转移到B5 固体培养基中培养2 ~3 周。 待子叶胚长大至3~4 片真叶,转入MS 固体培养基中进行生根培养。 在MS 培养基中培养2 ~3 周,待发育为组织分化明显的小植株时,炼苗后移栽。 利用AccuriTmC6 流式细胞仪(BD 公司,美国)采用倍性测量法[21]鉴定倍性,倍体植株的峰值在220 nm 左右出现,因此在220 nm 左右出现峰值的即为双倍体。
1.3 数据处理
试验数据通过Microsoft Excel 2007 软件进行统计分析,运用SPSS 19.0 进行显著性分析。
2 结果与分析
2.1 不结球白菜游离小孢子发育时期与P/A 之间的关系
由表2 可知,当大多数小孢子处于单核晚期时,不结球白菜的P/A 介于0.8~1.1 之间;当小孢子处于单核中期到晚期的过渡时期时,P/A 大于1.1(图1-a);当大多数小孢子处于单核晚期时,P/A 为0.85 ~1.1(图1-b);小孢子接近成熟时,花药伸长,即将授粉,此时P/A 小于0.85(图1-c)。 因此,不结球白菜游离小孢子培养取材一般选择P/A 在0.85 ~1.1 之间的花蕾,此时的花蕾黄中带绿,是小孢子培养的最佳时期。

图1 游离小孢子的发育时期Fig.1 The development phase of free microspores
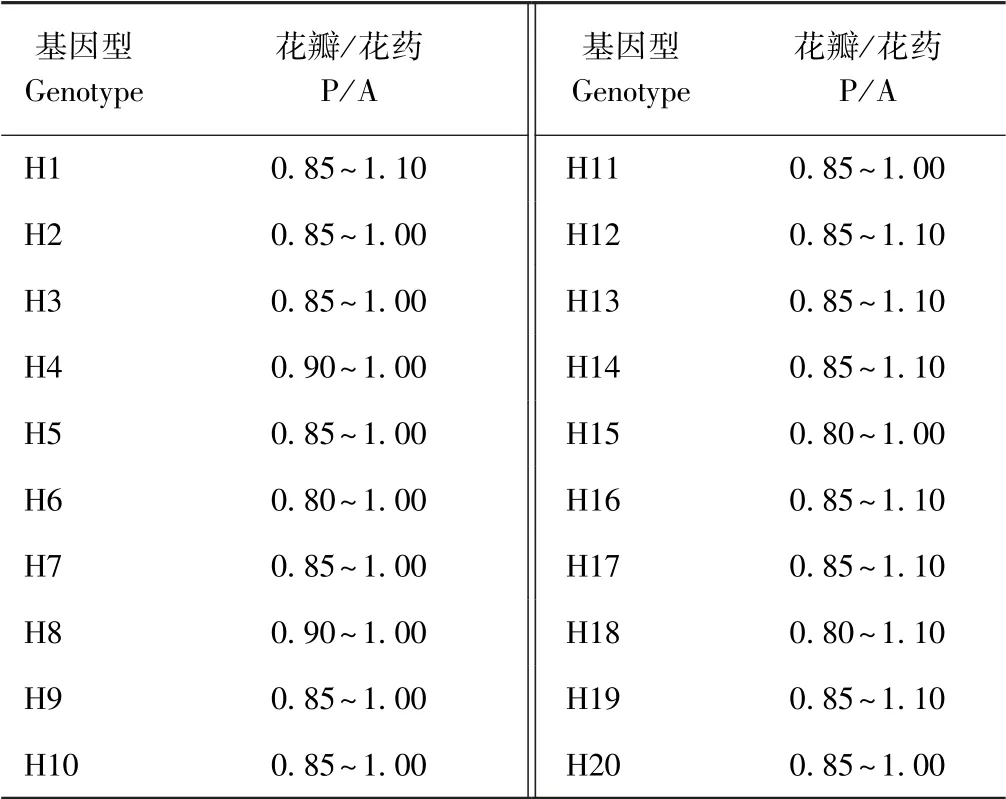
表2 供体植株游离小孢子单核晚期的P/ATable 2 The length ratio of petalslanthers at the late mononuclear stage of isdated microspores of donor plant
2.2 不同基因型对不结球白菜游离小孢子培养胚胎发生的影响
由表3 可知,20 个不结球白菜材料中有10 个基因型诱导出胚,诱导频率为50%。 此外,10 个品种的出胚率具有显著差异,出胚率最高的基因型为H20,每10 个花蕾出现胚状体数7.75,其次是H10,为6.88胚·10 蕾-1。
2.3 低温胁迫处理对不结球白菜游离小孢子培养胚胎发生的影响
由表4 可知,未经低温胁迫处理时,4 个基因型均未产生胚状体;低温胁迫处理1 d 时游离小孢子的出胚率最高,且不同基因型的小孢子出胚率存在差异,H20 出胚率最高,为7.66 胚·10 蕾-1,其次是H18(7.33 胚·10 蕾-1),H19 出胚率最低,仅0.67 胚·10蕾-1;低温胁迫处理2 d时仅H1出胚。 综上表明,4℃低温胁迫处理对游离小孢子胚胎的发生能力与处理时间和基因型密切相关。
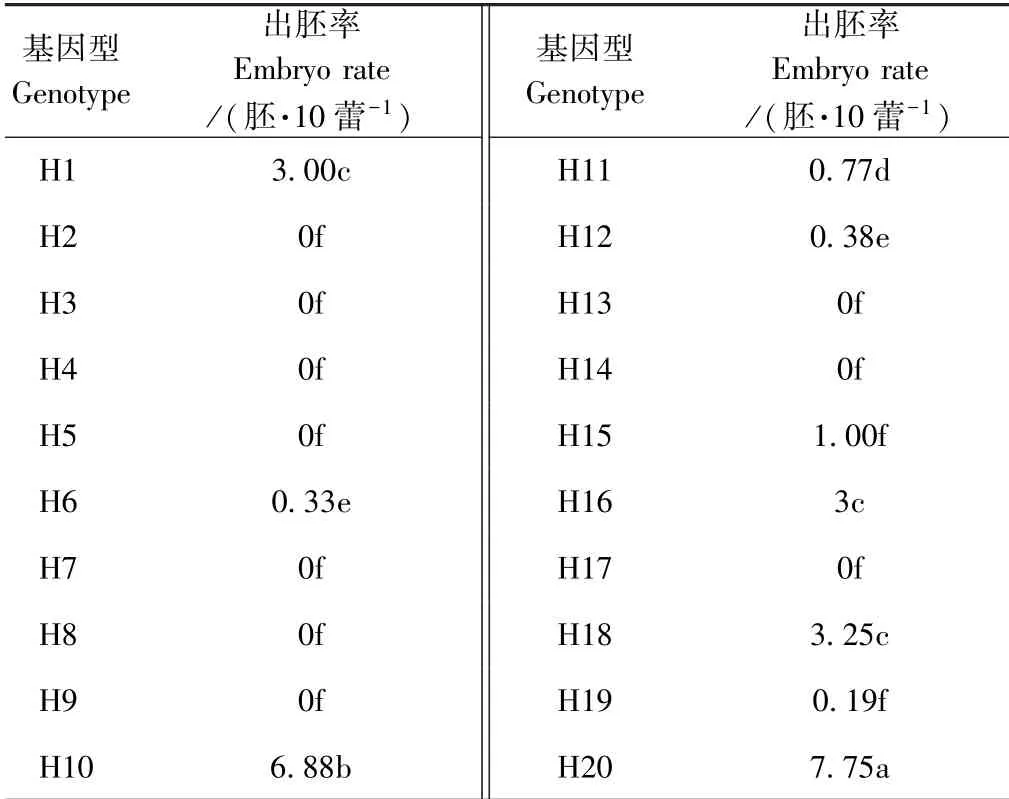
表3 不同基因型对游离小孢子出胚率的影响Table 3 Effect of different genotypes on germination rate of isolated microspores
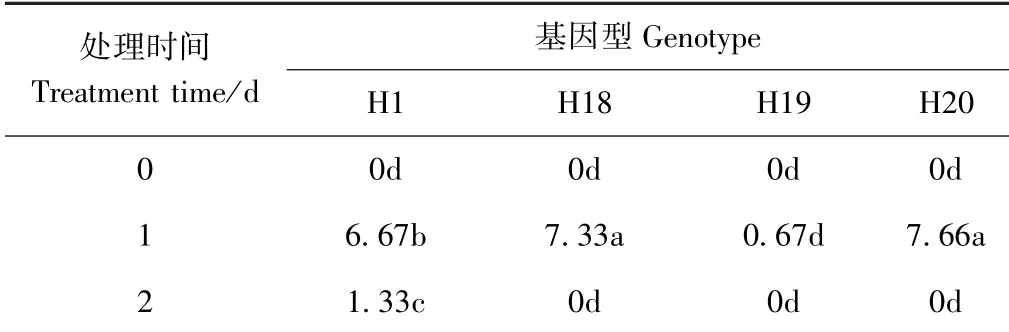
表4 4℃低温胁迫处理对游离小孢子出胚率的影响Table 4 Effect of 4℃cold stress on the germination rate of isolated micropores /(胚·10 蕾-1)
2.4 头孢噻胯对不结球白菜游离小孢子培养胚胎发生的影响
由图2 可知,游离小孢子出胚率与头孢噻胯浓度和基因型密切相关,未添加头孢噻胯时,基因型H18出胚率最高,胚状体数为17 个,而基因型H1 和H16出胚量极少,分别为0.5 和0 个,添加头孢噻胯会对基因型H18 中胚胎发生产生抑制作用,对基因型H1 和H16 产生一定的促进作用;添加50 mg·L-1头孢噻胯时,基因型H1 和H16 的出胚率均最大,胚状体数分别为4 个和6.5 个。
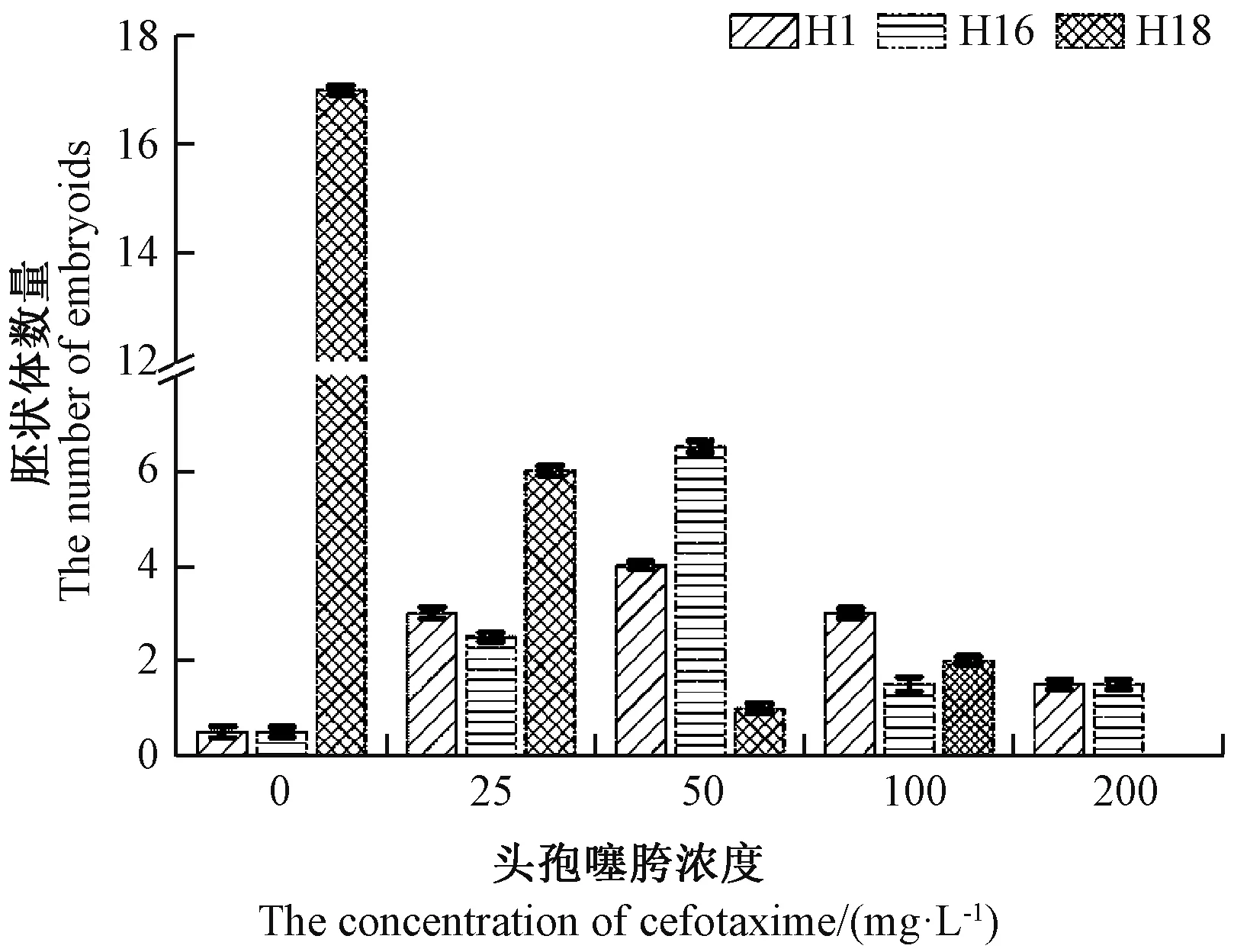
图2 头孢噻胯浓度对游离小孢子培养胚胎发生的影响Fig.2 Effect of cefotaxime concentration on embryogenesis of isolated microspore
2.5 小孢子胚胎发育过程观察及分析
在倒置显微镜下观察不结球白菜游离小孢子胚胎发育过程,热激处理1 d 时大多游离小孢子细胞未获得胚胎发生能力(图3-a),少数细胞膨大并开始发生对称分裂(图3-b);经过一系列的不规则的细胞分裂形成胚胎细胞簇,此时该细胞簇仍由小孢子外壁约束(图3-c),然后胚胎细胞簇继续发育形成球形胚(图3-d);培养7 d 左右时部分存活的小孢子发生多次分裂,最终导致细胞外壁开始破裂(图3-e),并释放出带胚柄的胚胎(图3-f),观察到正在进行纵向分裂的多细胞结构(图3-g);2~3 周后肉眼便可观察到白色小点,其生长迅速,很快长成子叶胚(图3-h、i)及愈伤组织(图3-j)。 随着培养天数的增加,存活的游离小孢子数量不断减少,只有少数的游离小孢子(<5%)成功形成胚状体。
2.6 游离小孢子胚胎再生能力分析

图3 小孢子胚胎发育过程Fig.3 Microspore-derived embryo development
经过游离小孢子培养获得的胚状体,进行植株再生试验,由表5 可知,从胚状体到再生幼苗阶段,胚胎再生频率因基因型不同而存在差异,H6、H15 和H19均在胚状体阶段死亡,未实现幼苗再生;H1、H13、H16、H18 和H20 均实现幼苗再生,但再生频率差异较大。
2.7 游离小孢子植株倍性鉴定分析
结合植株的形态观察结果,对游离小孢子植株进行流式细胞仪倍性鉴定分析,由表6 可知,共检测出21 个双倍体和2 个单倍体,自然加倍率为91.3%。 其中,H1、H13 和H16 的自然加倍率达到100%;H18 和H20 自然加倍率分别为80%和90%。 综上表明,不结球白菜的游离小孢子植株自然加倍率较高。
2.8 游离小孢子植株再生过程
对F2材料H20 从游离小孢子胚胎发育到植株再生过程进行持续观察,结果表明,子叶胚的初始颜色一般为淡黄色(图4-a),随着子叶胚的不断发育,子叶胚开始由淡黄色转变为绿色,胚轴伸长,并出现根毛(图4-b)。 继续观察发现,部分子叶胚在植株的根部产生愈伤,并褐化死亡(图4-c),部分子叶胚可直接发育成完整植株,且组织分化完全(图4-d、e、f)。 对正常发育的植株进行炼苗后,1 个月后将其转到人工气候室中培养,可观察到不同形态的植株(图4-h);培养6 个月后植株的形态仍各不相同(图4-i)。
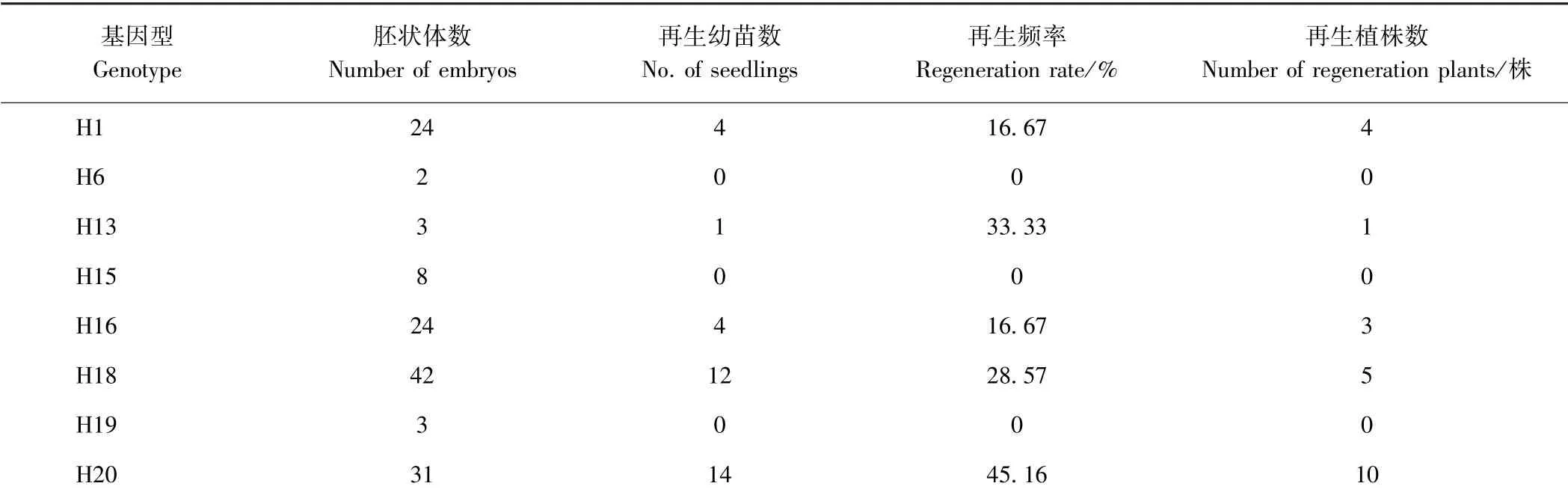
表5 游离小孢子胚胎植株再生状况Table 5 The condition of plant regeneration of microspore-derived embryos

表6 不结球白菜游离小孢子胚胎植株倍性鉴定Table 6 Ploidy identification of regeneration plant of microspore-derived embryos in non-heading Chinese cabbage
3 讨论
大量研究表明,基因型和发育时期是影响游离小孢子胚胎发生的主要因素[24-28],如不结球白菜大部分基因型出胚率均小于5 胚·蕾-1[22,29-30],甘蓝型油菜品种浙双758 和浙双72 出胚率能达到60 ~70胚·蕾-1[13], 花 椰 菜 品 种 xiaxue40 能 达 到 178胚·蕾-1[25],大白菜能达到42.4 胚·蕾-1[31],本试验中的20 个不同基因型的不结球白菜中仅10 个成功诱导出胚,且整体出胚率不高,最大的出胚率为7.75 胚·10蕾-1,与其他十字花科蔬菜相比,不结球白菜出胚率较少,且基因型对小孢子培养诱导效果起决定作用。 发育时期也是影响游离小孢子培养出胚率的关键因素,一般处于单核晚期至双核早期的游离小孢子较容易激发配子体胚胎发生能力,从而获得胚胎甚至完整植株。但是同一物种内基因型、生长环境等都会影响花蕾的大小,有的花蕾很小,可能已经进入双核晚期,但P/A则不会因为环境变化发生太大的改变,相对选择花蕾大小来说,比较可靠[28]。 本研究发现当P/A 介于0.85~1.10 时,小孢子主要处于单核晚期,此时是游离小孢子培养诱导胚胎发生的最佳阶段。
影响游离小孢子胚胎发生的因素有很多,如低温预处理[20-22]、蔗糖浓度[21]、小孢子培养密度[24]、培养基的组成[25-26],本研究发现4℃低温胁迫处理和头孢噻胯也会影响游离小孢子胚胎发生。 4℃低温胁迫处理1 d 时,出胚率最高,这可能是因为低温延迟了所采集花蕾的生长,并使其保持在一个较高的活性状态[2]。 头孢噻胯是一种抗生素,其对真核生物毒性较低,但对微生物有杀菌作用,此外,还具有类似于生长素的活性,可以促进体细胞胚胎发生及植株再生[32-34]。 本研究结果表明,H1 和H16 中1/2 NLN 培养基添加50 mg·L-1头孢噻胯对其胚的诱导效果最好,这与Ahmadi 等[35]和曾爱松等[36]的研究结果一致。但在H18 中未添加头孢噻胯的处理出胚率最高,表明头孢噻胯对不结球白菜游离小孢子胚胎发生的影响与基因型相关。

图4 H20 游离小孢子植株再生过程Fig.4 The regeneration of microspore-derived plant of H20
游离小孢子培养发育成长形成的胚状体,在形成完整可育的植株之前还需要经历再生培养及植株移栽过程,因为游离小孢子为花粉未成熟的配子体,经历胚胎发生后可能会产生加倍。 目前,有关游离小孢子培养植株的加倍的研究较多,如毛忠良等[28]对羽衣甘蓝游离小孢子植株进行秋水仙碱处理,并结合流式细胞仪倍性鉴定,发现其加倍率达到78.4%,提高了游离小孢子培养技术的利用率;成妍等[29]通过对不结球白菜暑绿和黄帮小孢子植株进行倍性鉴定,发现暑绿的自然加倍率达到90%,而黄帮的自然加倍率为62%,说明基因型不同,其自然加倍率也不同;袁素霞等[37]通过研究细胞倍性与气孔保卫细胞叶绿体数的相关性,提供了一种简便经济的倍性鉴定方法;王玉书等[38]研究发现观赏羽衣甘蓝中不同基因型倍性变异具有差异性,鉴定结果表明单倍体、二倍体和四倍体同时存在。 本试验通过流式细胞仪对所获得的游离小孢子植株进行倍性鉴定,共检测出21 个双倍体和2 个单倍体,自然加倍率为91.3%。 但不结球白菜的自然加倍率较高的原因尚不清楚,有待进一步更深入的研究。
4 结论
本试验结果表明,基因型是影响小孢子培养的出胚率和其后的植株再生的关键因素。 当P/A 为0.85~1.10 时,不结球白菜小孢子主要处于单核晚期;4℃低温胁迫处理1 d 时出胚率较高,头孢噻胯对出胚率的影响与基因型相关,不结球白菜植株自然加倍率较高,为91.3%。 头孢噻胯对小孢子培养具有基因特异性相一致,但由于本试验出胚率较少,仅能对今后的不结球白菜游离小孢子培养提供参考价值。

