一个水稻黄绿叶突变体ygl15 的鉴定和基因定位
魏玲霞 王 颖 郭 蓉 杜 丹 毛英杰 杨 超 黄英金 王兆海,∗
(1 江西农业大学作物生理生态与遗传育种教育部重点实验室,江西 南昌 330045;2江西农业大学生物科学与工程学院,江西 南昌 330045)
水稻(Oryza sativa L.)是世界上最主要的粮食作物之一,也是单子叶模式植物。 叶片是植物光合作用的重要器官,水稻产量和品质与叶片的光合作用密切相关[1]。 叶色变异是指植物色素的代谢或稳定性发生异常从而造成叶片颜色改变。 大量研究表明,叶色变异突变体是研究植物光合作用[2]、解析植物色素代谢途径[3]、叶绿体发育途径[4]、光形态建成[5]、核质互作信号途径[6-7]等生物学过程的重要材料。 此外,水稻叶色突变体也广泛用于作物性状标记、不育系良种繁殖等领域的研究[8-11]。
目前,水稻中共有11 个叶绿素合成关键酶基因被克隆,除CAO2[12]基因的T-DNA 插入突变体无可见突变表型外,其余10 个基因,包括RLIN1[13]、ChlH[14]、ChlI[15]、 ChlD[15-16]、 ChlM[17]、 CRD1[18-19]、 PORB[20]、DVR[21]、YGL1[22]和CAO1[12,23]突变会导致水稻叶片出现黑斑、黄色、黄绿、白化、光漂白等叶色变异表型。 此外,叶绿素降解途径中的基因发生突变,也会导致叶色变异,如水稻NYC1 和NOL 基因编码蛋白相互作用共同形成叶绿素b 还原酶,发挥降解叶绿素b 的作用,突变体nyc1 和nol 因叶绿素b 降解受阻而导致其后期叶片持绿[24-25]。 血红素代谢途径基因的突变,通常会影响叶绿素的合成,从而导致叶色变异,如水稻突变体ygl2 因血红素加氧酶基因的突变,导致叶片呈黄绿叶表型[26]。 类胡萝卜素合成途径中的基因突变也会导致叶色突变体的产生,如水稻八氢番茄红素脱氢酶PDS、ζ-胡萝卜素脱氢酶ZDS、β-环化酶β-LCY 和类胡萝卜素异构酶CRTISO 等基因的突变均会导致类胡萝卜素的合成途径受损,进而引起光氧化,出现黄化、白化或光漂白等叶表型突变体[27-29]。
截至目前,水稻中已发现了多种与叶绿体发育相关的基因,其突变会导致叶绿体发育异常,进而影响色素的合成和稳定,从而导致叶色变异。 YGL138(t)基因被预测编码1 个“信号识别颗粒54 kD 蛋白”,在叶绿体中多肽的形成和定位运输方面起作用,并参与叶绿体的发育过程,其突变体ygl138 表现出黄绿叶[30]。质体酪蛋白酶基因VYL 在幼叶叶绿体的发育过程中发挥作用,其突变导致水稻叶片呈淡绿萎黄叶[31]。WSL3 基因编码质体RNA 聚合酶的重要组分,TCD10基因编码1 个质体定位的PPR 蛋白,它们的突变导致植株叶片在低温下出现白化表型,这2 个基因参与低温胁迫下叶绿体的早期发育[32-33]。 定位和克隆更多的叶色突变基因,有助于更加全面地阐明叶色突变机制。
本研究对前期获得的1 个性状稳定遗传的水稻黄绿叶突变体ygl15 进行表型分析和基因定位,以期为突变体ygl15 进一步克隆及其基因功能研究奠定一定的理论基础。
1 材料与方法
1.1 试验材料
水稻黄绿叶突变体ygl15 来源于喜玉/ /PA64S/丰富占的杂交群体分离后代(由武汉大学生命科学学院李阳生教授提供)。 经在海南陵水、湖北武汉、江西南昌等地多代繁殖和观察,突变体ygl15 的黄绿叶性状能稳定遗传。
1.2 试验方法
1.2.1 叶绿素含量测定 取野生型和突变体ygl15植株苗期叶片,液氮研磨,采用丙酮法[34]测定叶绿素和类胡萝卜素的含量。 每个样品分别设3 次生物学重复和3 次技术重复。
1.2.2 基因表达分析 苗期叶片取样后立即用液氮冷冻,-80℃保存备用。 利用TRIZOL试剂盒(Invitrogen,美国)提取总RNA;将DNase 处理过的总RNA 用MMLV 反转录酶(Promega,美国)合成总cDNA。 荧光定量PCR 采用2×TB GreenTMPremix Ex TaqTM试剂(TaKaRa,日本)在Bio-Rad CFX96 荧光定量PCR 仪(BioRad,美国)上进行。 内参基因为Actin1、Profilin-2和UBC[35]。 每个样品分别设3 次生物学重复和3 次技术重复。
1.2.3 定位群体的构建和遗传分析 以突变体ygl15为母本,分别与粳稻品种中花11 和日本晴杂交,得到杂交F1种子;F1植株再自交得到F2种子。 分单株收取F2种子进行种植。 观察杂交F1和F2植株叶片的颜色表型并进行遗传分析;以突变体ygl15/中花11 的F2群体作为初步定位和精细定位群体。
1.2.4 基因定位 参照文献[36]进行。 在突变体ygl15/中花11 的F2群体植株中随机选取66 株黄绿叶突变表型单株,提取叶片DNA。 利用分布于12 条染色体上的突变体ygl15 与中花11 的多态性分子标记,对这66 个单株进行PCR 带型分析,并进行初步定位;根据NCBI(http:/ /www.ncbi.nlm.nih.gov/)网站上提供的水稻籼稻9311 和粳稻日本晴基因组序列,开发和筛选初步定位区间内ygl15 和中花11 之间的多态性分子标记并用于精细定位;在突变体ygl15/中花11 的F2群体植株中,对300 株黄绿叶突变表型单株取材,提取DNA。 利用PCR 检测初步定位区间内的多态性分子标记这300 个F2黄绿叶突变表型单株中的交换单株,并进行精细定位分析。
2 结果与分析
2.1 突变体ygl15 的黄绿叶叶色表型鉴定
在自然条件下,突变体ygl15 萌芽后从苗期开始表现出黄绿叶表型(图1-A)。 与WT 相比,突变体ygl15 的叶绿素和类胡萝卜素的含量显著下降(图2-B、C),表明突变体ygl15 的叶绿素合成受到抑制。
2.2 突变体ygl15 的农艺性状鉴定
由表1 可知,突变体ygl15 的株高、有效穗数、单株总粒数和单株实粒数分别较WT 显著下降了17.2%、37.5%、51.6%和51.6%,其中,突变体ygl15 的株高和有效穗数极显著高于WT;突变体ygl15 穗长、每穗粒数和结实率低于WT,但差异不显著;突变体ygl15 千粒重较WT 提高了4.0%,且差异具有显著性。
2.3 叶绿体基因的定量表达分析
利用荧光定量PCR 对叶绿素合成途径、光合系统相关以及血红素合成途径的关键基因进行基因转录表达分析。 结果表明,与WT 相比,突变体ygl15 中叶绿素合成途径中的关键酶基因HEMA1、ChlM、YGL1 和CAO1 的基因表达量均显著上调,其中HEMA1、ChlM和CAO1 极显著上调(图2-A);光合系统相关的关键基因PsaA、PsaB、PsbA 和PsbB 为叶绿体基因,它们的基因表达量也均显著上调,其中PsaA 和PsbA 极显著上调(图2-B);而血红素合成途径中的关键基因FCI和HO1 的基因表达量分别显著、极显著下调,而FCII和HY 的基因表达量无明显差异(图2-C)。
2.4 ygl15 突变体的遗传分析
利用突变体ygl15 与中花11 和日本晴分别进行杂交,得到中花11/ygl15 和日本晴/ygl15 这2 个杂交组合,2 个组合F1表型均为正常绿叶表型,F1植株自交得到F2群体。 在2 个F2群体中肉眼观察植株分别为绿叶和黄绿叶表型,=3.84,表明正常绿叶与黄绿叶植株数目均符合3 ∶1的分离比(表2),进一步表明突变体ygl15 突变性状受细胞核隐性单基因控制。
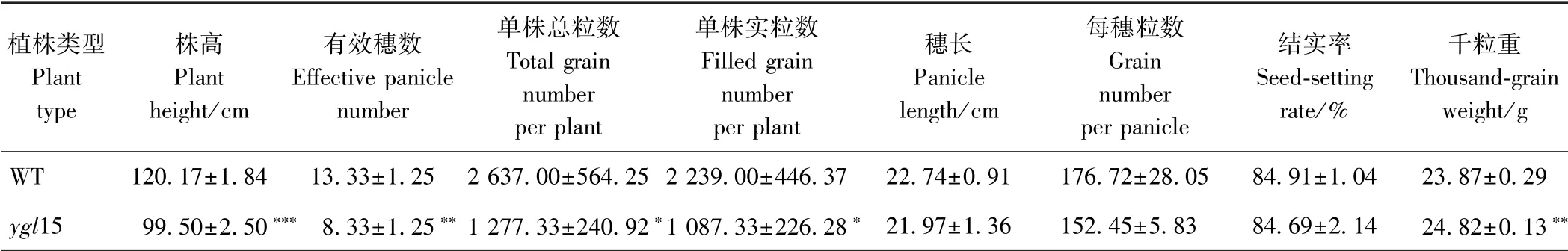
表1 野生型和突变体ygl15 的农艺性状鉴定Table 1 Identification of agronomic characteristics of the wild type and mutant ygl15
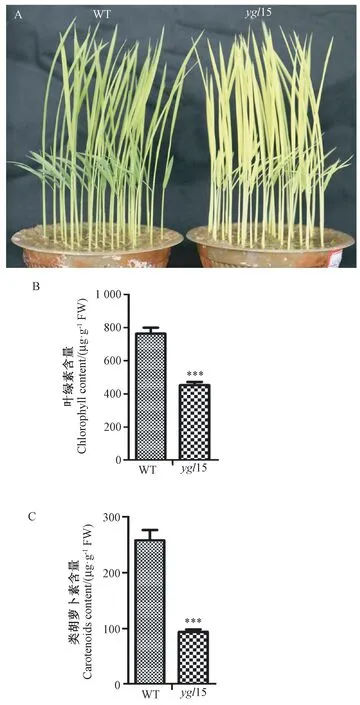
图1 野生型(WT)和突变体ygl15 的叶色表型及色素含量Fig.1 Leaf color phenotype and pigment content of the wild type and mutant ygl15
2.5 突变体ygl15 的基因定位
ygl15 基因的初步定位和精细定位利用突变体ygl15 和中花11 的F2群体进行。 筛取突变体ygl15 和中花11 之间的多态性SSR 分子标记共121 对,均匀分布在12 条染色体上。 初步定位取材F2群体中66 株黄绿叶突变表型植株,将ygl15 基因初步定位在第3号染色体的多态性分子标记RM14859 ~RM5551 之间,并与多态性分子标记chr03mm2581 紧密连锁。 初步定位的物理区间距离约1.28 Mb(图3-A)。
为了进一步缩小ygl15 基因的定位区间,选取F2群体中的300 株黄绿叶突变表型植株进行精细定位。根据已公布的粳稻品种日本晴和籼稻品种9311 的序列差异,在初步定位区间内开发出6 对多态性分子标记 M07982、 M08063、 M08124、 M08139、 M08175 和M08216(表3)。 最终将ygl15 基因限定在多态性分子标记M08124 ~M08175 之间,并与多态性分子标记M08139 紧密连锁。 精细定位的物理区间距离约79 kb(图3-B)。
3 讨论
本研究中突变体ygl15 从种子萌发后,叶片持续表现出黄绿叶表型;ygl15 叶片中叶绿素和类胡萝卜素含量显著下降,与前人关于水稻黄绿叶突变体的研究结果类似[20,26,30]。 水稻的黄绿叶突变对农艺性状的影响存在差异,如水稻黄绿叶突变体yl-1 的叶绿素含量下降,导致其株高、每穗粒数、单株产量严重下降,但其千粒重和结实率增加[17];水稻黄绿叶突变体824ys的叶绿素含量下降且植株生长发育严重迟缓,最终导致其株高、有效分蘖数、有效穗数、每穗粒数、结实率和千粒重均显著下降[20]。 水稻淡黄叶突变体ygr[37]和黄绿叶突变体ygl14(t)[38]的叶绿素和类胡萝卜素的含量均显著下降,但其株高、穗长、每穗粒数、结实率和千粒重等性状未受到影响。 本研究中突变体ygl15除叶色变异外,其株高、有效穗数、单株总粒数和实粒数也均下降,而每穗粒数和结实率与野生型差异不显著,千粒重略有上升。 有效穗数、每穗粒数、结实率和千粒重是水稻产量的关键决定因素,对突变体ygl15的进一步研究也将有助于解析叶色基因调控水稻产量的机理。
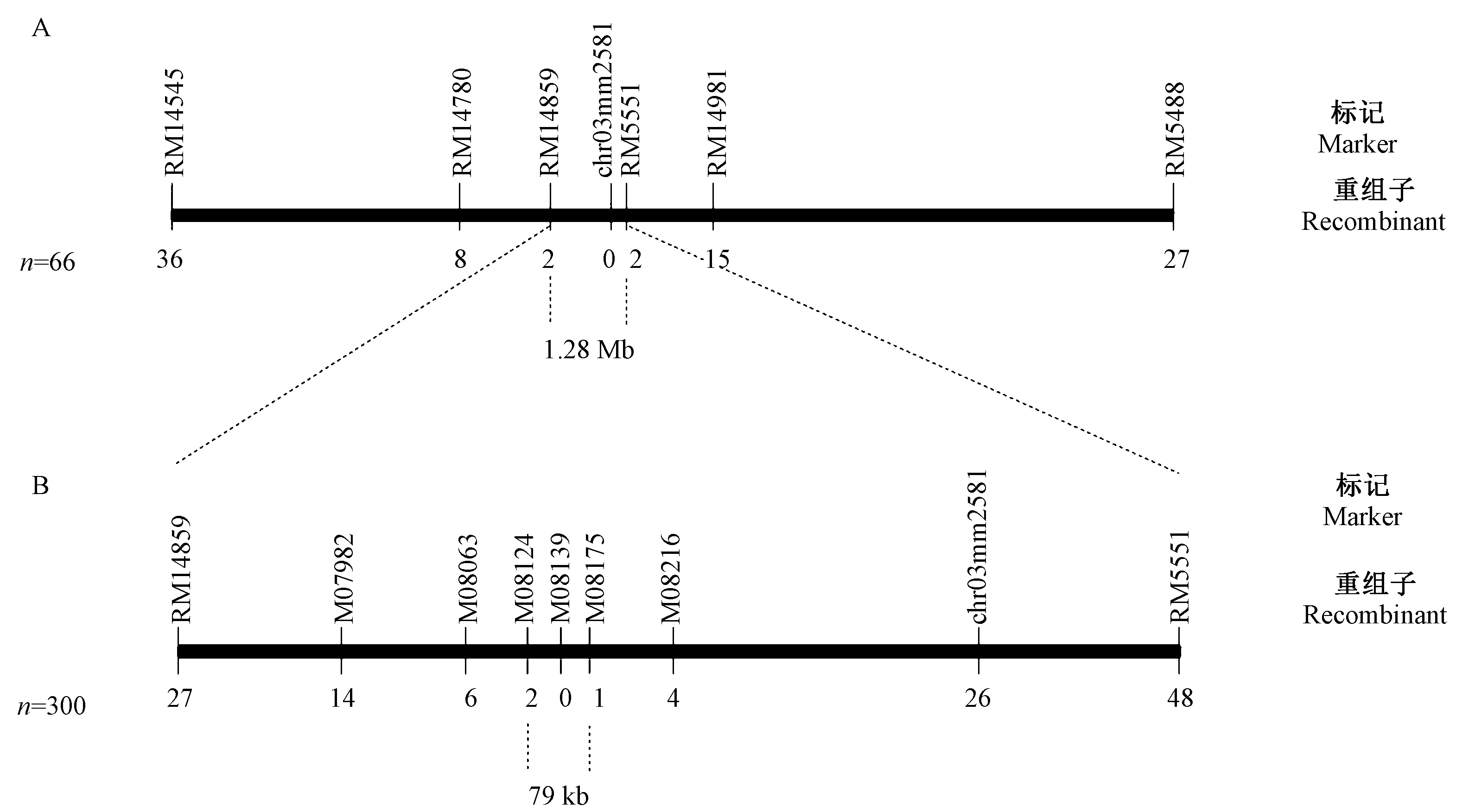
图3 ygl15 基因的定位Fig.3 Mapping of the ygl15 gene

表2 2 个杂交组合F2 群体的性状分离Table 2 Segregation of F2 populations from two crosses
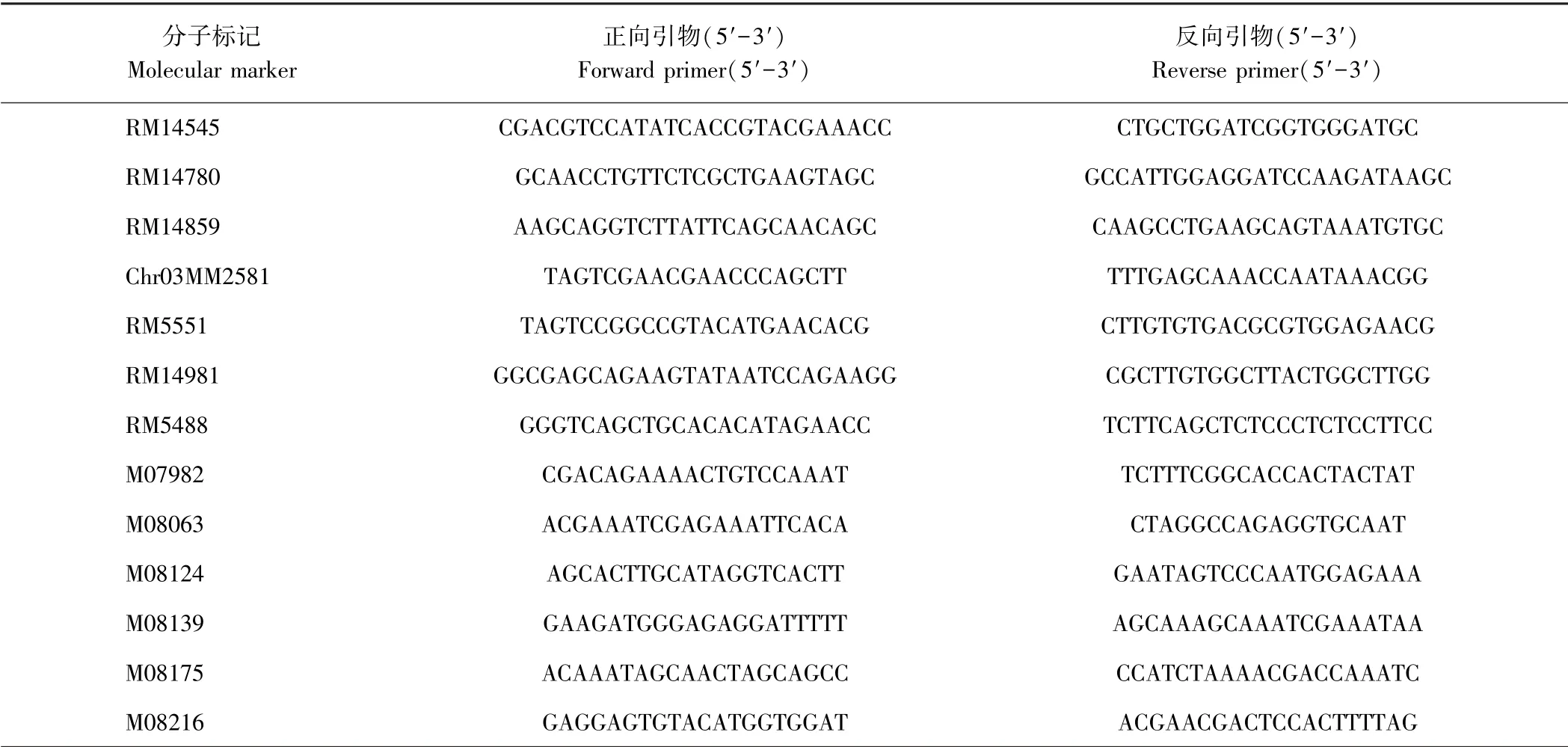
表3 ygl15 基因定位所用的分子标记引物序列Table 3 Primer sequence of molecular markers for ygl15 gene mapping
叶绿体中的蛋白大部分由细胞核基因组编码,少部分由质体基因组编码,叶绿体的状态受到细胞核的监控,可能存在质核反馈信号调控质体定位的核编码基因的表达[39]。 突变体ygl15 中所检测的核编码的叶绿素合成相关基因和质体编码的光合系统相关基因的表达均受到激发上调,这与叶绿素合成途径中的拟南芥镁原卟啉Ⅸ甲基转移酶基因突变体chlm[40]、镁原卟啉Ⅸ单甲酯环化酶基因突变体crd1[41]以及水稻镁螯合酶亚基ChlD 蛋白编码基因突变体ygl7[15]的研究结果一致。 但在水稻叶绿素合酶基因突变体ygl1 中,叶绿素合成和光合系统相关基因却呈下调表达[21]。YGL15 基因参与调控这些质体定位基因的表达模式机理,还有待ygl15 基因克隆后的进一步研究。
通过初步定位和精细定位,最终将目标基因ygl15定位在水稻第3 号染色体上约79 kb 的物理区间内。目前已报道的水稻黄绿叶基因有3 个被定位到第3 号染色体上,即叶绿体“信号识别颗粒43 kD 蛋白”编码基因OscpSRP43[42]、联乙烯还原酶基因OsDVR[20]以及铁氧化还原蛋白基因OsFdC2[43]。 OscpSRP43 被定位在第3 号染色体短臂上的分子标记RM569 ~ID32 之间,该基因的突变体w67 叶片中的叶绿素和类胡萝卜素含量显著低于野生型;突变体植株的发育稍迟缓于野生型,其株高、分蘖数、穗长、每穗粒数显著低于野生型,而千粒重无变化[42]。 OsDVR 基因被定位在第3 号染色体短臂上的分子标记PR809 ~PR826 之间,该基因突变体824ys 叶片中的叶绿素含量较野生型显著降低;突变体植株的发育严重迟缓于野生型,其株高、有效分蘖数、每穗粒数、结实率、千粒重均明显下降[20]。OsFdC2 基因被定位在第3 号染色体长臂上的分子标记C4~C5 之间,该基因的突变体501ys 叶片中的叶绿素和类胡萝卜素含量略低于野生型;突变体植株的发育受影响小,其株高、有效分蘖数、每穗粒数、结实率和千粒重仅稍低于野生型,下降幅度并不显著[43]。 综上,这些基因均没有位于ygl15 的精细定位区间内,与ygl15 均不是等位基因,且突变体的表型也与ygl15 的表型有区别。 因此,水稻ygl15 基因极有可能是一个新的黄绿叶控制基因。
4 结论
本研究结果表明,与野生型水稻相比,黄绿叶表型突变体ygl15 叶片中的叶绿素和类胡萝卜素含量均下降,其株高、有效穗数、单株总粒数和单株实粒数等农艺性状指数下降,千粒重略有增加,叶片中叶绿素合成和光合系统相关酶基因表达上调,但血红素合成基因下调。 遗传分析表明,突变体ygl15 受单个细胞核隐性基因控制。 水稻ygl15 基因被定位在第3 号染色体的多态性分子标记M08124 ~M08175 之间,物理区间距离约79 kb,推测水稻ygl15 基因极有可能是一个新的黄绿叶控制基因。 本研究结果为进一步克隆ygl15突变基因和研究基因功能奠定了一定的理论基础。

