miR-429在食管鳞癌中的表达及对细胞增殖迁移的影响
花光斌,朱国玺,苏煜强
miR-429在食管鳞癌中的表达及对细胞增殖迁移的影响
花光斌,朱国玺,苏煜强
454000 焦作,河南省焦作市焦煤集团中央医院心胸外科
探讨微小 RNA-429(miR-429)在食管鳞癌(ESCC)中的表达及其对细胞增殖及迁移的影响。
选取本院 45 例 ESCC 患者手术切除的癌组织(ESCC组)及癌旁组织(正常组)标本为研究对象,并采用实时荧光定量(qRT-PCR)检测两组 miR-429 表达水平。体外培养 ESCC 癌细胞株系 ECa109 及人正常食管上皮细胞株 Het-1A,将转染试剂、miR-429 阴性对照质粒、miR-429 mimic 质粒分别转染 ECa109 细胞,命名为空白组、阴性转染组、miR-429 过表达组,同时应用生物信息学工具预测 miR-429 的靶基因为 CTl0 激酶调节子样蛋白(CRKL),荧光素酶活性检测 miR-429 与 CRKL 的靶向调控关系。采用 qRT-PCR 法检测细胞中 miR-429 与 CRKL mRNA 表达水平,蛋白免疫印迹法检测细胞中CRKL 蛋白表达。MTT 法检测细胞增殖情况,Transwell 检测细胞迁移能力。
与正常组相比,ESCC 组 miR-429 表达水平显著降低(< 0.05);荧光素酶活性测定显示 3'UTR-Wt 细胞中miR-429 过表达组荧光素酶活性显著低于阴性对照组(< 0.05),3'UTR-Mut 细胞中miR-429 阴性转染组与过表达组比较差异无统计学意义(>0.05);与 Het-1A 细胞相比,ECa109 细胞中miR-429 表达水平显著降低(< 0.05),而 CRKL mRNA 及蛋白表达水平显著升高(< 0.05);与空白组、阴性转染组相比,miR-429 过表达组 miR-429 表达水平显著升高(< 0.05),而 CRKL mRNA 及蛋白表达水平显著降低(< 0.05);与空白组、阴性转染组相比,miR-429 过表达组细胞增殖率及迁移数量均显著降低(< 0.05)。
ESCC 中 miR-429 呈低表达,其可通过下调 CRKL 表达进而抑制 ESCC 细胞增殖及迁移。
食管肿瘤; 细胞增殖; 细胞运动; 微小 RNA-429
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌的主要组织学类型,我国 ESCC 发病率及死亡率逐年增加,研究显示癌细胞增殖及迁移可加快病情恶化,严重危及患者生命安全[1]。目前关于 ESCC 发病机制尚未完全阐明,因而进一步明确 ESCC 发病机制将有助于临床早期诊断及提高治疗效果。微小 RNA(micro RNA,miRNA)作为内源性非编码 RNA 分子可通过调节基因表达进而参与肿瘤等多种病理过程[2]。研究表明miRNA 可通过负向调控下游靶基因表达进而在多种恶性肿瘤中发挥抑癌或致癌作用[3]。微小 RNA-429(micro RNA-429,miR-429)可在胃癌等多种癌症中呈低表达并发挥抑癌基因作用[4]。相关研究表明 miR-429 可通过负向调控靶基因表达进而抑制乳腺癌细胞侵袭及转移[5]。关于 miR-429 与 ESCC 的相关研究相对较少,因此本研究主要探讨 miR-429 在ESCC 中的表达,应用 MiRbase、Targetscans 等数据库预测 miR-429 的靶基因为CT10 激酶调节子样蛋白(chicken tumor virus 10 regulator of kinase like protein,CRKL),从细胞水平上分析其对 ESCC 细胞的增殖及迁移的影响,旨在为进一步揭示 ESCC 发病机制提供理论依据。
1 资料与方法
1.1 材料
1.1.1 一般资料 选取 2017 年 2 月– 2018 年 3 月本院收治的 45 例 ESCC 患者为研究对象,所有患者均经手术病理证实,其中男 23 例,女22 例,年龄为 57 ~ 72 岁,平均年龄 65.24 ± 8.87 岁。将手术切除 ESCC 癌组织标本 45 例作为 ESCC 组,另选取相应癌旁组织标本45 例为正常组,并将切除的组织标本分别放置–80 ℃冰箱保存待测。纳入标准:①未患有其他食管病变者;②所有患者术前均未接受化疗或放疗;③所有患者知情且签署同意书。排除标准:①合并其他恶性肿瘤者;②自身免疫性疾病者;③精神疾病患者;④心、肝、肾等严重损伤者;⑤临床资料不完整者。
1.1.2 主要试剂与仪器 Lipofectamine 2000 转染试剂购于美国 Invitrogen 公司;MTT 购于北京索莱宝科技限公司;CRKL 抗体购自深圳市豪地华拓生物科技有限公司;RNA 与 qRT-PCR 检测试剂盒选购于天根生化科技有限公司;蛋白提取试剂盒购于美国 Thermo Fisher Scientific 公司;双荧光素酶报告基因鉴定试剂盒购自于美国 Omega 公司;ABI PCR 仪与蛋白凝胶成像仪均购自美国 Bio-Red 公司。
1.2 方法
1.2.1 细胞培养 人正常食管上皮细胞株 Het-1A 购于上海细胞生物学研究所,ESCC 细胞系 ECa109 购于中国科学院细胞库,并将其冻存于液氮中。使用时冰上复苏,置于 37 ℃水浴中溶化后 1000 r/min 离心 5 min 弃去上清液,将其置于 10%胎牛血清的 DMEM 培养基中,置于 37 ℃、5% CO2的潮湿培养箱中培养,待细胞生长至 80% 时,弃去培养基,加入 PBS 溶液清洗细胞,随后加入 0.2% 胰酶消化 5 min,加入 10% 胎牛血清DMEM 培养基进行传代培养,当细胞培养至第3 代时可用于后续研究。
1.2.2 细胞转染与分组 取对数期细胞,转染前 1 h 将培养液替换为不含胎牛血清的培养液,参照Lipofectamine 2000 转染试剂盒进行转染,将转染试剂、miR-429 阴性对照质粒、miR-429 mimic 质粒分别转染至 ECa109 细胞,命名空白组、阴性转染组、miR-429 过表达组,转染后置于 37 ℃、5% CO2中培养 48 h,随后收集细胞上清,进行后续测定。
1.2.3 实时荧光定量 PCR 检测 miR-429 及 CRKL mRNA 表达水平 采用 RNA 提取试剂盒提取细胞总 RNA,逆转录为 cDNA,采用实时荧光定量 PCR(qRT-PCR)试剂盒进行反应,反应程序设定:94 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,共 40 个循环;72 ℃终延伸 10 min。miR-429 以 U6 作为内参基因,CRKL 以 β-actin 为内参基因。采用 2-ΔΔCt法计算miR-429 及 CRKL mRNA 的相对表达量。
1.2.4 蛋白免疫印迹法检测 CRKL 蛋白表达 RIPA 裂解液裂解细胞,提取细胞总蛋白质并测定蛋白质浓度,采用 SDS-PAGE(12%)电泳分离蛋白,将其移至 PDVF 膜封闭后添加 CRKL 一抗(1:500),4 ℃孵育,次日加入二抗(1:5000)并在室温下孵育 1 h,以 β-actin 为内参基因,并采用 Quantity One 软件评估蛋白相对表达水平。
1.2.5 MTT 法检测细胞增殖情况 转染后培养 48 h 收集细胞并将其接种于细胞培养板,密度调整为 1 × 104个/ml,每组设置 6 个重复,分别培养 12、24、48 和 72 h,并向孔内添加 20 μl MTT 溶液继续培养 4 h,结束后加入 150 μl 二甲基亚砜(DMSO)溶液,室温下培养 15 min 后于 570 nm 处测定孔内吸光值。细胞增殖率=(空白组–实验组)/空白组× 100%。
1.2.6 Transwell 检测细胞迁移能力 转染后细胞饥饿培养 24 h,制备单细胞悬浮液并将细胞密度调整为 1 × 105个/ml,分别在 Transwell 小室上室与下室中加入 300 μl 单细胞悬浮液、500 μl 胎牛血清培养基,培养 24 h 后保留下层细胞,采用棉签清理未迁移细胞后加入结晶紫染液进行染色,15 min 后将其置于显微镜下进行计数。
1.2.7 荧光素酶报告基因测定 构建荧光素酶报告载体,将突变后的miR-429/CRKL(wt miR-429/CRKL)载体、未突变的miR-429(mut miR-429/CRKL)载体与miR-429 阴性对照质粒、miR-429 mimic 质粒共转染入细胞,37 ℃、5% CO2中培养 48 h,采用荧光素酶检测试剂盒检测其活性的变化。
1.3 统计学处理

2 结果
2.1 ESCC 癌组织及癌旁组织中 miR-429 表达水平比较
ESCC 组患者 miR-429 表达水平(0.67 ± 0.11)显著低于正常组(1.03 ± 0.17)(11.927,0.000)。
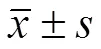
表 1 ECa109、Het-1A 细胞系中 miR-429 与 CRKL mRNA及蛋白表达水平比较()
2.2 ECa109、Het-1A 细胞系中 miR-429 与 CRKL mRNA 及蛋白表达水平比较
ECa109 细胞中 miR-429 表达水平显著低于 Het-1A 细胞(< 0.01),而 CRKL mRNA 表达水平显著高于 Het-1A 细胞(< 0.01),且CRKL 蛋白表达显著高于Het-1A 细胞(< 0.05),详见表1、图 1。
2.3 转染后 miR-429 与 CRKL mRNA 及蛋白表达水平比较
miR-429 过表达组miR-429 表达水平显著高于空白组、阴性转染组(< 0.05),而CRKL mRNA 表达水平显著低于空白组、阴性转染组(< 0.05);与空白组、阴性转染组相比,miR-429 过表达组 CRKL 蛋白表达显著降低(< 0.05),详见表2、图 2。

图 1 ECa109、Het-1A 细胞系中 CRKL 蛋白表达
Figure 1 CRKL protein expression in ECa109 and Het-1A cell lines
2.4 细胞增殖情况
随着细胞培养时间延长,miR-429 过表达组细胞增殖率逐渐降低,同一时间内 miR-429 过表达组细胞增殖率均显著低于空白组、阴性转染组(< 0.05),详见表3。
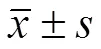
表 2 转染后 miR-429 与 CRKL mRNA 及蛋白表达水平比较()
注:与空白组、阴性转染组比较,*< 0.05。
Note:*< 0.05 compared with the blank group and the negative transfection group.

图 2 转染后 CRKL 蛋白表达
Figure 2 CRKL protein expression after transfection
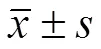
表 3 各组细胞增殖率情况比较()
注:与空白组、阴性转染组比较,*< 0.05。
Note:*< 0.05 compared with the blank group and the negative transfection group.

图 3 细胞迁移情况(× 100)
Figure 3 Cell migration (× 100)
2.5 细胞迁移情况
miR-429 过表达组细胞迁移数量显著低于空白组、阴性转染组(< 0.05),详见图 3、表4。
2.6 CRKL 是 miR-429 的直接靶标
利用 TargetScan 鉴定miR-429 靶基因及在CRKL 3'UTR 中的结合位点(图 4)。在CRKL 3'UTR-Wt的细胞中,与miR-429 阴性对照组(2.12 ± 0.35)相比,miR-429 过表达组荧光素酶活性(1.17 ± 0.15)显著降低(< 0.05)。在CRKL 3'UTR-Mut的细胞中,miR-429 阴性对照组(1.07 ± 0.11)与miR-429 过表达组(1.10 ± 0.18)的荧光素酶活性比较差异无统计学意义(>0.05)。
3 讨论
食管癌中 ESCC 是最常见的细胞学类型,患者预后较差。由于起因隐匿,导致早期诊断困难,研究显示早期 ESCC 具有一定的侵袭及转移能力[6]。目前临床主要采用手术并辅助放化疗方法,但患者生存率仍较低[7]。故而寻找与 ESCC 细胞增殖及迁移相关的分子生物学标志物对提高治疗效果及改善患者预后均具有重要意义。随着生物技术的进步,研究表明 miRNA 的异常表达与多种肿瘤发生及进展过程紧密相关[8]。近年来相关研究表明部分 miRNA 与 ESCC 发生及发展有关,并可通过调控靶基因表达进而参与肿瘤细胞迁移及侵袭过程[9]。
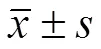
表 4 细胞迁移数量比较(,个)
注:与空白组、阴性转染组比较,*< 0.01。
Note:*< 0.01 compared with the blank group and the negative transfection group.
miR-429 属于 miR-200 家族,位于人 1 号染色体 p36.33,研究表明 miR-429 在多种恶性肿瘤中异常表达并可参与细胞增殖、凋亡等生物学过程[10]。Zhu 等[11]研究表明,miR-429 在胃癌组织中呈低表达,并可通过上调靶基因 Bcl-2 表达进而促进胃癌细胞增殖及侵袭。Sun 等[12]研究发现,miR-429 表达水平下调可显著促进结直肠癌细胞的增殖、侵袭及迁移,同时可通过调节靶基因 Onecut2 表达进而调控上皮间质化过程。相关研究表明 miR-429 低表达可促使下游信号分子 Ascl2 表达水平上调进而共同参与癌细胞增殖及迁移等过程[13]。关于 miR-429 与 ESCC 的相关研究相对较少,本研究结果显示 ESCC 组 miR-429 表达水平显著低于正常组,同时 ESCC 细胞系 ECa109中 miR-429表达水平显著低于 Het-1A 细胞,说明miR-429 在 ESCC 中呈低表达,提示 miR-429 在ESCC 发生过程中发挥抑癌基因作用。

图 4 miR-429 与 CRKL 3'UTR 基因配对区域
Figure 4 miR-429 and CRKL 3'UTR gene pairing region
同时本研究通过荧光素酶活性检测 miR-429 及其靶基因 CRKL,结果显示 CRKL 是miR-429 的直接靶标基因。CRKL 是 CRK 调节蛋白家族的一员,其主要由 CRKL 基因编码并包含 SH2 与SH3 结构域,同时可通过结构域与信号通路中的相关蛋白相互作用进而参与细胞增殖及迁移等多种生物学过程[14]。相关研究表明 CRKL 还可作为多功能接头蛋白并在上游及下游信号传递过程中发挥重要作用[15]。研究发现 CRKL 在肺腺癌中呈高表达并可通过上调 Cyclin D1 及 Cyclin B1 等蛋白表达水平进而参与肿瘤细胞增殖过程[16]。CRKL 在 ESCC 癌细胞中的表达尚未见报道,本研究结果显示 ECa109 中CRKL mRNA 及蛋白表达水平显著高于 Het-1A 细胞,说明 CRKL 在 ESCC 中呈高表达。提示 ESCC 中 miR-429 表达水平降低并促使靶基因 CRKL 表达水平上调进而参与 ESCC 发生过程,可进一步探究其对癌细胞增殖及迁移的影响。
miR-429 作为调节分子可参与细胞增殖、凋亡及肿瘤发生过程[17]。相关研究表明miR-429 在肝细胞癌中呈低表达,miR-429 过表达后可通过下调靶基因 Notch1 表达进而抑制癌细胞增殖[18]。孙少鹏等[19]研究表明,miR-429 过表达可抑制转录抑制因子锌指 E-盒结合同源异形盒 1、基质金属蛋白酶 2 表达并提高上皮细胞钙黏蛋白表达水平进而抑制膀胱癌细胞迁移及侵袭。余稳稳等[20]研究表明 miR-429 过表达可通过下调靶基因表达进而抑制多种恶性肿瘤细胞的增殖、迁移及侵袭,并对多种肿瘤的诊断、治疗及患者预后评估均具有重要应用价值。本研究通过细胞转染等技术特异性上调 ESCC miR-429 表达,结果显示miR-429 过表达组 miR-429 表达水平显著高于空白组、阴性转染组,而 CRKL mRNA 及蛋白表达水平显著降低,说明转染 miR-429 mimic 可特异性上调细胞中 miR-429 表达进而降低靶基因 CRKL 表达。同时本研究进一步分析其与细胞增殖及迁移的关系,结果显示miR-429 过表达组细胞增殖率显著低于空白组、阴性转染组,且细胞迁移数量显著降低,说明上调 miR-429 表达可抑制 ESCC 细胞增殖、迁移及侵袭。提示 ESCC 中 miR-429 可通过负向调控CRKL 表达进而参与细胞增殖及迁移过程。
综上所述,miR-429 在 ESCC 中发挥抑癌基因的作用,并可抑制 ESCC 的增殖及迁移,其机制可能为miR-429 通过调节CRKL 表达进而参与 ESCC 细胞增殖及迁移过程,可为ESCC 靶向治疗提供一定参考。但本研究仅以 ECa109 细胞、Het-1A 细胞作为研究对象,初步探究miR-429 的作用机制,所涉及相关信号通路还有待深入研究。
[1] Zhang J, Zhu J, Yang L, et al. Interaction with CCNH/CDK7 facilitates CtBP2 promoting esophageal squamous cell carcinoma (ESCC) metastasis via upregulating epithelial-mesenchymal transition (EMT) progression. Tumour Biol, 2015, 36(9):6701-6714.
[2] Odenthal M, Hee J, Gockel I, et al. Serum microRNA profiles as prognostic/predictive markers in the multimodality therapy of locally advanced adenocarcinomas of the gastroesophageal junction. Int J Cancer, 2015, 137(1):230-237.
[3] Gu DN, Huang Q, Tian L. The molecular mechanisms and therapeutic potential of microRNA-7 in cancer. Expert Opin Ther Targets, 2015, 19(3):415-426.
[4] He F, Yan LQ, Li XL. The research progress of miR-429 in diseases. Jiangsu Med J, 2017, 43(17):1266-1269. (in Chinese)
何枫, 颜连启, 李小磊. miR-429在疾病中的研究进展. 江苏医药, 2017, 43(17):1266-1269.
[5] Ye ZB, Ma G, Zhao YH, et al. miR-429 inhibits migration and invasion of breast cancer cells in vitro. Int J Oncol, 2015, 46(2):531- 538.
[6] Fujita H. History of lymphadenectomy for esophageal cancer and the future prospects for esophageal cancer surgery. Surg Today, 2015, 45(2):140-149.
[7] Shapiro J, Biermann K, van Klaveren D, et al. Prognostic value of pretreatment pathological tumor extent in patients treated with neoadjuvant chemoradiotherapy plus surgery for esophageal or junctional cancer. Ann Surg, 2017, 265(2):356-362.
[8] D'Angelo B, Benedetti E, Cimini A, et al. MicroRNAs: a puzzling tool in cancer diagnostics and therapy. Anticancer Res, 2016, 36(11):5571- 5575.
[9] Nariman-Saleh-Fam Z, Bastami M, Somi MH, et al. In silico dissection of miRNA targetome polymorphisms and their role in regulating miRNA-mediated gene expression in esophageal cancer. Cell Biochem Biophys, 2016, 74(4):483-497.
[10] Li JM, Wu AB, Yang ZX. Progress of miR-373 in tumor invasion and metastasis. J Chin Pract Diagn Ther, 2015, 29(10):946-948. (in Chinese)
李金媚, 吴爱兵, 杨志雄. miR-373与肿瘤侵袭转移研究进展. 中华实用诊断与治疗杂志, 2015, 29(10):946-948.
[11] Zhu P, Zhang J, Zhu J, et al. MiR-429 induces gastric carcinoma cell apoptosis through Bcl-2. Cell Physiol Biochem, 2015, 37(4):1572- 1580.
[12] Sun Y, Shen S, Liu X, et al. MiR-429 inhibits cells growth and invasion and regulates EMT-related marker genes by targeting Onecut2 in colorectal carcinoma. Mol Cell Biochem, 2014, 390(1-2):19-30.
[13] Tian Y, Pan Q, Shang Y, et al. MicroRNA-200 (miR-200) cluster regulation by achaete scute-like 2 (Ascl2): impact on the epithelial-mesenchymal transition in colon cancer cells. J Biol Chem, 2014, 289(52):36101-36115.
[14] Shi J, Meng L, Sun MZ, et al. CRKL knockdown promotes in vitro proliferation, migration and invasion, in vivo tumor malignancy and lymph node metastasis of murine hepatocarcinoma Hca-P cells. Biomed Pharmacother, 2015, 71(1):84-90.
[15] Shi X, Xiao X, Yuan N, et al. MicroRNA-379 suppresses cervical cancer cell proliferation and invasion by directly targeting v-crk avian sarcoma virus CT10 Oncogene Homolog-Like (CRKL). Oncol Res, 2018, 26(7):987-996.
[16] An R, Wang Y, Voeller D, et al. CRKL mediates EML4-ALK signaling and is a potential therapeutic target for ALK-rearranged lung adenocarcinoma. Oncotarget, 2016, 7(20):29199-29210.
[17] Fan JY, Fan YJ Wang XL, et al. miR-429 is involved in regulation of NF-κB activity by targeting IKKβ and suppresses oncogenic activity in cervical cancer cells. FEBS Lett, 2017, 591(1):118-128.
[18] Gao H, Liu C. miR-429 represses cell proliferation and induces apoptosis in HBV-related HCC. Biomed Pharmacother, 2014, 68(8): 943-949.
[19] Sun SP, Kong GQ, Xian SZ, et al. Effect and mechanism of overexpression of mir-429 on migration and invasion ability of bladder cancer cells. Shandong Med J, 2017, 57(45):42-44. (in Chinese)
孙少鹏, 孔广起, 贤少忠, 等. miR-429过表达对膀胱癌细胞迁移、侵袭能力的影响及机制. 山东医药, 2017, 57(45):42-44.
[20] Yu WW, Tao RY, Feng XL, et al. Progress of the correlation between miR-429 and tumor. J Chin Pract Diagn Ther, 2016, 30(10):950-952. (in Chinese)
余稳稳, 陶瑞雨, 冯学亮, 等. miR-429与肿瘤相关性研究进展. 中华实用诊断与治疗杂志, 2016, 30(10):950-952.
Expression and function of miR-429 in esophageal squamous cell carcinoma and its effects on cell proliferation and migration
HUA Guang-bin, ZHU Guo-xi, SU Yu-qiang
Department of Cardiothoracic Surgery, Central Hospital of Jiaozuo Coal Industry Group, Henan 454000, China
To investigate the expression of micro RNA-429 (miR-429) in esophageal squamous cell carcinoma (ESCC) and its effects on cell proliferation and migration.
The specimens of cancer tissues (ESCC group) and adjacent tissues (normal group) removed from 45 ESCC patients after surgery in our hospital were selected, and the expression level of miR-429 in the two groups was detected by real-time fluorescence quantitative PCR (qRT-PCR). ESCC cell line ECa109 and human normal esophageal epithelial cell line Het-1A were cultured. Transfection reagent alone, miR-429 negative control plasmid and miR-429 mimic plasmid were transfected into ECa109 cells, and named as blank, negative transfection and miR-429 overexpression group, respectively. CTl0 kinase regulating the like protein (CRKL) was predicted as the target gene of miR-429 by bioinformatics tool, and luciferase activity was used to detect the regulatory relationship between miR-429 and CRKL. The expression levels of miR-429 and CRKL mRNA in cells were detected by qRT-PCR, and CRKL protein was detected by Western blot. MTT assay was used to detect cell proliferation, and transwell assay was used to detect cell migration ability.
Compared with the normal group, the expression level of miR-429 in ESCC group was significantly decreased (< 0.05). In cells with 3'UTR wide type, the activity of luciferase in the overexpression group of miR-429 was significantly lower than that in the negative control group (< 0.05), while in cells carrying mutant 3'UTR, no significant difference was observed between the negative transfection group and miR-429 overexpression group (> 0.05). Compared with Het-1A cells, the expression level of miR-429 in ECa109 cells was significantly decreased (< 0.05), while the expression of CRKL mRNA and protein levels significantly increased (< 0.05). Compared with the blank and negative transfection group, the expression level of miR-429 was significantly higher (< 0.05), and the expression level of CRKL mRNA and protein was significantly lower (< 0.05) in the overexpression group. Cell proliferation rate and migration ability in the miR-429 overexpression group were significantly decreased (< 0.05) as compared with the blank group and negative transfection group.
Decreased expression of miR-429 was observed in ESCC compared with normal tissue, and miR-429 can inhibit the proliferation and migration of ESCC cells by down-regulating the expression of CRKL.
Esophageal neoplasms; Cell proliferation; Cell movement; Micro RNA-429
HUA Guang-bin, Email:hnzzz1974@163.com
花光斌,Email:hnzzz1974@163.com
2018-10-10
10.3969/j.issn.1673-713X.2019.01.010

