产果聚糖蔗糖酶重组枯草芽孢杆菌的构建及表达
孙惟沁,沐万孟,张 涛,江 波
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
低聚乳果糖(lactosucrose,LS)是由半乳糖、葡萄糖和果糖构成的一种三糖。低聚乳果糖的吸湿性高、持水力强、在酸性条件下稳定、甜度为蔗糖的30%[1],与其他低聚糖甜味剂相比,低聚乳果糖的甜味质量与蔗糖最为相近[2]。低聚乳果糖不能被人和小鼠肠道酶系水解[3],但能够被双歧杆菌选择性利用[2,4-5],从而改善肠道微环境,摄入低聚乳果糖还能够促进钙吸收[6],抑制体脂积聚,预防肥胖[7],调节免疫[8-9]。因此,低聚乳果糖被认为是一种具有益生元效果的功能性低聚糖。在日本,低聚乳果糖被批准作为特定保健食品(FOSHU)的功能性配料。
以蔗糖和乳糖为底物,酶法生产低聚乳果糖有两种方法,一是通过环状芽孢杆菌[10]来源的β-半乳糖苷酶将乳糖分解产生的β-半乳糖苷转移到蔗糖中葡萄糖C4 位羟基上;二是通过多种来源(Aerobacter levanicum[11]、Bacillus natto[12]、Bacillus subtilis KCCM 32835[13]、Paenibacillus polymyxa IFO 3020[14]、Sterigmatomyces elviae ATCC 18894[15]等)的果聚糖蔗糖酶或节杆菌Arthrobacter sp.K-1[16]来源的β-呋喃果糖苷酶将蔗糖分解产生的果糖基转移到乳糖还原性末端C1 位羟基上。目前,针对这些具有合成低聚乳果糖能力的酶的研究主要在高效野生菌株的筛选、化学试剂修饰[17]、固定化[15,18]、基因工程菌株的构建[19-22]几方面。
枯草芽孢杆菌有着长期制备发酵食品的历史,被美国FDA 和中国农业部等部门批准为食品级安全菌株[23],它具有培养简单快速、蛋白分泌能力强、产物不易形成包涵体、非致病性、遗传背景清楚、密码子偏好性不明显[24]的特点,是目前生产各种工业用酶,如淀粉酶、蛋白酶和脂肪酶的理想表达宿主[25]。目前对基因工程菌的研究报道均是以大肠杆菌作为表达系统,尚未有枯草芽孢杆菌表达。本研究拟将肠膜明串珠菌Leuconostoc mesenteroides B-512 FMC[25]编码的果聚糖蔗糖酶基因分别克隆到单启动子、双启动子表达载体上,并将质粒导入枯草芽孢杆菌WB600 和1A751 中,构建无抗菌株。对重组菌的发酵条件进行优化,以实现果聚糖蔗糖酶的高效表达,为该酶的应用提供基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 实验所用菌株和质粒详见表1。
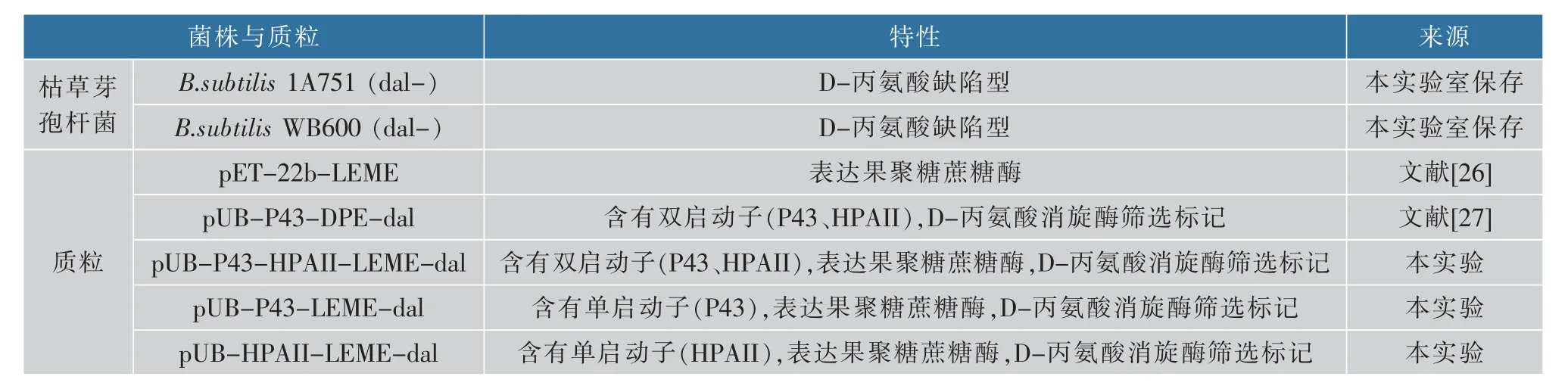
表1 菌株与质粒Table 1 Strain and plasmid
1.1.2 试剂和培养基 DNA 聚合酶PrimeSTAR Max DNA Polymerase 和DL10 000 DNA Marker 购自大连宝生物工程有限公司;SanPrep 柱式质粒DNA 小量抽提试剂盒和SanPrep 柱式DNA 胶回收试剂盒购自生工生物工程(上海)股份有限公司;引物由生工生物工程(上海)股份有限公司合成;葡萄糖、蔗糖、麦芽糖、乳糖等其他常用试剂均购自国药集团化学试剂有限公司。
LB 培养基(g/L):NaCl 10,胰蛋白胨10,酵母提取物5。
基础发酵培养基(g/L):酵母提取物20,胰蛋白胨25,K2HPO43,葡萄糖30。
1.2 实验方法
1.2.1 果聚糖蔗糖酶目的基因的克隆与重组质粒的构建
1)双启动子重组质粒构建。以pET-22b-LEME质粒为模版,用引物P1 和P2 扩增果聚糖蔗糖酶基因LEME 片段,以pUB-P43-DPE-dal 质粒为模版,用引物P3 和P4 扩增双启动子载体骨架pUB-P43-HPAII-dal片段,胶回收纯化PCR产物,用NanoDrop 测定DNA 浓度,按照摩尔比1∶1 互为模版PCR,得到多聚体片段Poly-PH,将其转化到枯草芽孢杆菌WB600 感受态细胞中,构建重组菌株WB-PH。参照SanPrep 柱式质粒DNA 小量抽提试剂盒方法提取重组菌株质粒pUB-P43-HPAII-LEMEdal。
2)单启动子重组质粒构建。单启动子(P43 和HPAII)以pUB-P43-HPAII-LEME-dal 质粒为模版,分别用引物P5、P6 和P7、P8 扩增果聚糖蔗糖酶基因LEME+P43 片段和LEME 片段,分别用引物P9、P10 和P11、P12 扩增单启动子载体骨架pUBdal 片段和pUB-HPAII-dal 片段,同上述双启动子方法一样构建多聚体片段Poly-P、Poly-H。
PCR 反应条件:98 ℃预变性2 min;98 ℃解链10 s,60 ℃退火15 s,72 ℃延伸2 min,共30 个循环;72 ℃延伸5 min。
预期得到3 种不同启动子组合的质粒见图1。引物列表见表2。
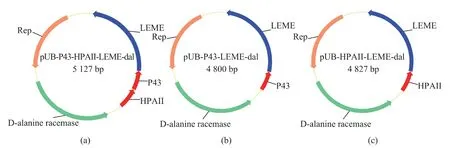
图1 不同启动子组合质粒Fig.1 Plasmids with different promoters

表2 引物列表Table 2 List of primers
1.2.2 重组枯草芽孢杆菌的构建 枯草芽孢杆菌感受态按照文献[28]制备。将Poly-PH、Poly-P、Poly-H 分别转入枯草芽孢杆菌WB600(dal-)和1A751(dal-)感受态细胞中,37 ℃、100 r/min 培养1 h,离心并用无菌水洗涤3 次,再用400 μL 无菌水重悬。取200 μL 菌液涂布在无抗LB 固体平板上,37 ℃12 h 培养,次日检查并筛选成功转化的阳性转化子,表达在枯草芽孢杆菌WB600(dal-)中的命名分别为WB-PH、WB-P、WB-H,表达在枯草芽孢杆菌1A751(dal-)中的命名分别为1A-PH、1A-P、1A-H。
1.2.3 培养与表达 将构建成功的重组菌在LB 平板上划线活化,挑取单菌落接种于4 mL LB 培养基中,37 ℃、200 r/min 培养12 h 作为种子液。按照2%接种量接种于25 mL 发酵培养基中,37 ℃200 r/min培养15 h,收集发酵液。
1.2.4 聚丙烯酰胺凝胶电泳分析(SDS-PAGE)取1 mL 发酵液离心取菌体,加入1 mL 水重悬并煮沸10 min,冷却后加入50 μL 浓度为20 mg/mL 的溶菌酶溶液,置于37 ℃水浴中1 h 进行裂解。离心后取40 μL 上清液,向其中加入10 μL 5×SDS-PAGE Loading Buffer,沸水浴5 min。使用5%的浓缩胶,12%的分离胶进行蛋白电泳,考马斯亮蓝R250 染色。
1.2.5 果聚糖蔗糖酶发酵酶活检测 果聚糖蔗糖酶发酵酶活检测:1 mL 反应体系包括:15%蔗糖、15%乳糖、PBS 50 mmol/L pH 6.5、80 μL 发酵液。反应条件:4 0℃,10 min。反应完成后沸水浴10 min灭酶。
将灭酶的反应液离心后取上清200 μL 加入800 μL 超纯水中稀释,用0.22 μm 滤膜过滤后上液相色谱检测。
测定条件:高效液相色谱Agilent 1260 Infinity,色谱柱Waters Spherisorb Amino(NH2)Column,示差折光检测器,流动相 乙腈∶甲醇∶水=77∶13∶10(V∶V∶V),流速1 mL/min,柱温35 ℃。
一个酶活单位(U)定义为pH 6.5,40 ℃条件下,每分钟生成1 μmol 低聚乳果糖产物所需要的酶量。
1.2.6 菌体量测定 湿菌体重:取2 mL 发酵液于预先称重的2 mL 离心管中,8 000 r/min 离心5 min,弃去上清后再次称重,得到湿菌体质量浓度,计算每毫升湿菌体重。
1.2.7 发酵条件优化 氮源优化:保持总氮含量不变,分别使用大豆蛋白胨、胰蛋白胨、鱼粉蛋白胨、酵母提取物、尿素、NH4Cl、(NH4)2SO4、柠檬酸氢二铵、NH4H2PO4、CH3COONH4作为唯一氮源进行发酵,测定菌体量和发酵酶活。确定最佳氮源后,改变氮源添加量,进行发酵培养,测定菌体量和发酵酶活。
碳源优化:保持总碳含量不变,分别使用葡萄糖、果糖、蔗糖、乳糖、麦芽糖、糊精、可溶性淀粉、甘油作为唯一碳源进行发酵,测定菌体量和发酵酶活。确定最佳碳源后,改变碳源添加量,进行发酵培养,测定菌体量和发酵酶活。
接种量:采用最佳碳源、氮源配制发酵培养基,按0.5%、1%、2%、3%、4%、5%、6%接种量接种,进行发酵培养,测定菌体量和发酵酶活。
装液量:在250 mL 三角瓶和500 mL 三角瓶中分别装25、50、75、100 mL 发酵培养基,进行发酵培养,测定菌体量发酵酶活。
2 结果与分析
2.1 目的基因的克隆与重组质粒的构建
通过PCR 方法,成功扩增得到6 条基因片段,分别为pUB-P43-HPAII-LEME-dal 质粒的目的基因片段(1 275 bp)、载体骨架片段(3 852 bp)、pUBP43-LEME-dal 质粒的目的基因片段(1 575 bp)、载体骨架片段(3 225 bp)、pUB-HPAII-LEME-dal质粒的目的基因片段(1 275 bp)、载体骨架片段(3 552 bp)。再以扩增片段互为引物进行PCR,成功得到了3 条多聚体片段Poly-PH、Poly-P、Poly-H,见图2。

图2 基因片段PCR 扩增产物Fig.2 PCR products of different genes
2.2 重组质粒在枯草芽孢杆菌中的表达
使用化学转化方法,将Poly-PH、Poly-P、Poly-H 导入枯草芽孢杆菌1A751 和WB600 中。将阳性转化子进行发酵培养,测定其发酵酶活,结果如图3所示,6 种重组菌均有酶活,其中双启动子质粒对于果聚糖蔗糖酶表达的效果均优于单启动子质粒,其中WB-PH 的发酵酶活最高(4.179 U/mL),是WB-P的17.3 倍,WB-H 的55.7 倍;1A-PH 的发酵酶活是1A-P 的7 倍,1A-H 的8.8 倍。文献[29]将启动子HPAII 多次串联,经串联后的启动子介导的纳豆激酶活性较单个启动子最多提高了92.51%。文献[30]将两个病原诱导物启动子串联并与编码β-葡萄糖苷酸酶的基因uidA 融合,双启动子的诱导表达活性比单启动子高了9 倍。结果表明,启动子串联能够提高蛋白的表达量。
两种枯草芽孢杆菌表达载体相比,WB-PH 的发酵酶活是1A-PH 的9.4 倍,其原因是与1A751 相比,WB600 敲除了6 个自身蛋白酶基因,因而外源蛋白能够更稳定的表达。综上,后续实验采用WB-PH作为研究对象。
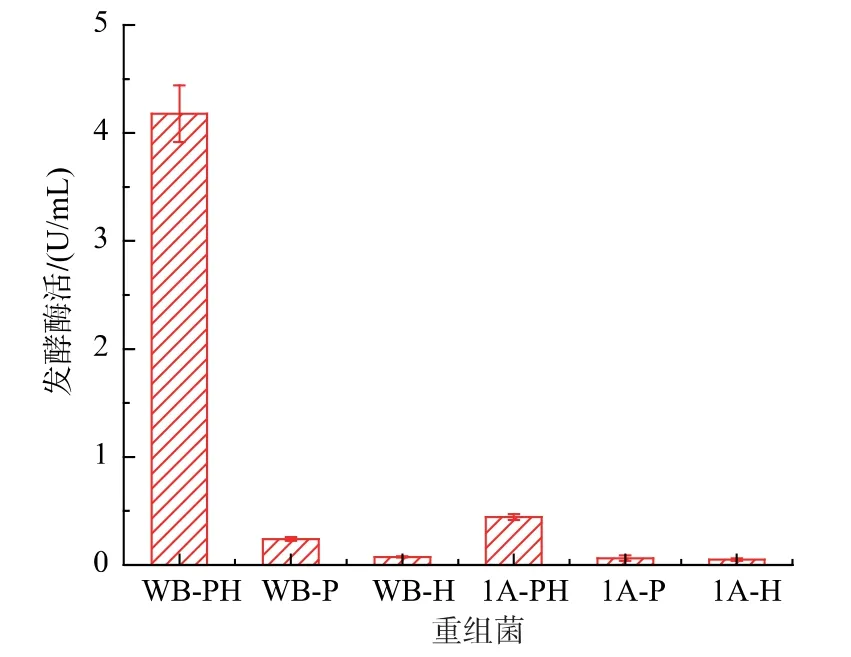
图3 重组菌的发酵酶活Fig.3 Enzyme activity of different recombinant strains
2.3 发酵条件优化结果分析
2.3.1 氮源种类及用量 不同氮源对发酵酶活和菌体质量浓度的影响见图4。如图4 所示,以大豆蛋白胨作为氮源能够获得最高发酵酶活(66.82 U/mL),其次是以酵母提取物作为氮源(13.38 U/mL)。有机氮源能明显提高菌体量,其中以酵母提取物作为氮源,菌体量最大,其次是大豆蛋白胨、胰蛋白胨、鱼粉蛋白胨。从结果中还可以发现,WB-PH 对无机氮源利用率很低,菌体量及发酵酶活均没有提高。

图4 不同氮源对发酵酶活和菌体量的影响Fig.4 Effects of nitrogen source on levansucrase production and biomass
以大豆蛋白胨作为氮源,考察不同添加量对发酵酶活的影响,结果如图5 所示,大豆蛋白胨质量分数为2%时,发酵酶活最高。大豆蛋白胨含量在1%~8%范围内时,菌体质量浓度与氮源质量分数呈正相关趋势,发酵酶活先升高后降低,可能是由于大豆蛋白胨添加量较高的几组中的菌体还处于生长阶段,尚未进入表达蛋白的时期。而大豆蛋白胨质量分数为10%时菌体量减少,主要是由于浓度增加导致培养基粘度变大,在摇床培养时溶氧减少,枯草芽孢杆菌为好氧菌,生长受到了抑制。

图5 大豆蛋白胨浓度对发酵酶活和菌体量的影响Fig.5 Effects of soy peptone concentration on levansucrase production and biomass
2.3.2 碳源种类及用量 保持总碳含量不变,分别使用葡萄糖、果糖、蔗糖、乳糖、麦芽糖、糊精、可溶性淀粉、甘油作为唯一碳源进行发酵,考察不同种类碳源的影响,结果如图6 所示,以果糖作为唯一碳源时,发酵酶活最高(64.58 U/mL),其次是葡萄糖(61.79 U/mL)和蔗糖(54.01 U/mL),3 者的菌体质量浓度基本相同。考虑到三种碳源中,果糖成本较高,葡萄糖成本最低,故采用葡萄糖作为最佳碳源。

图6 不同碳源对发酵酶活和菌体量的影响Fig.6 Effects of carbon source on levansucrase production and biomass
以葡萄糖作为碳源,考察不同添加量对发酵的影响,结果如图7 所示,不同的葡萄糖添加量对菌体量的影响变化不大,考察范围内所有组别湿菌体重都在20~30 mg/mL 范围之间,葡萄糖添加量为2%时,发酵酶活和菌体量均达最大值。

图7 葡萄糖添加量对发酵酶活和菌体量的影响Fig.7 Effects of glucose concentration on levansucrase production and biomass
2.3.3 接种量 接种量会影响菌体的生长和蛋白的表达。接种量过低,菌体生长的延滞期时间会增长,从而延长了发酵周期;接种量过高,会使得菌体生长利用的营养物质过多,对后期产酶不利。以最佳碳源、氮源配制发酵培养基,分别将种子液按0.5%、1%、2%、3%、4%、5%、6%的接种量,接种至发酵培养基进行发酵培养,考察不同接种量的影响,结果如图8 所示,接种量为1%时,发酵酶活达最大值。
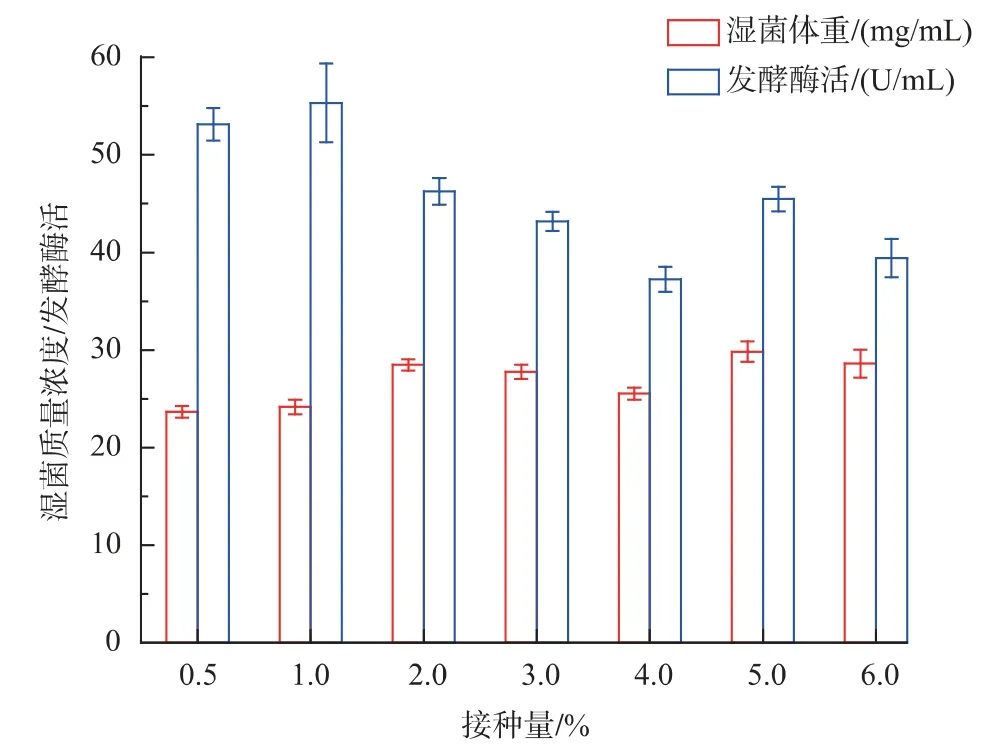
图8 接种量对发酵酶活和菌体量的影响Fig.8 Effects of inoculum size on levansucrase production and biomass
2.3.4 装液量 摇瓶装液量的变化反映了溶氧水平的高低,枯草芽孢杆菌是好氧菌,因此发酵过程中充足的氧气供给十分重要。在固定摇床转速200 r/min 下,考察了250 mL 三角瓶和500 mL 三角瓶不同装液量情况下对枯草芽孢杆菌生长的影响,结果如图9、图10 所示,发酵酶活和菌体量均随着装液量的增加而降低。相同装液量条件下,使用的三角瓶体积越大,发酵酶活越高。可以发现充足的供氧对菌体生长和产酶都有提高作用。
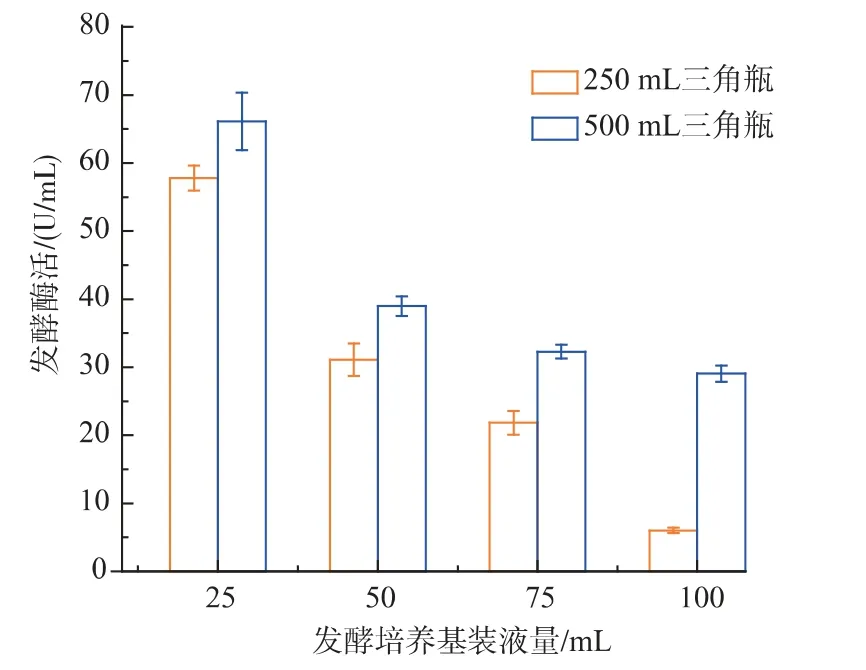
图9 装液量对发酵酶活的影响Fig.9 Effects of culture volume on levansucrase production
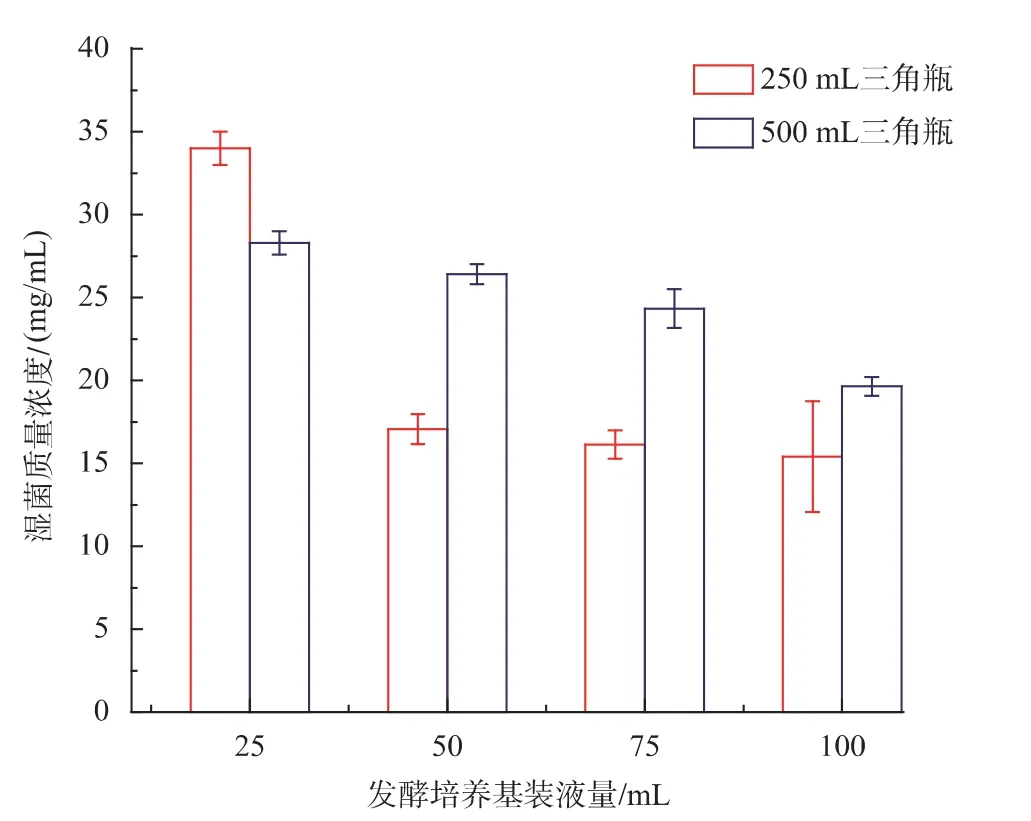
图10 装液量对菌体量的影响Fig.10 Effects of culture volume on biomass
2.3.5 发酵时间 采用以上所有优化过的条件,进行摇瓶连续发酵培养,每隔一段时间取样测定湿菌体重、发酵酶活,结果如图11 所示。从图中可以看出,在3 h 后菌体生长进入对数期,15 h 后达到平台期,21 h 湿菌质量浓度达到最大值29.6 mg/mL,之后逐渐降低。发酵酶活在发酵4 h 以后开始逐渐升高,在9~18h 期间升高速率最快,18 h 发酵酶活达最大值108.34 U/mL。18 h 以后酶活开始降低,分析原因主要是由于菌体开始凋亡,胞内的蛋白酶被释放出来,降解自身原有蛋白的同时也将果聚糖蔗糖酶蛋白分解了。

图11 发酵时间对发酵酶活和菌体量的影响Fig.11 Effects of fermentation time on levansucrase production and biomass
3 结语
将来源于肠膜明串珠菌 Leuconostoc mesenteroides B-512 FMC 的果聚糖蔗糖酶基因克隆并构建了3 种不同启动子组合的质粒,分别导入枯草芽孢杆菌WB600 和1A751 后,经过发酵比较酶活,确定了WB-PH 的发酵酶活最高。将WB-PH的发酵条件进行单因素实验优化,确定了发酵培养基配方为:20 g/L 葡萄糖,20 g/L 大豆蛋白胨;培养条件为:接种量1%,装液量5%(V∶V),发酵周期18 h,培养温度37℃,摇床转速200 r/min。在该培养条件下产果聚糖蔗糖酶的发酵酶活最高可达108.34 U/mL,约为优化前的25.92 倍,为下一步利用果聚糖蔗糖酶以蔗糖和乳糖为底物高效合成低聚乳果糖提供了基础。

