蛹虫草固态发酵产虫草素的优化
杨 帆,刘金彬,管政兵,廖祥儒,蔡宇杰
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
蛹虫草是一种众所周知的药食用真菌,属于虫草属真菌,通常寄生于鳞翅目昆虫的幼虫或蛹。蛹虫草被广泛用作草药和补品,研究发现其具有多种多样的生物活性,如抗肿瘤[1],抗病毒[2],辐射防护[3],抗炎症[4],抗氧化[5],降血压[6],增强免疫力[7],以及抗真菌活性[8]等。在蛹虫草中发现了一系列药理活性成分,包括虫草素、虫草酸、虫草多糖、类胡萝卜素、溶栓酶[6],以及超氧化物歧化酶[9]等。由于蛹虫草具有吸引力的有益效果,在自然界很稀有,被认为是一种非常昂贵的真菌,同时被添加到功能性食品和保健品中[9-10]。
虫草素在蛹虫草药理性质上起特别重要的作用,其所具有的重要的药理价值被揭示,包括抗肿瘤,免疫调节,抗炎症,抗氧化,降血脂,抗衰老,神经保护功能,肾脏保护作用[11],抗菌活性[12],抗病毒活性[13],促进学习和记忆[14],细胞凋亡[15],和减轻类风湿性关节炎[16]。研究还将虫草素作为治疗白血病的药物[17]。此外,虫草素和喷司他丁联合治疗二期非洲锥虫病的临床前评估已进行[18]。上述研究都预示着虫草素在未来有着良好的应用前景,实现虫草素高效合成才能满足大量的需求。
虫草素的合成主要有化学合成和生物发酵。由于化学合成得到的虫草素较难纯化,且成本较高于生物发酵,所以主要研究集中到生物发酵上。生物发酵主要包括寄主培养、液态发酵和固态发酵。寄主培养主要用来获得蛹虫草子实体,但虫体感染成功率低,生产周期长,且虫草素含量较低[19]。目前,液态发酵虫草素产量最高达到14.3 g/L[20],但是其发酵周期很长,生产效率较低。用固态发酵法生产虫草素的文献较少,且产量很低[21]。与其他发酵过程相比,固态发酵具有以下有点:体积较小,耗水量更低,减少污水处理成本,并能降低能耗。此外,固态发酵水活度低,不易染菌,产物浓度较高,下游处理较易进行。在自然条件下,蛹虫草在僵硬的昆虫上生长,分解昆虫的尸体。而固态发酵条件与蛹虫草生长的自然条件有相似之处,是蛹虫草生长的理想发酵方式。本实验室前期进行了一系列液态发酵的工作[22-24],且通过诱变获得一株性状稳定,具有高产潜力的菌株[24]。
综上所述,本研究采用固态发酵培养蛹虫草,对培养基组成和发酵条件进行优化,以期得到较高的虫草素产量,为虫草素的大规模生产打下一定的基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种 蛹虫草Cordyceps militaris JN168:保藏于中国典型培养物保藏中心,保藏号为CCTCCNO:M2011333。
1.1.2 主要材料及试剂 大米、小米、玉米、高粱、小麦、荞麦:市售食品级,作基质用;虫草素标准品:购自中国药品生物制品检定所;其他试剂均为国产分析纯。
1.1.3 培养基
1)斜面培养基(g/L):PDA 培养基。
2)种子培养基(g/L):葡萄糖30,酵母浸膏10,七水硫酸镁1.0,磷酸氢二钾1.0,磷酸二氢钾1.0。
3)固态发酵培养基:组培瓶体积350 mL,基质20 g,料液比1∶1.2。
实验中所用培养基均在115 ℃,20 min 条件下灭菌。
1.2 实验方法
1.2.1 菌种培养及发酵方法
1)斜面菌种培养:取保藏的Cordyceps militaris JN168 菌株,挑5 mm 见方的菌块接种到斜面培养基上,25 ℃避光培养至菌丝长满斜面,每天光照12 h 转色,选菌体颜色为橘黄色或橘红色的斜面备用。
2)种子培养:用10 mL 无菌水冲洗斜面上的孢子,得均匀的孢子悬液,按10%的接种量接种到种子培养基中,在25 ℃下,200 r/min 振荡培养3 d,备用。
3)固态发酵:接种量25%,25 ℃培养16 d,相对湿度80%左右,无通风。
1.2.2 虫草素含量的测定
1)虫草素提取。将发酵产物搅碎,60 ℃烘干至恒重,粉碎过筛,准确称取1.0 g,加30 mL 蒸馏水,40 ℃水浴提取1 h,8 000 r/min 离心的上清液。
2)高效液相色谱检测条件。色谱柱:江苏汉邦Megres C18,250 mm×4.6 mm×5 μm;柱温30 ℃,紫外检测器波长为260 nm,流速1.0 mL/min,进样量20 μL,流动相为20%的甲醇,保留时间30 min。利用外标法计算提取液中虫草素质量浓度[22]。
3)虫草素产量计算。
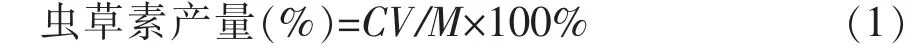
式中:C 为提取液中虫草素质量浓度,g/mL;V 为提取液体积,mL;M 为发酵产物质量,g。
1.2.3 固态发酵优化
1)培养基组成优化
(1)基质筛选。将1.1.2 中基质粉碎过筛,选0.80~0.90 mm 粒径,进行固态发酵,根据虫草素产量确定发酵基质。
(2)基质粒径优化。根据上一步结果确定的基质,将其粉碎过筛,粒径分别为1.25~1.60、0.90~1.25、0.80~0.90、0.60~0.80、0.36~0.60 mm,发酵选择最佳基质粒径。
(3)料液比优化。将基质粉碎到上一步中的最佳粒径,调节料液比分别为1∶1、1∶1.2、1∶1.5、1∶1.8、1∶2.1 进行发酵,选择最适料液比。
(4)碳源筛选。在最佳发酵基质及最适料液比的基础上,向培养基中分别加入1%的葡萄糖、果糖、半乳糖、蔗糖、麦芽糖、乳糖和淀粉,以不加碳源为对照,确定最佳碳源。之后碳源浓度为0、0.5%、1.0%、2.0%、3.0%、4.0%、5.0%添加到培养基中,选定最适浓度。
(5)氮源筛选。选择最适碳源浓度后,在培养基中分别添加0.5%蚕蛹粉、黄豆粉、酵母膏、牛肉膏、硫酸铵、氯化铵、硝酸铵,以不加氮源为对照,以确定最佳氮源。添加最佳氮源,浓度分别为0、0.5%、1.0%、2.0%、3.0%、4.0%进行发酵,确定最适浓度。
(6)辅料筛选。确定上述培养基后,选取稻壳、甘蔗渣、麦麸、稻秆、玉米秆和木屑为辅料,添加量0.5%,不加辅料作为对照,选择最佳辅料。以最佳辅料添加量分别为0、0.5%、1.0%、1.5%、2.0%发酵,以确定最适添加量。
2)培养条件优化
①装料量优化。在最适培养基组成基础上,分别称取10、20、30、40、50 g 基质,其他成分按相同比例添加,以确定最适装料量。
②接种量优化。在最适装料量上,分别加入1、2、3、4、5、6、7、8 mL 种子液,以确定最佳接种量。
③种龄优化。在种子培养的第0、1、2、3、4 d 取种子液,按最佳接种量接种到固态发酵培养基上发酵,选择最佳的接种时间。
④发酵时间优化。在培养基组成和培养条件最适的情况下进行发酵,分别在第2、4、6、8、10、12、14、16、18、20 d 取样,确定最适的发酵时间。
以上所有实验同一水平均做3 次。
2 结果与讨论
2.1 培养基组成优化
2.1.1 基质对虫草素产量的影响 在固态发酵过程中,基质为微生物的生长提供营养,形成适宜微生物生长的环境,同时基质还能为发酵产物的生物合成提供条件,因此选择合适的基质是固态发酵优化的基础,基质对虫草素产量的影响见图1。由图1可知,6 种基质中,以大米作基质时,虫草素产量为0.74%,小麦和荞麦次之,小米、高粱和玉米都很低,其中大米比高粱高出近10 倍,且大米廉价易得,最适合作为发酵基质。

图1 基质对虫草素产量的影响Fig.1 Effects of substrate on cordycepin production
2.1.2 大米粒径对虫草素产量的影响 基质粒径的大小直接影响到微生物的生长。只有基质表面能接触空气,对于蛹虫草等好氧微生物,只能在基质表面生长。基质粒径过大不利于营养物质的利用,较小的粒径有利于微生物分解基质,吸收营养物质,但基质孔隙率下降,不利于氧的传递,同样影响微生物的生长。大米粒径对虫草素产量的影响见图2。如图2 所示,虫草素的产量在大米粒径为0.90~1.25 mm 左右时最高,达到1.05%,随着粒径变小,大米的粘度增大,基质结团严重,虫草素的产量明显降低。本文选择0.90~1.25 mm 作为最佳大米粒径。

图2 大米粒径对虫草素产量的影响Fig.2 Effect of rice particle size on cordycepin production
2.1.3 料液比对虫草素产量的影响 水分是固态发酵培养基的重要组成。水可以将营养物质溶解便于微生物利用;水的比热容较高,能调节培养基的温度。料液比对虫草素产量的影响见图3。由图3 可知,料液比过低或过高都会影响虫草素的生成。料液比过低,培养基过于干燥,不利于蛹虫草的生长;料液比过高,物料结块严重,空气不流通,菌体不能再基质内部生长,同样造成虫草素产量较低。所以,料液比定为1∶1.5,虫草素产量约为1.52%。
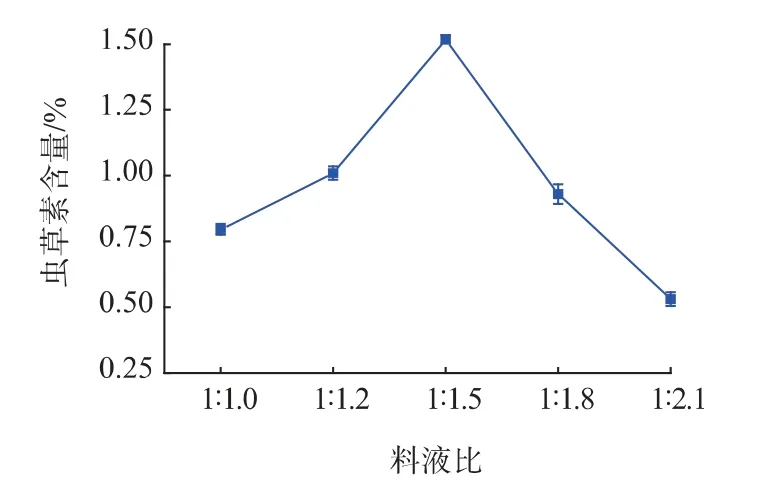
图3 料液比对虫草素产量的影响Fig.3 Effects of solid-liquid ratio on cordycepin productio n
2.1.4 碳源对虫草素产量的影响 碳源能够为微生物的生长提供物质基础,能被微生物分解转化成能量,同时也是微生物代谢产物中碳的来源。碳源对虫草素产量的影响见图4。如图4 所示,与对照相比,单糖和双糖均能不同程度的提高虫草素的产量,其中葡萄糖的效果最明显,虫草素产量为1.88%;而淀粉是多糖,分解利用较难,不利于虫草素的合成。故选择葡萄糖为发酵碳源。
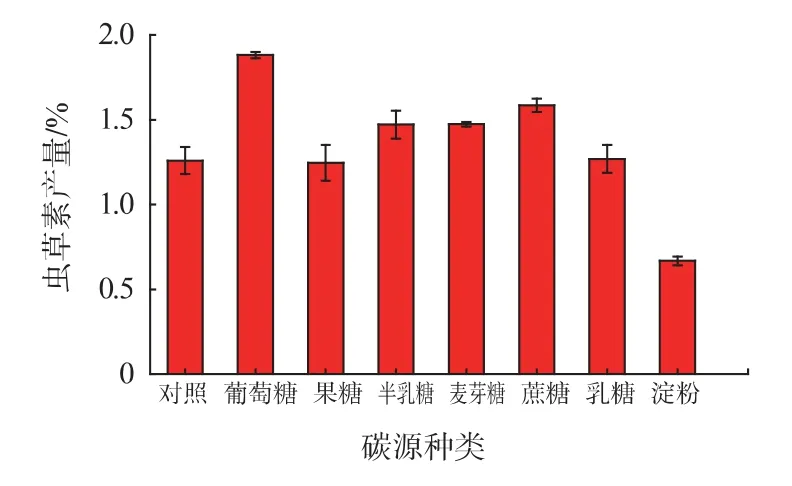
图4 碳源对虫草素产量的影响Fig.4 Effects of carbon sources on cordycepin production
2.1.5 葡萄糖浓度对虫草素产量的影响 葡萄糖最容易被微生物分解利用,为微生物的生长提供能量和物质来源,所以它常被添加到培养基中。葡萄糖不足,微生物生长缓慢,过多则会抑制微生物生长,不利于产物生成。图5 反映了葡萄糖浓度对蛹虫草产虫草素的影响,随着葡萄糖浓度的升高,虫草素产量逐渐增加,到3%时达到2.37%,之后由于葡萄糖的抑制作用而迅速降低。选择葡萄糖浓度为3%左右较合适。

图5 葡萄糖浓度对虫草素产量的影响Fig.5 Effects of glucose concentration on cordycepin production
2.1.6 氮源对虫草素产量的影响 微生物生命活动所需的蛋白质、酶、核酸及其他含氮物质的合成都需要氮源作为物质基础。氮源对虫草素产量的影响见图6。通过图6 对比发现,有机氮源对虫草素生成有促进作用,而无机氮源则没有效果,甚至有抑制作用。有机氮源中,黄豆粉效果最佳,虫草素产量为2.68%,选作氮源进一步优化。

图6 氮源对虫草素产量的影响Fig.6 Effects of nitrogen sources on cordycepin production
2.1.7 黄豆粉添加量对虫草素产量的影响 黄豆粉中含有丰富的蛋白质,能被微生物分解成氨基酸吸收利用。此外,黄豆粉中还含有核黄素、硫胺素、泛酸、尼克酸等重要物质,也能促进微生物生长代谢。黄豆粉添加量对虫草素产量的影响见图7。如图7 所示,黄豆粉添加量为2%时,虫草素产量达3.02%,确定黄豆粉最适添加量在2%左右。
2.1.8 辅料对虫草素产量的影响 固态发酵中大多会选择添加合适的辅料,因为辅料质地疏松,能有效增加发酵界面,有利于培养基的高效利用,提高培养基中氧气含量,还能提供少量营养,促进微生物的生长代谢。辅料对虫草素产量的影响见图8。图8 所列均是常用辅料,可见除玉米秆和木屑外,稻壳、甘蔗渣、麦麸和稻秆均有利于虫草素的产生,且麦麸效果最优,虫草素产量为3.35%,选择麦麸作为辅料。
图7 黄豆粉添加量对虫草素产量的影响Fig.7 Effects of soybean meal concentration on cordycepin production

图8 辅料对虫草素产量的影响Fig.8 Effects of auxiliary materials on cordycepin production
2.1.9 麦麸添加量对虫草素产量的影响 麦麸是一种常用的辅料,其能形成较大的发酵界面,提高培养基的利用率,而且含有一定量的淀粉、粗蛋白等营养物质,使得微生物生长良好,提高产物产量。麦麸添加量对虫草素产量的影响见图9。在图9 中,随着麦麸添加量的增加,虫草素产量逐渐提高,在1%添加量时,虫草素产量为3.85%,再增加添加量,虫草素产量明显下降,故麦麸添加量1%左右为好。

图9 麦麸添加量对虫草素产量的影响Fig.9 Effects of the wheat bran amount on cordycepin production
2.2 培养条件优化
2.2.1 装料量对虫草素产量的影响 装料量的多少影响培养基的多少,在发酵容器不变情况下,培养基的厚度会随之改变,会给发酵过程带来一系列变化,如氧的传递、水分蒸发速率都不同,从而影响产物的生成。装料量对虫草素产量的影响见图10。如图10 所示,装料量为10 g 时,培养基迅速干结,蛹虫草停止生长,虫草素产量低;而装料量为50 g时,培养基底部含氧量低,蛹虫草无法生长,虫草素产量也较低。装料量为30 g 时,虫草素产量为4.16%,最适合虫草素生成。

图10 装料量对虫草素产量的影响Fig.10 Effects of medium account on cordycepin production
2.2.2 接种量对虫草素产量的影响 接种量的大小直接影响到菌体生长延滞期的长短。较大的接种量能大大缩短延滞期,产物迅速合成,发酵时间缩短;但过多的接种量,会导致菌体提前衰老,使产物合成减少。另外,适当增加接种量还能抑制杂菌的生长繁殖。接种量对虫草素产量的影响见图11。如图11 所示,接种量为30%时,虫草素产量达到4.39%。接种量小于或大于30%,均导致虫草素产量偏低,故接种量定在30%左右。

图11 接种量对虫草素产量的影响Fig.11 Effects of inoculation amount on cordycepin production
2.2.3 种龄对虫草素产量的影响 接种时,一般选择处于对数生长期的菌体为好。种龄过长,菌体衰老,在培养基中不能正常生长,导致产量偏低;种龄太短,增加发酵延滞期,菌体生长缓慢,增加发酵时间。种龄对虫草素产量的影响见图12,由图12 可知,种龄为2 d 时最适合虫草素的合成,产量达到4.67%,明显高于其他种龄接种发酵后的虫草素产量。所以种子培养2 d 左右即可接种。

图12 种龄对虫草素产量的影响Fig.12 Effects of seed age on cordycepin production
2.2.4 发酵时间对虫草素产量的影响 合理的发酵时间,就是在最短的时间内,用最低的成本,达到最大的生产强度,获得最高的产物产量。虫草素产量随发酵时间的变化见图13,自第6 天起,虫草素开始大量合成,至第12 天达到4.69%,之后随时间延长变化较小,故12 d 是最佳发酵时间。

图13 发酵时间对虫草素产量的影响Fig.13 Effects of time course of fermentation on cordycepin production
3 结语
因为蛹虫草是好氧微生物,也是异样微生物,所以固态发酵过程实际上是为蛹虫草提供营养物质和氧气。例如,大米、麦麸都能为蛹虫草生长和虫草素的合成提供营养物质,而大米粒径和麦麸添加量都可以改变整个基质的空隙,提高空气交换效率,提供充足的氧气,利于蛹虫草生长代谢。料液比以另一种方式提供营养和氧气,因为水可以溶解营养物质,同时适当的含水量不会阻挡氧气流通。添加葡萄糖和黄豆粉主要是提供营养,装料量和发酵时间可以提高生产强度,接种量和种龄则影响菌株生长和产虫草素的活力。而温度、湿度等条件需要培养箱等设备的控制。可见,本文基本上是通过提供营养和氧气两方面对蛹虫草固态发酵产虫草素的条件进行优化,对后续的发酵研究具有一定的借鉴意义。
通过对蛹虫草固态发酵产虫草素的研究,优化了培养基组成及培养条件,得到最优条件:大米粒径0.90~1.25 mm,料液比1∶1.5,葡萄糖3%,黄豆粉2%,麦麸1%,装料量30 g,接种量6 mL,种龄2 d,发酵时间12 d,虫草素产量达到4.69%,约为优化前的6.3 倍。另外,本文发现葡萄糖、黄豆粉和麦麸等对虫草素产量有较显著的影响,将通过正交试验考查这些因素的相互作用,进一步提高虫草素产量。

