共表达抗氧化酶促进脂肪氧合酶在大肠杆菌中的表达
邱芳芳,刘 松,堵国成*,陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
脂肪氧合酶(EC1.13.11.12,LOX)是一类能够专一催化多元不饱和脂肪酸(含顺-1,4-戊二烯结构)形成具有共轭双键的脂肪酸氢过氧化物的酶[1-2]。此类酶分子一般含有非血红素铁。LOX 作为一种无毒无害的生物制剂,可替代溴酸钾和苯甲酰过氧化物等化学增白剂提高面粉白度。此外,LOX 能够改善面粉筋力,改善面团的水合力,增加面包体积,改善面包质构。LOX 催化不饱和脂肪酸的氧化产物可进一步转化为己醇、己醛、壬烯醛等风味化合物。
目前商业化的LOX 产品由大豆提取。然而,由于大豆中存在多种同工酶,提取法获得的LOX 产品批次稳定性差,不利于最终产品质量的控制和大规模应用。目前,大豆、豌豆、人、猪等真核细胞生物来源的LOX 已经在大肠杆菌,毕赤酵母或酿酒酵母中获得活性表达,但胞内产酶水平最高仅为4.5 U/mL。最近的报道显示,鱼腥藻(Anabaena sp.PCC 7120)LOX 在枯草芽孢杆菌中成功表达,但按标准酶活力定义计算,其胞外LOX 产量仅为0.01 U/mL[2]。本文作者所在团队将铜绿假单胞菌(Pseudomonas aeruginosa BBE)来源的LOX 基因至大肠杆菌(Escherichia coli),首次实现了LOX 在大肠杆菌中的高效分泌[1]。
一般认为,导致重组LOX 的总体表达水平不高的主要原因可能是活性LOX 产生的氧自由基会对宿主细胞产生毒性,进而抑制宿主细胞的生长和重组蛋白合成及分泌[1]。为降解活性氧中间体,细菌会产生超氧化物歧化酶(SOD)和过氧化氢酶(CAT)来消除活性氧中间体对细胞的毒害[3-6]。本研究通过共表达P.aeruginosa BBE 来源SOD(sodB、sodM)和E.coli 来源的CAT(katE),以期降低LOX 表达对细胞的毒性,进一步提高其在大肠杆菌中的表达水平。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 E.coli Rosetta(DE3)(pET-22b(+)/pre-LOXlox1)(N6)为分泌表达P.aeruginosa BBE来源LOX的重组E.coli Rosetta(DE3)[1]。pRSFDuet-1 为表达载体。E.coli JM109 分别用于基因克隆。
1.1.2 培养基 LB 培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L。
发酵培养基(TB 培养基):蛋白胨12 g/L,酵母提取物24 g/L,甘油4 mL/L,K2HPO472 mmol/L,KH2PO417 mmol/L,诱导时培养基中添加终浓度为1 mmol/L 的IPTG 和1.5%(V/V)的吐温20。
1.1.3 试剂 Taq DNA 聚合酶,T4 DNA 连接酶,限制性内切酶,DNA 和蛋白Marker 等购自宝生物工程(大连)有限公司。质粒抽提试剂盒购于生工生物工程(上海)股份有限公司。DNA 凝胶回收试剂盒,PCR 产物纯化试剂盒购自赛默飞世尔科技公司,亚油酸为Sigma-Aldrich 公司产品。引物由深圳华大基因科技有限公司合成。其余常用试剂购于国药集团化学试剂有限公司。
1.2 方法
1.2.1 基因的PCR 扩增 设计合成分别带有NotⅠ和XhoⅠ两种酶切位点的SodB、SodM、CAT 引物。以P.aeruginosa BBE 基因组为模板,以P1 和P2为上下游引物扩增5’端带有NotⅠ和3’端带有和XhoⅠ两种酶切位点的sodB 基因;以P3 和P4 为上下游引物,扩增5’端和3’端分别带有NotⅠ和XhoⅠ两种酶切位点的sodM基因.以大肠杆菌JM109 基因组为模板,以P5 和P6 为引物,扩增5’端和3’端分别带有NotⅠ和XhoⅠ两种酶切位点的katE 基因。PCR 引物序列见表1。

表1 PCR 引物序列Table 1 PCR primer sequence
1.2.2 表达载体的构建及转化 将上述PCR 产物分别克隆至pRSFDuet-1 上的NotⅠ和XhoⅠ之间,分别构建得到表达sodB,sodM 和katE 的重组质粒pRSF-sodB,pRSF-sodM 和pRSF-katE,3 个质粒分别转化E.coli Rosetta(DE3)(pET-22b(+)/pre-LOXlox1)感受态细胞,冰浴30 min,42 ℃热激90 s,再加入1 mL LB 培养基37 ℃振荡培养1 h,涂布LB 平板(含50 μg/mL 氨苄霉素,10 μg/mL 卡那霉素和34 μg/mL 氯霉素),置于37 ℃培养箱中培养12 h。挑取若干LB 平板单菌落分别接种于3 mL LB液体培养基中(含50 μg/mL 氨苄霉素,10 μg/mL 卡那霉素和34 μg/mL 氯霉素),培养12 h,用质粒抽提试剂盒提取质粒,用表1 中的引物进行PCR 扩增,PCR 产物进行琼脂糖凝胶电泳,以验证各质粒是否已转化成功,并进行测序.PCR 产物纯化和凝胶回收按试剂盒说明书进行操作,基因的酶切和连接按试剂说明书进行操作。
1.2.3 共表达N6-B,N6-M 和N6-K 菌株的诱导表达 将表达质粒pRSF-sodB,pRSF-sodM 和pRSFkatE 转化至表达LOX 的重组大肠杆菌N6,分别得到菌株N6-B,N6-M 和N6-K。从固体培养基上挑取原始菌株N6 及N6-B,N6-M 和N6-K 的单菌落,分别接种于装有20 mL LB 的250 mL 三角瓶中,N6培养基中加入50 μg/mL 氨苄霉素(终浓度)和34 μg/mL氯霉素(终浓度),N6-B,N6-M 和N6-K 的培养基中加入50 μg/mL 氨苄霉素(终浓度),34 μg/mL 氯霉素(终浓度)和10 μg/mL 卡那霉素(终浓度),于37 ℃和200 r/min 培养过夜,按1%接种量接入装有50 mL LB 的500 mL 三角瓶中,37 ℃,200 r/min 培养至OD600至0.6 左右,加入终浓度为1 mmol/L 的IPTG 和终浓度为1.5%的吐温20,20 ℃诱导70 h[7]。
1.2.4 诱导条件优化 外源基因在工程菌中的诱导表达受到很多因素例如菌株类型,目的基因密码子优化,载体类型,培养基,诱导条件(如诱导剂类型和浓度,诱导时间,诱导温度)等的影响,因此确定还原酶在N6 中表达的优化条件对提高LOX 最终产量具有重要意义[8]。根据第一步的实验结果,选取LOX 酶活最高的N6-M 重组菌株,由于N6-M 中的两个质粒均为T7 启动子,所以选取诱导剂浓度和诱导时菌体浓度两个因素。采用L12(41×31)正交表,选定诱导时异丙基-β-D-硫代半乳糖苷(IPTG)浓度和菌体浓度(OD600)作为考察因子。其中IPTG的浓度为4 水平,OD600为3 水平,进行正交试验。实验以诱导30 h 胞内LOX 酶活为评价指标,实验因素水平设置如表2 所示,选择最佳条件和水平。

表2 诱导条件正交因素水平表Table 2 Orthogonal factor levels of induction conditions
1.2.5 重组菌株生长测定 将各共表达菌株和对照菌株接种至含有相应抗生素的LB 液体培养基,200 r/min,采用比浊法(OD600)测定菌体生长。
1.2.6 酶活检测 LOX 酶活测定:在25 ℃下和234 nm 条件下以亚油酸为底物,使用Shimadzu UV-2450 分光光度计在线测定吸光值的变化,以吸光值变化曲线稳定上升部分的斜率计算酶活[7]。LOX 酶活单位定义:25 ℃下每分钟催化亚油酸形成亚油酸氢过氧化物(HPOD,ε=25 000 L/(mol·cm))1 μmol所需要的酶量定义为1 个酶活单位(U)。
SOD 酶活测定:邻苯三酚在碱性条件下的自氧化反应生成红橘酚,同时有O2-产生,邻苯三酚的自氧化速率与O2-的浓度有关;SOD 能通过催化O2-发生歧化反应得到H2O2和O2,来抑制邻苯三酚的自氧化;检测邻苯三酚自氧化速率的抑制率,可得知样品中的SOD 的含量;故,使用Shimadzu UV-2450分光光度计测定在25 ℃条件下邻苯三酚在325 nm处吸光值变化曲线的斜率,计算酶活[6]。酶活单位定义:25 ℃时抑制邻苯三酚自氧化速率50%时所需要的SOD 酶量为一个酶活力单位(U)。
CAT 酶活测定:在240 nm 波长下H2O2有强烈吸收;过氧化氢能被过氧化氢酶分解,从而反应溶液的吸光值(A240)随反应时间下降,使用Shimadzu UV-2450 分光光度计测定该反应体系在25 ℃条件下240 nm 处的吸光值变化,以吸光值变化拟合斜率,计算酶活[6]。酶活单位定义:使0.1 mol/L H2O2在1 min 内A240减少0.1 的酶量为一个酶活单位(U)。
为了分析重组菌中SOD 和CAT 的表达情况,将不同时间点取的样品离心收集菌体,用pH 7.5 的PBS 缓冲液漂洗一遍后重悬,超声破碎,离心去上清得到胞内可溶物质。破碎后上清液检测SOD 和CAT的酶活性。
1.2.7 SDS-PAGE 分析 将不同诱导时间的发酵液离心,0.5 mL 的菌体用磷酸缓冲液(PBS,pH 7.5)漂洗一遍,然后用1.5 mL PBS 悬浮,超声破碎10 min,离心取上清。破碎后的胞内可溶物质和发酵液上清一起进行SDS-PAGE 分析。
2 结果
2.1 重组质粒pRSF-sodB,pRSF-sodM,pRSFkatE 的构建
研究显示,超氧化物歧化酶和过氧化氢酶可以降解细胞内的活性氧中间体[3-6]。为考察抗氧化酶对LOX 表达的影响,将PCR 扩增得到的P.aeruginosa BBE 超氧化物歧化酶基因sodB 和sodM 以及E.coli 过氧化氢酶基因katE 克隆至pRSFDuet-1,分别得到表达质粒pRSF-sodB,pRSF-sodM 和pRSFkatE(图1)。重组的pRSF-sodB、pRSF-sodM,pRSFkatE 经双酶切后可以分别得到约600、600 bp 和2 400 bp 的DNA 片段。测序结果显示DNA 序列无突变,证明重组表达载体构建成功,抗性平板上长出的即为阳性克隆。

图1 重组质粒的构建Fig.1 Construction of recombinant plasmids
2.2 抗氧化酶共表达对LOX 表达的影响
将构建得到的抗氧化酶表达质粒pRSF-sodB,pRSF-sodM 和pRSF-katE(图1)转化LOX 表达菌N6,分别得到重组菌N6-B,N6-M 和N6-K。将重组菌进行摇瓶发酵,IPTG 诱导70 h。如图2 所示,诱导70 h 后,N6、N6-B、N6-M 和N6-K 胞外LOX 酶活分别为10.3,2.9,3.1 和7.1 U/mL,胞内LOX 酶活分别为1.5,18.7,25.0 和0 U/mL。因此,N6-B、N6-M 和N6-K 诱导70 h 的LOX 总酶活分别为11.8,21.6,28.1 和7.1 U/mL,其中,N6-B 和N6-M的LOX 酶活分别较对照菌株N6 分别提高的1.8 和2.4 倍,N6-K 较对照菌株N6 下降40%,值得注意的是,当IPTG 诱导32 h,N6-M 中胞内LOX 酶活达到最大值27.2 U/mL,是N6 胞内LOX 酶活的3.1 倍。结果表明:共表达超氧化物歧化酶能有效促进胞内LOX 的高效合成,但降低了其向胞外分泌;共表达过氧化氢酶(katE)抑制了重组菌表达与分泌LOX。


图2 重组菌发酵产LOXFig.2 Fermentation production of the LOX by the recombinant strains
为进一步分析LOX 在重组菌N6-B、N6-M 和N6-K 中的表达情况,对其胞内可溶物质和发酵液上清液进行SDS-PAGE 分析。如图3 所示,诱导表达32 h 和70 h 后,N6、N6-B、N6-M 和N6-K 胞内均存在70 kDa 条带,与LOX 的理论分子量一致[1]。其中,N6-M 的LOX 条带明显较对N6 相应条带增粗,与酶活测定结果一致(图3)。此外,在胞内样品中 未 见SodB(21 kDa)、SodM(22 kDa)和CAT(84 kDa)蛋白条带,可能这几种酶表达量不高或者表达后被快速降解。

图3 SDS-PAGE 电泳分析LOX 与抗氧化酶的共表达Fig.3 SDS-PAGE analysis of the co-expression of LOX and antioxidase
2.3 重组菌胞内抗氧化酶活分析
为了分析重组菌中抗氧化酶的表达情况,测定了破碎后上清液检测SOD 和CAT 活性。如图4(a)所示,N6-B 和N6-M 胞内SOD 酶活波动较大,但总体上N6-M 中SOD 的酶活明显高于N6-B 和N6;N6-B 中SOD 酶活总体水平较N6 未见明显提高,但其酶活较N6 出现更早。研究表明,SOD 的表达受环境中K+和Ca2+影响较大[3],整个发酵周期中伴随着大肠杆菌的生长和裂解,环境中的离子浓度会随菌体变化产生一些波动可能引起了N6-B 和N6-M中SOD 酶活波动。因此,SOD 胞内活性的增加可能是LOX 大量累积的重要原因.由图4(b)可知,在诱导前期N6-K 中CAT 酶活显著提高,表明CAT 在N6 中也得到了活性表达。但是,N6-K 与N6 中胞内LOX 酶活未见明显差异,胞外酶活有所下降。这说明CAT 活性未对LOX 的表达产生明显促进作用,可能表达CAT 加重重组菌株表达外源蛋白质的负担[9]。

图4 重组菌胞内抗氧化酶活Fig.4 Antioxidase activity in recombinant strains
2.4 诱导条件的优化
重组蛋白的表达水平在一定范围内与工程菌的生长具有一定的关联性,其依赖于培养温度、培养基组成、IPTG 的浓度和诱导时间等因素[9]。因此,确定重组菌株的诱导条件对LOX 的最终产量和工业化生产具有重要意义。根据第一步的实验结果,选择LOX 酶活力最高的N6-M 重组菌株作为优化对象,由于N6-M 中的两个质粒均为T7 启动子,同时IPTG 存在着潜在的毒性,所以选取诱导剂浓度和诱导时菌体浓度两个因素。由于诱导30 h 胞内LOX 已经大量积累,所以检测诱导30 h 细胞破碎后上清中LOX 酶活作为实验的判断标准。正交试验结果如表3 所示。
分析正交试验得出以下结论:1)由极差大小可以直观判断出各因素对LOX 酶活的影响主次顺序为:诱导时菌体浓度(A)>IPTG 终浓度(B)。蛋白的表达依赖于足够量和生长旺盛的菌体,所以重组菌的生长和蛋白的表达在时间上存在差异[8]。重组菌的数量不足,即菌株处于对数期前期及对数期前,能够表达重组蛋白的菌体不足,重组蛋白的表达量会受到较大影响。2)N6-M 发酵产LOX 的因素最佳条件组合为:诱导时菌体浓度(OD600)2.5+IPTG 终浓度2.0 mmol/L(即A3B4),胞内LOX 酶活为28.8 U/mL,较优化前(诱导OD600=0.6,IPTG=1 mmol/L)提高5.88%。
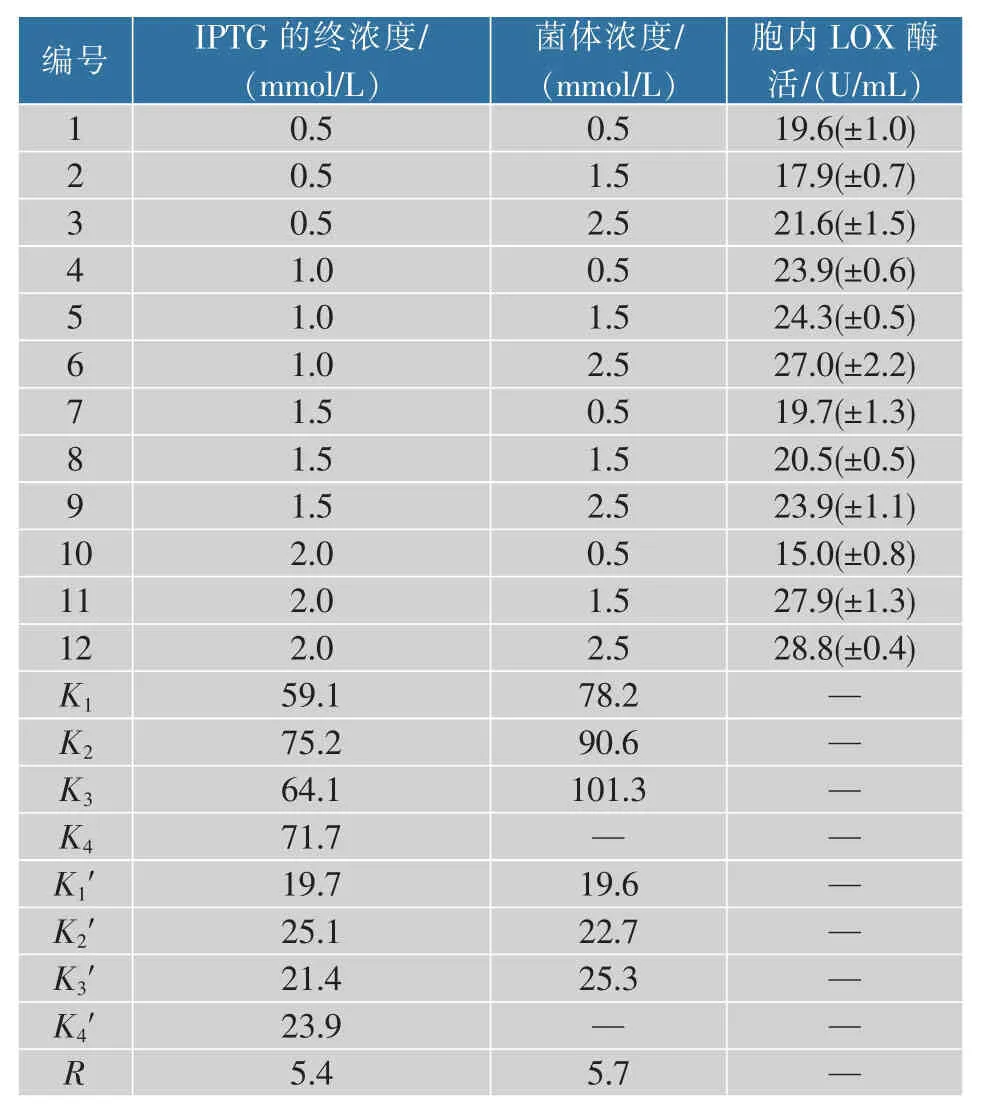
表3 正交实验结果Table 3 Results of orthogonal experiment
3 讨论
作为典型的过氧化物酶,LOX 在工业生产中的应用受到人们的日益关注。LOX 可以对面粉进行漂白,改善面粉筋力,改善面团的水合力,提高面团强度和增加食物风味,大豆提取的LOX 各批次之间会有较大差异,因此利用大肠杆菌表达LOX 是工业化生产稳定的LOX 的重要基础。来源于动物,植物等真核生物的LOX 基因在大肠杆菌[10]、酵母、曲霉等系统中实现了表达。原核LOX 基因研究较少,仅Cyanobacterium、N.punctiforme 及P.aeruginosa 在大肠杆菌系统中得到表达[11]。酵母系统中研究者利用信号肽使LOX 分泌到胞外,简化了下游操作,但产量十分有限;枯草芽孢杆菌中LOX 胞外产量仅有0.01 U/mL[12-13],Steczko 在E.coli 表达系中实现了大豆LOX 的胞内表达,酶活达到4.5 U/mL[14-15]。但总体而言,LOX 的异源表达的水平偏低。
氧毒性在各种物种中均有发现,是由分子氧的一价还原产物介导的,包括超氧自由基(O2-),过氧化氢(H2O2)和羟基(OH-)[3]。氧毒性对生物和非生物的威胁可能来自于O2-内在和相对选择性的反应性,而且O2-可以通过质子化得到氧化性更强的HO2-,或者通过铁催化的Haber-Weiss 反应生成OH·。而LOX 能催化内源性化学物如花生四烯酸的反应并伴有活性氧的产生,LOX 还能通过影响细胞间的信号转导而激活其他活性氧产生途径;此外,LOX 还能催化外源化学物代谢为高活性的自由基中间体而诱发活性氧的产生。因此,如何降低LOX活性对宿主菌的毒性可能是其高效表达的关键。
SOD 是非常高效的催化剂,25 ℃下速度约为2×109m/s,活化能为26.9 kJ/M[16]。N6 表达的LOX 为铜绿假单胞菌(P.aeruginosa BBE)来源,而P.aeruginosa 中会产生几种SOD 包括SodB 和SodM,与降解胞内活性氧中间体有关[17]。因此,本研究选择P.aeruginosa 来源的SodB,SodM 和E.coli 来源的CAT 三种抗氧化酶,构建共表达载体,降低N6 中LOX 大量合成对细胞产生的压力,从实验结果来看,共表达SodM 时,N6-M 中LOX 酶活提高最多,是原始N6 的2.4 倍(图2)。虽然影响外源蛋白在宿主中表达因素还有很多,但本研究为LOX 的异源表达提供了一个方向,降低胞内活性氧中间体可能是一种解决方法。
4 结语
微生物发酵产品想要成功实现产业化,发酵工艺的优化是重要的环节。本研究通过正交实验对N6-M 发酵的菌体浓度和IPTG 浓度两个条件进行优化,实验结果表明OD600为2.5 时,添加终浓度为2 mmol/mL 的IPTG 诱导30 h 后胞 内LOX 酶活达到28.8 U/mL,与OD6000.6,IPTG 终浓度1 mmol/mL的初始条件相比提高了5.88%。

