代谢工程改造大肠杆菌合成酪醇
薛宇翔,陈献忠*,杨 翠,沈 微,樊 游
(1.江南大学,工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
酪醇,即4-(2-羟基乙基)苯酚,作为一种重要的芳香族化合物,是天然的抗氧化剂,也是苯乙醇的衍生物[1]。酪醇天然存在于橄榄油、绿茶及酒中[2-4],它可以保护细胞免受氧化伤害。酪醇及其衍生物具有多方面的生理学活性[5],如抗疲劳、抗缺氧、抗应激、抗寒冷、镇静等的药理作用[2,6],进而运用在相关药物(主要是治疗心血管疾病的药物)的研发生产上[7]。随着对酪醇的生理功能的研究进一步加深,酪醇的生产也受到越来越多的关注。
现阶段,酪醇制备方法主要是天然材料提取法和化学法合成法。对于天然材料提取来说,酪醇可以从橄榄或橄榄油制备过程中产生的废水中提取分离纯化获得。天然提取制备酪醇存在很多弊端,对于橄榄油提取酪醇,其回收率和纯度极低,成本投入高,这些问题在工业大规模化生产应用时会带来很大的阻力[8]。化学合成法是主要以对羟基苯乙烯、对羟基苯乙胺等为原料合成酪醇,生产原料价格昂贵,且在生产过程中会产生对环境有害物质,这些问题制约了大规模化、工业化生产[9-10]。
近年来,研究者尝试通过生物发酵法来合成酪醇,由于生物合成有能够减少对环境的污染及方便后续酪醇的提取,同时不依赖于植物资源等优点,备受关注。在自然界中,存在两种生物合成途径,见图1,一种是酿酒酵母生物合成途径:酪氨酸(TYR)经过芳香族氨基酸氨基转移酶(ARO8)作用脱去氨基,再经丙酮酸脱羧酶(ARO10)的作用脱羧,最后在乙醇脱氢酶的作用下合成酪醇[11-13];一种是酪氨酸经酪氨酸脱羧酶(TDC)的作用生成酪胺,酪胺进一步在酪胺氧化酶(TYO)和乙醇脱氢酶(ADH)的作用下生成酪醇[1]。研究者在酿酒酵母中过表达ARO8及ARO10 基因,以苯丙氨酸为底物,可以提高的苯乙醇合成能力,重组菌的苯乙醇的产量比野生型的提高了36.8%[14]。为了构建产红景天苷的大肠杆菌,研究者在大肠杆菌异源表达ARO10 和葡萄糖基转移酶等关键基因,并进行代谢途径改造,重组菌能够合成红景天苷和其前体物质酪醇[11]。
本研究在E.coli 中异源表达ARO10 基因,并通过敲除预苯酸脱水酶编码基因pheA 和苯乙醛脱氢酶编码基因feaB,阻断了苯丙氨酸途径及4-羟基苯乙酸合成途径,改善了酪醇的合成能力,通过培养条件的优化,提高了酪醇的产量。在外源添加酪氨酸的发酵培养基中,重组菌合成酪醇的能力有所提高。

图1 酪醇的生物合成途径Fig.1 Biosynthesis pathway of tyrosol
1 材料与方法
1.1 材料
1.1.1 菌株、质粒 菌株:大肠杆菌(Escherichia coli BL21(DE3))、E.coli JM109,酿酒酵母(Saccharomyces cerevisiae EBY100)均为江南大学生物资源与生物能源研究中心保藏。
质粒:pRSFDuet-1、pKD13、pKD46、pCP20 由本实验室保藏。
1.1.2 主要试剂 限制性内切酶、T4 DNA 连接酶、Taq DNA 聚合酶及蛋白分子量marker 均购自TaKaRa 生物技术公司。B 型质粒少量快速提取试剂盒及DNA 纯化与割胶回收试剂盒均购自北京博大泰克生物基因技术有限公司。氨苄青霉素(Amp)、卡那霉素(Kan)与异丙基硫代半乳糖苷(IPTG)购自上海生工生物工程有限公司,酪氨酸和酪醇标准品购自SIGMA(上海)公司,其他的分析纯级试剂购自上海生物工程公司。
1.2 方法
1.2.1 培养基和培养条件 LB 培养基:酵母粉0.5%,蛋白胨1%,氯化钠1%,固体培养基加琼脂粉2%,121 ℃下灭菌20 min。
M9Y 培养基:葡萄糖1%,酵母粉0.025%,七水磷酸氢二钠1.28%,磷酸二氢钾0.3%,氯化钠0.05%,氯化铵0.1%,115 ℃下灭菌15 min。转接时需添加分开灭菌的硫酸镁溶液,其最终浓度应为5 mmol/L。
种子培养:划单菌落到LB 液体培养基,在37 ℃、200 r/min 的条件下培养约12 h。用紫外分光光度仪测定种子培养液的OD600,转接1 mL 种子培养液到50 mL 的LB 液体培养基中。
诱导培养:将培养基在37 ℃、200 r/min 的条件下培养,控制培养液OD600在0.6~0.8,添加一定量的IPTG,在30 ℃、200 r/min 的条件下培养10 h。
发酵培养:将诱导表达后的培养液于4 ℃、7 000 r/min 的条件下离心3 min,并用无菌水离心洗涤,收集菌体。转接入M9Y 培养基在30 ℃、200 r/min的条件下,发酵培养48 h。
1.2.2 目的基因的克隆 本研究中所用引物见表1,引物由上海生工生物工程技术服务部合成。根据NCBI 公布的酿酒酵母(S.cerevisiae EBY100)丙酮酸脱羧酶基因ARO10(GenBank ID:851987)序列设计引物ARO10U 和ARO10D。PCR 扩增参数:95℃变性5 min,然后94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.5 min,30 个循环后16 ℃保温30 min,得到目的基因ARO10。

表1 基因PCR 扩增引物列表Table 1 List of primers in this study
1.2.3 重组表达载体的构建 将ARO10 基因PCR产物与pRSFDUet-1 质粒同时用NcoI 与BamHI 双酶切后,纯化处理,用T4 DNA 连接酶进行连接,16℃反应12 h,得到表达载体pRSFDUet-ARO10,转化E.coli BL21(DE3)感受态细胞,提取质粒酶切鉴定。
1.2.4 feaB、pheA 和tyrB 基因的敲除 制备含有pKD46 的E.coli BL21(DE3)电转化感受态细胞[15],将由引物YfeaBU 和YfeaBD(表1)扩增获得的DNA 片段(feaB 上下游同源序列、FRT 位点和kan基因),电转化入含有pKD46 的E.coli BL21(DE3)感受态细胞,电转化条件为2 mm 电转杯、电压2 500 V,电转化后37 ℃下培养2 h,涂布于Amp 和Kan 双抗性LB 平板上。突变盒片段进入细胞后,在pKD46 辅助质粒所表达的重组蛋白的帮助下,同源臂基因与大肠杆菌基因组发生同源重组,使feaB 基因区域被敲除框替换,即feaB 被kan 替换,因此,重组菌可在Kan 抗性平板上生长。平板培养12 h 后挑取单菌落,用鉴定性引物NfeaBU 和NfeaBD(表1)PCR 扩增,通过确定敲除框上下游是否正确交换来鉴定的敲除。之后将pCP20 质粒转入E.coli BL21(DE3)ΔfeaB::kan 菌株中,42 ℃培养12 h,取菌液稀释,涂布于LB 固体平板。pCP20 质粒含编码FLP 重组酶的基因,可介导2 个FRT 位点间的切除,从而消除kan 基因。pCP20 为温敏型质粒,培养温度高于37℃时会自动丢失,因此挑取单菌落分别点到Kan 抗性LB 平板和LB 平板上培养12 h,挑取在LB 固体培养基平板上生长而Kan 抗性平板上不生长的菌落,即为E.coli BL21(DE3)ΔfeaB。
制备含有pKD46 的E.coli BL21(DE3)ΔfeaB的感受态细胞,将由引物YpheAU 和YpheAD(表1)扩增获得的DNA 片段(含pheA 上下游同源序列、FRT 位点和kan 基因),利用同上的电转化技术,转入含有pKD46 的E.coli BL21(DE3)ΔfeaB 的感受态细胞。利用同上的方法,最终得到了E.coli BL21(DE3)ΔfeaBΔpheA。
制备含有pKD46 的E.coli BL21(DE3)的感受态细胞,将引物YtyrBU 和YtyrBD(表1)扩增获得DNA 片段(含tyrB 上下游同源序列、FRT 位点和kan 基因),利用电转化技术,转入含有pKD46 的E.coli BL21(DE3)的感受态细胞,经标记基因弹出后,最终获得E.coli BL21(DE3)ΔtyrB。
1.2.5 酪醇和酪氨酸的高效液相测定 使用高效液相色谱(HPLC)。色谱条件如下:HPLC 色谱柱为COSMOSIL-5C18-MS-Ⅱ(3.0 ID×150 mm)[16]。流动相A 为0.1%三氟乙酸,流动相B 为纯甲醇,柱温为30 ℃,紫外检测器,流速设置为0.4 mL/min。流动相需用0.22 μm 孔径的水系膜进行真空抽滤,使用前超声10 min 除去气泡。
样品处理:取发酵液100 mL,12 000 r/min 离心5 min 收集上清,经0.22 μm 孔径滤膜过滤后加入HPLC 样品瓶对发酵液中的酪醇和酪氨酸含量进行检测[17]。
2 结果与分析
2.1 产酪醇的重组大肠杆菌构建
2.1.1 重组质粒的构建 以酿酒酵母(S.cerevisiae EBY100)染色体DNA为模版,PCR扩增得到ARO10 基因片段,目的基因经NcoI 与BamHI 酶切纯化后插入到表达载体pRSFDUet-1 的相应酶切位点上,获得重组表达载体pRSFDUet-ARO10,酶切验证(如图2 所示),ARO10 片段大小为1 908 bp,与预期结果一致,证明表达载体pRSFDUet-ARO10构建成功。

图2 酶切产物电泳检测图Fig.2 Enzyme-digested product of the recombinant plasmid pRSFDUet-ARO10
2.1.2 重组菌发酵生产酪醇 将pRSFDUet-1 质粒和重组表达载体pRSFDUet-ARO10 分别导入E.coli BL21(DE3)中,获得重组菌BE0 和重组菌BE1,两株重组菌发酵培养48 h,发酵结果如图3 所示。由图3 可知,重组菌BE0 发酵液中未检测到酪醇,可见大肠杆菌本体内不能合成酪醇。重组菌株BE1的酪醇产量达到0.35 mmol/L,可知通过丙酮酸脱羧酶编码基因ARO10 异源表达,可以建立E.coli 合成酪醇的途径。另一方面,虽然重组质粒进行游离表达,而且带有T7 的强启动子,但是酪醇的产量还是较低的,这说明重组E.coli 从葡萄糖到酪醇的合成途径较长,而且芳香族氨基酸合成途径中存在的反馈调节,也可能阻碍酪醇的合成。
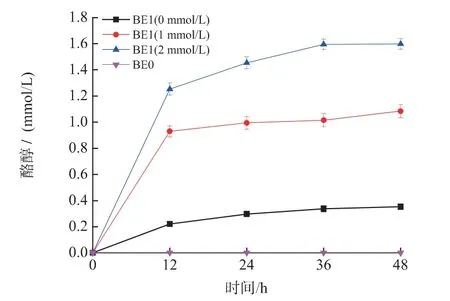
图3 外源添加酪氨酸对重组菌BE1 酪醇合成的影响及重组菌BE0 发酵生产酪醇过程Fig.3 Effect of supplementing tryrosine on the tryrosol production for the recombinant strain BE1 and the course of producing tyrosol by the recombint strain BE0
2.2 外源添加酪氨酸对重组菌BE1 酪醇合成的影响
由图1 代谢途径可知,酪氨酸和酪醇合成过程中需要利用相同的前体—4-羟基苯丙酮酸(4HPP)。因此,推测胞内的酪氨酸浓度可能会影响酪醇的合成。通过添加不同浓度(0、1.0、2.0 mmol/L)的酪氨酸考察了重组菌BE1 对酪醇的产量的影响。发酵结果及酪醇产量提高率如图3 和表2 所示。

表2 添加不同浓度酪氨酸时重组菌BE1 合成酪醇的产量Table 2 Tyrosol production of different concentration tyrosine sumplemented in M9Y for BE1
从图3 中可以得出,发酵培养基中添加不同浓度的酪氨酸,酪醇的产量都有了较大的提高。发酵液中未检测到酪氨酸,说明发酵液中几乎没有酪氨酸残留。从代谢途径上可以推测重组菌BE1 中大肠杆菌本体内基因tyrB 可能导致酪氨酸生成4-羟基苯丙酮酸,进而产生了酪醇。根据以上结果,决定保留该菌株的酪氨酸合成途径。
2.3 改造旁路代谢途径并提高酪醇产量
2.3.1 敲除基因feaB 和pheA 由代谢途径(图1)分析可知,敲除feaB 和pheA 基因,可以阻断4-羟基苯乙酸的合成途径和苯丙氨酸代谢途径,推测可能提高酪醇产量。因此,进一步构建含有feaB 基因同源臂和kan 抗性基因的删除盒并转化E.coli BL21(DE3)菌株,筛选转化子并经诱导弹出kan 抗性基因。突变株的PCR 鉴定结果如图4(a)所示,原始菌株PCR 产物大小为1 780 bp,抗性基因弹出后的突变株PCR 产物大小为398 bp,与预期结果一致,证明成功敲除了feaB 基因。在敲除feaB 基因的基础上,敲除pheA 基因,阻断苯丙氨酸代谢途径。将kan 抗性基因整合E.coli BL21(DE3)ΔfeaB 菌株的pheA 基因位点,转入pCP20 质粒消除Kan 抗性后转化子验证,结果如图4(b)所示,原始序列为1 658 bp,突变株499 bp。与预期结果一致,证明成功敲除了pheA 基因。

图4 PCR 验证Fig.4 PCR identification
2.3.2 基因敲除后对酪醇产量的影响 将构建好的表达载体pRSFDUet-ARO10 导入E.coli BL21(DE3)ΔfeaB 和E.coli BL21(DE3)ΔfeaBΔpheA,获得重组突变菌株BE3 和BE4。将重组菌BE1、BE3和BE4 发酵48 h,收集发酵液处理后检测酪醇,结果如图5 所示。

图5 基因敲除对酪醇产量的影响Fig.5 Effect of gene deletion on tryrosol production
从图5 中可以看出,对于菌株BE3 来说,酪醇产量达到0.41 mmol/L,可知,敲除feaB 基因,较BE1 提高了17.1%,说明敲除feaB 基因,有助于提高酪醇的合成能力;对于菌株BE4 来说,可产酪醇0.91 mmol/L,较BE1 提高了160%,说明在敲除feaB基因基础上,敲除pheA 基因,可显著提高酪醇的合成能力。进而说明敲除feaB 和pheA 基因,阻断了4-羟基苯乙酸与苯丙氨酸生成途径,使葡萄糖更多地流向酪醇成途径,从而提高了酪醇的合成能力。
2.4 重组突变菌株BE4 产酪醇条件的优化
2.4.1 重组蛋白诱导温度及诱导时机的优化 温度对酶的活性及其表达有着极大的影响[18],考察了不同诱导温度(20、25、27、30 ℃对酪醇产量的影响,结果如图6(a)所示。从图中6(a)可以看出诱导温度在25 ℃时,酪醇的产量最高,产量可达3.61 mmol/L。诱导时机对重组蛋白表达有重要影响。考察了在不同OD 值(0.6、0.9、1.2、1.5、1.8、2.1)时诱导剂IPTG 诱导蛋白表达对酪醇产量的影响,结果如图6(b)所示。图6(b)表明OD 值高于0.6 时并不利于酪醇的产生,当OD 值在0.6~0.8,大肠杆菌处于对数生长期,生理状态良好,更利于最终酪醇的产生。最终酪醇产量可达3.48 mmol/L。
2.4.2 诱导剂浓度的优化 诱导剂浓度的大小可以起到促进或抑制的作用,所以适当浓度的诱导剂是十分关键的。考察了不同IPTG 浓度(0.2、0.4、0.6、0.8、1.0、1.2 mmol/L)对酪醇产量的影响,结果如图6(c)所示。由图中6(c)可以看出当IPTG 浓度在0.8 mmol/L时,酪醇产量最低,当IPTG 浓度在0.2 mmol/L 时,酪醇产量最高,产量可以达到4.15 mmol/L。

图6 重组菌诱导条件对酪醇合成的影响Fig.6 Optimization of induction conditions for tyrosol produciton
2.5 基因tyrB 对酪醇合成的影响
2.5.1 基因tyrB 的删除 为删除E.coli BL21(DE3)菌株的tyrB 基因,构建含有同源臂和Kan 抗性基因的删除盒,将其转化E.coli BL21(DE3)并整合到基因组上,筛选转化子并经诱导弹出Kan 抗性基因。野生型与突变型转化子菌落PCR 验证,原始菌株PCR 产物大小为1 059 bp,抗性基因弹出后的突变株PCR 产物大小为254 bp。结果如图7 所示,与预期的大小一致,证明基因tyrB 已成功敲除。

图7 大肠杆菌tyrB 基因敲除的PCR 验证Fig.7 PCR identification of the gene tyrB deletion in E.coli strain
2.5.2 删除基因tyrB 对重组菌合成酪醇的影响将构建好的表达载体pRSFDUet-ARO10 导入E.coli BL21(DE3)ΔtyrB 中,获得重组大肠杆菌BE2。将两株重组菌BE1 和BE2 经种子液培养、LB 液体培养、IPTG 诱导表达,分别转接外源添加不同浓度(0、1、2.8 mmol/L)酪氨酸的M9Y 培养基中,发酵培养48 h,发酵结果如图8 所示。
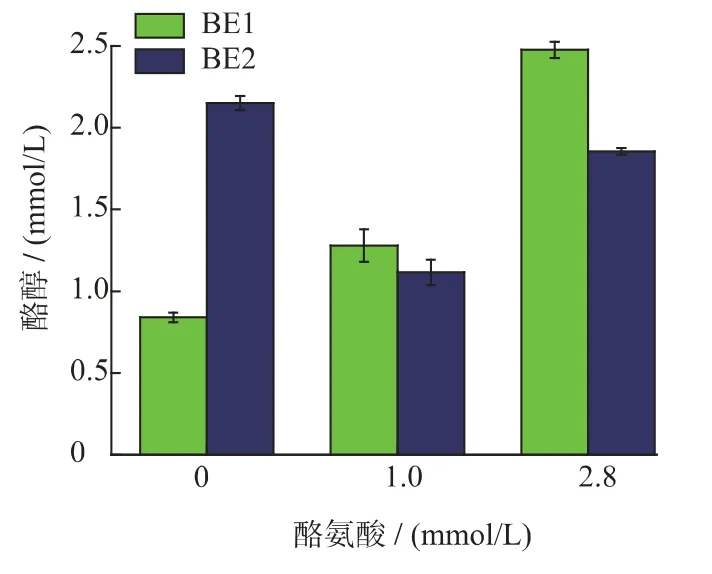
图8 外源添加酪氨酸对重组菌BE1 和重组菌BE2 酪醇合成的影响Fig.8 Effect of supplementing tryrosine on the tryrosol production for the recombinant strain BE2 and BE1
从图8 可以看出,发酵培养基不添加酪氨酸时,BE1 可产酪醇0.86 mmol/L,BE2 可产酪醇2.18 mmol/L,BE2 的合成能力高于BE1,可知,删除基因tyrB 可以提高重组菌酪醇的合成能力。从图6 可以看出,发酵培养基外源添加2.8 mmol/L 的酪氨酸与1 mmol/L 酪氨酸相比,重组菌BE1 和BE2 的合成能力均有提高。发酵液中未检测到酪氨酸,说明发酵液中几乎没有酪氨酸残留。可知,大肠杆菌胞内存在多条催化酪氨酸合成4-羟基苯丙酮酸的途径。
3 讨论
本研究通过在E.coli BL21(DE3)中异源表达ARO10 基因,获得了可以合成酪醇的重组大肠杆菌。通过删除旁路代谢途径及对培养条件优化,利用10 g/L 葡萄糖作为碳源,发酵48 h 酪醇产量可达4.15 mmol/L。Yasuharu Satoh 通 过 在E.coli MG1655 中异源表达TYO 及TDC 基因,重组菌利用10 g/L 葡萄糖作为碳源,摇瓶发酵48 h,酪醇产量可达0.5 mmol/L[1]。文献[11]通过在E.coli MG1655中异源表达ARO10 基因,并对代谢途径进行了改造,利用20 g/L 葡萄糖作为碳源,酪醇产量可达5.4 mmol/L。与之相比,本研究仅对酪氨酸合成途径上的个别基因进行改造,重组菌合成酪醇的能力还有进一步的提升空间。本研究中ARO10 基因来源于酿酒酵母,在大肠杆菌的表达效率相对较低。下一步将对ARO10 基因进行密码子优化,进一步改善酪醇的合成能力。
由于大肠杆菌体内酪醇的前体物质4-羟基苯丙酮酸合成途径较长[15],对于增强酪醇的合成能力,在未来还有很多研究要做。由酪醇的代谢途径可知(图1),4-羟基苯丙酮酸也是合成酪氨酸的前体物质,下一步将采用过量合成酪氨酸的菌株合成酪醇。过去几十年里,有关于过量合成酪氨酸的菌株的研究成一直是研究热点[19-21]。理论推测,利用产10 g/L 酪氨酸的工程化的大肠杆菌可以产酪醇7.6 g/L。这个产量比从橄榄油中提取得到的酪醇产量高3 倍。因此,利用合成酪氨酸能力强的宿主菌以葡萄糖为底物来提高重组菌酪醇的合成能力,将成为下一步的研究重点。
4 结语
在外源添加酪氨酸的发酵培养基中培养合成酪醇,可以改善酪醇的合成能力,推测大肠杆菌体内存在催化酪氨酸合成4-羟基苯丙酮酸的酶。下一步,将进一步探索以酪氨酸为底物的全细胞催化合成酪醇的条件。

