饱和突变提高肌酸酶热稳定性
阮 洁,刘 松,李江华*,堵国成,陈 坚
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
人体内的磷酸肌酸代谢终产物肌酐可以经过肾脏过滤,经由血液进入尿液而排出体外。在肾脏功能或者肌肉功能出现问题时,血清中肌酐含量将从正常的35~150 μM 上升到1 000 μM[1-2]。因此,血清中肌酐含量成为检测肾的重要指标。当前市场上最常用的酶法检测肌酐含量试剂盒主要涉及3 种关键酶,肌酐水解酶、肌酸酶(EC 3.5.3.3,CRE)和肌氨酸氧化酶[3]。其中,CRE 主要用于催化肌酸水解产生尿素和肌氨酸。要制备商品化的且能长久保存的肌酐检测试剂,CRE 的稳定性十分重要。
在酶法测定肌酐含量涉及的3 种酶中,已报道的肌酐酶水解酶和肌氨酸氧化酶较稳定[4-5],而其主要来源于恶臭假单胞菌、节杆菌、产碱杆菌和副球菌[6-9]等的肌酸酶热稳定性皆不理想,文献[6]对Paracoccus sp.strain WB1 CRE 分析发现:CRE 最适反应温度在30~40 ℃,当温度高于45 ℃时,稳定性会显著下降,在55 ℃保温10 min 后残余酶活仅剩10%左右。P.putida NTU-8 CRE[10]与Alcaligenes sp.nov CRE[11]的研究中也具有这一性质。已有研究中关于CRE 稳定性改造的研究较少,文献[12]对来源于P.putida CRE 分子进行了随机突变改造,其中V182I 突变株的Tm提高0.2 ℃。文献[13]通过固定化的方式使得肌酸酶在4 ℃保存200 d 后仍具有较高活性。但若想将CRE 应用于工业大规模生产,CRE的热稳定性还有待进一步提高。
本研究前期来源于Arthrobacter nicotianae 23710 CRE 表达基因与pET-20b(+)相连,并转入Escherichia coli(DE3),获得高效表达重组菌pET-20J[14]。且A.nicotianae 23710 CRE 在45 ℃热稳定性较好、比酶活较高,但仍不能达到工业应用的标准。蛋白质工程能有效改善天然酶的性能,通常蛋白质改造的策略主要包括:DNA shuffling[15],易错PCR[16],体外随机重组、定点突变[17]等。本研究拟结合同源序列比对与计算机同源建模确定改造位点,对A.nicotianae 23710 CRE 的进行饱和突变,得到热稳定性显著提高的CRE 突变体,为分子改造提高CRE 稳定性研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 本研究前期构建保存的表达质粒pET-20J,用于表达CRE。E.coli BL21(DE3)和E.coli JM109 来自Qiagen 公司(美国)。
1.1.2 主要试剂 限制性内切酶Nde I、Xho I、Dpn I 均购自Thermo 公司。Primer star DNA 聚合酶、感受态制备试剂盒、柱回收试剂盒均购与TaKaRa 公司。异丙基-β-D 硫代半乳糖苷(IPTG)、质粒提取试剂盒与氨苄青霉素均购自上海生工生物工程股份有限公司。
1.1.3 培养基 种子培养基(LB):酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L;发酵培养基(TB):酵母粉24 g/L,胰蛋白胨12 g/L,甘油10 g/L,K2HPO416.43 g/L,KH2PO42.32 g/L,(pH 7.0)。
1.2 方法
1.2.1 CRE 突变体的构建 以前期实验室保存的pET-20J 质粒为模板[14],设计两条引物(见附表1),利用突变引物通过重叠延伸PCR 引进突变点。将相应的重叠延伸PCR 产物Dpn I 消化2 h,除去模板质粒后进行柱回收并转入感受态E.coli JM109 中,挑取单菌落培养并提质粒测序。将正确突变质粒利用化学法转入E.coli BL21(DE3)感受态细胞中进行表达。实验所需的突变引物均由上海生工合成。

表1 K195 位点饱和突变引物Table 1 Saturation mutagenesis-primer of K195 site

续表1
1.2.2 CRE 突变体的表达 将突变体质粒转入E.coli BL21(DE3)得到表达CRE 的突变菌株。挑取单个菌落至LB 培养基(含100 μg/mL 的氨苄抗生素)中,于37 ℃、220 r/min 摇床振荡培养8 h。之后将种子液以体积比为3%的接种量接入TB 培养基,于37℃、220 r/min 摇床振荡培养至菌浓OD600=3,并加入终浓度为0.6 mmol/L 的IPTG 诱导,于30 ℃、220 r/min 摇床振荡培养10 h。
1.2.3 CRE 突变体的纯化 将突变菌株的发酵液经过超声破碎,在低温下12 000 r/min 离心10 min后收集上清液。在冰浴条件下将上清液进行逐级硫酸铵沉淀,离心收集沉淀。向获得的沉淀中加入少量的磷酸缓冲液(0.05 mol/L NaH2PO4及0.05 mol/L Na2HPO4混合液,pH=7.0)以溶解沉淀,装入透析袋(截留分子量为10 kDa)后在同样的磷酸缓冲液中透析24 h。透析后,透析除盐后用微孔滤膜(0.25 μm)去除酶液中的杂质,利用阴离子交换柱(HiPrep 16/10 Q-XL)进行蛋白纯化。上样缓冲液(A 液)为50 mmol/L 的磷酸缓冲液,而洗脱缓冲液(B 液)为加有1 mol/L NaCl 的磷酸缓冲液(50 mmol/L)。
1.2.4 CRE 的酶活测定 在试管中加入0.1 mol/L肌酸溶液900 μL,在室温条件下平衡5 min 后加入待测酶液100 μL,于37 ℃反应10 min 后加入2 mL终止剂终止反应,并置于25 ℃温育20 min,在435 nm 处测定吸光度值。空白管是在肌酸溶液中先加入对-二甲氨基苯甲醛,后加入待测酶液,其他步骤与测定管一致。终止剂为对二甲氨基苯甲醛溶液:2 g 对-二甲氨基苯甲醛固体粉末溶于100 mL 二甲亚砜溶液中,待完全溶解后加入15 mL 浓盐酸。
单位酶活定义为单位时间内将肌酸水解产生1 μmol 尿素所需要的酶量。计算如下

式中:V样为反应体系中酶液体系;V总为反应总体积;ε 为毫摩尔吸光系数;t 为反应时间。
1.2.5 酶学参数的测定 半衰期检测(t1/2,min):将纯化后的突变CRE 稀释到同一浓度,放置于50 ℃水浴保温25 min,其中每隔3 min 取样并按照1.2.4节方法测定CRE 的残余酶活,确定蛋白的半衰期。
Km和kcat测定:配制不同浓度的肌酸溶液(0~120 mmol/L),加入过量的酶液,按照1.2.4 测定酶活力,并用GraphPad Prism 5 软件(GraphPad Software)计算。
1.2.6 软件分析 利用在线服务器SWISS-MODEL(http://swissmodel.expasy.org/),以PDB 数据1CHM[18]晶体结构为模板,同源模拟A.nicotianae 23710 CRE 晶体结构。CRE 晶体结构由软件Discovery studio 4.1 分析。
2 结果与讨论
2.1 CRE 饱和突变位点的选择及构建
随机突变的结果显示,V182 突变为异亮氨酸使P.putida CRE 的Tm提高0.2 ℃[12],表明V182 对与P.putida CRE 热稳定性有重要影响。氨基酸序列比对 显 示,A.nicotianae 23710 与P.putida 来 源 的CRE 同源性达到62%。以P.putida 晶体结构(PDB ID.1CHM)为模板,通过SWISS-MODEL 在线服务器构建得到A.nicotianae CRE 的模拟结构。通过一级及二级序列比对发现,V182 位点对应于A.nicotianae CRE 的K195 位点,两位点同处于α 螺旋(图1)。因此,为研究K195 对A.nicotianae CRE 热稳定性的影响,对此K195 进行饱和突变。

图1 CRE 序列比对Fig.1 CRE secondary sequence alignment
2.2 CRE的表达及酶学性质分析
以pET-20J 质粒为模板,设计两条含突变点的引物,利用突变引物通过重叠延伸PCR 引进突变点。将测序正确的转化子转入E.coli BL21(DE3)中,用于发酵表达CRE 突变体。发酵结束后收集菌体,测定胞内上清中CRE 的热稳定性。如图2(a)所示,相同条件下,突变体的粗酶液在45 ℃保温30 min 后,CRE 突 变 体K195V、K195T、K195C 和K195L 较野生酶(WT)热稳定性明显提高。通过硫酸铵沉淀及阴离子柱纯化得到K195V、K195T、K195C 和K195L 纯酶液(图2(b)),进一步分析其酶学性质。
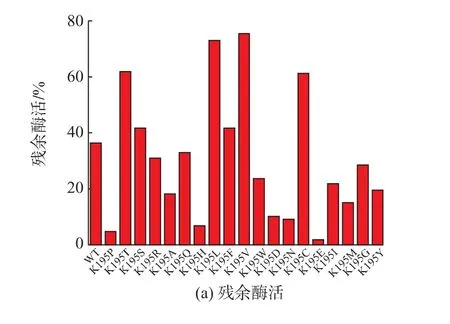

图2 粗酶液中CRE 及其突变体的热稳定性及优势突变体纯化蛋白的电泳分析Fig.2 Crude enzyme thermostability analysis of CRE and its mutants;SDS-PAGE analysis of CRE and its positive mutants
与野生酶相比,突变体K195V、K195T、K195C和K195L 的t1/2(50 ℃)分别提高260%、230%、60%和20%;其中,K195V 和K195C 的比酶活分别提高了80.7%,88.2%(表2)。突变体中Tm值较WT 增加了4~5.9 ℃;K195V 的Tm达到55.4 ℃。与P.putida CRE 的组合突变体A109V/ V182I/V355M 相比[12],K195V 高0.7 ℃。表明本研究得到的K195V 在稳定性方面更具有优势。
此外,部分突变体的Km值较突变前降低,其中K195C 突变体的Km值降低幅度较大,降低了28%,与报道的A.nicotianae 02181[19]来源CRE 基本一致。突变体K195V、K195T、K195C 和K195L 的kcat/Km值与野生型相比,分别提高了131%、218%、83%和100%。表明,K195 对CRE 底物亲和力及酶催化速率有较大影响。

表2 突变体的酶学性质Table 2 Kinetic constants of CRE
2.3 K195 突变体的稳定化机制分析
研究表明,蛋白质分子的热稳定性、催化活性的变化与蛋白质分子间作用力的种类和数量有关[20]。为分析突变体热稳定性提高的原因,构建了A.nicotianae CRE 结构模型并用在线软件 Protein Interaction calculator(http://pic.mbu.iisc.ernet.in/job.html)分析CRE 分子间作用力的变化。如表3 所示,突变体K195V、K195T、K195L 较WT 分别增加2、3、4 个疏水作用力。研究表明,疏水作用力是影响蛋白稳定性的重要因素,降低蛋白表面的疏水性或者增强分子内部的疏水性有利于蛋白质的稳定[21-22]。因此,疏水作用力的增加极有可能是CRE 热稳定性提高的一个原因。此外,突变体K195V、K195T、K195L 较WT 分别增加了7、12、13 个氢键。文献[23]研究表明增加一个氢键可提供0.6 kcal·mol-1的能量,且氢键增加是酶分子稳定性增加的重要原因之一[24]。因此,氢键的增加可能是CRE 热稳定性提高的重要原因。

表3 突变前后CRE 作用力变化Table 3 Interactions potentially involved in the stability of wild-type and mutants
运用软件Discovery studio 4.1 对CRE 的活性位点及催化区域分析发现:突变体K195T 的活性位点Phe 72、Arg 74、His 663、Glu 693、Glu 789、Arg 766 与周围氨基酸形成的氢键较WT 有所增加。如图3 所示,在K195T 中,Arg 74 与Thr 71 形成2 个氢键,且Arg 766 与催化区域形成的氢键由原来的2 个增至4 个。据报道,氢键对于在高温条件下维持酶的稳定性具有重要作用[25]。文献[26]研究中表明,增加分子间的作用力特别是主链氢键的增加有利于酶的稳定,且增强活性位点的刚性有利于酶的催化。文献[27]的研究中也表明了这一观点。因此,氢键的增加极有可能是K195T 催化效率提高及热稳定性提高的重要因素。

图3 突变体形成新的氢键作用分布情况Fig.3 Hydrogen binding network newly formed of mutants
3 结语
通过饱和突变的方法,确定了K195 位点为提高肌酸酶热稳定性的重要位点,构建的K195V、K195T、K195C 和K195L 突变体的半衰期较野生型分提高260%、230%、60%和20%。其中,K195V 和K195C 的比酶活分别提高了80.7%,88.2%。获得高热稳定性及高催化活性的CRE 突变体将有助于其工业化应用。
——以高中化学“氢键”的教学为例

