负载光敏剂D-甘露糖修饰胶束的制备及其在靶向光动力治疗中的应用
蔡 颖,王胜涛,魏 朋,张 权,尹 健*
(1.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
光动力疗法(Photodynamic Therapy,PDT)是治疗肿瘤疾病的一种非侵入性新技术[1-2]。这种治疗策略主要依赖于单线态氧(1O2)的产生[3]:当低暗毒性光敏药物在肿瘤组织区域富集后,向肿瘤部位给予特定波长的光照,光敏药物吸收特定波长的光跃迁至激发态;此时处于激发态的光敏药物会将能量传递给周围肿瘤组织和细胞中的基态氧,产生活性很强的单线态氧,单线态氧和相邻的生物大分子发生氧化反应,产生细胞毒性作用进而导致细胞受损和死亡[4-5]。
目前,用于光动力疗法的光敏剂种类已经被广泛开发,主要包括卟啉、二氢卟酚、酞菁、氟硼二吡咯(简称BODIPY)等[6-7]。这些光敏剂具有高荧光量子产率、高光稳定性、良好化学稳定性和易于化学修饰等性质,但其在水中溶解性较差,而且缺乏对肿瘤细胞的靶向性[8-9],因此严重制约了其在光动力疗法临床上的应用。近年来,已有许多报道利用新型靶向输送系统在改善光敏剂性能方面取得了很大的进步,但仍需进一步开发安全高效的新型输送载体材料用于靶向光动力治疗研究。
胶束是一类药物输送系统。具有良好生物相容性的两亲性大分子能在水中自组装形成胶束[10]。对疏水性的光敏剂进行亲水性修饰,或以包载的形式构建成具有光敏特性的胶束,可以满足光动力治疗的要求。同时,由于肿瘤区域增强渗透与滞留(EPR)效应[11]的存在,通过构建适宜粒径的具光敏特性的胶束可以实现很好的被动靶向作用,进一步提高光动力治疗的效率,减少对正常细胞的毒副作用。但仅依靠EPR 作用不足以实现对癌细胞选择性光动力治疗;通常采用对光敏剂修饰靶向性分子或用具有靶向性的胶束包载光敏剂的方式,实现靶向光动力治疗的目的。由于癌组织区域细胞的特殊的生长性质,其会在细胞膜表面过度表达多种靶向受体;而一些功能性靶向分子,例如透明质酸[12]、抗体[13]、多肽[14]、叶酸[15]等,能特异型识别这些受体,所以表面修饰有靶向分子的胶束能被癌细胞通过受体介导识别方式大量摄取,从而达到靶向输送光敏剂进行光动力治疗的目的,降低光动力治疗对正常细胞的毒性。
甘露糖作为一类靶向性小分子已被应用于靶向药物输送的研究中[16]。近年来,已有研究表明修饰有甘露糖的纳米载体能够特异性识别甘露糖受体[17],而达到靶向给药的目的;但利用甘露糖的靶向作用,实现选择性光动力治疗的研究鲜有报道。本文以D-甘露糖修饰的两亲性β-环糊精(β-CD)制备胶束,另外合成金刚烷(Ad)修饰的BODIPY 光敏剂分子,利用β-CD 与Ad 之间主客体识别[18]原理制备高负载光敏剂的胶束,考察其理化性质和光动力治疗性能。以表面甘露糖受体高表达的人乳腺癌细胞MDA-MB-231 作为细胞模型,考察了负载光敏剂聚合物胶束通过甘露糖受体识别作用被MDA-MB-231 癌细胞摄入并用于靶向光动力治疗的性能。
1 材料与方法
1.1 主要试剂
1-金刚烷甲酸(99%)、2-(2-氨基乙氧基)乙醇(99%)、对甲苯磺酰氯(TsCl,99%)、2,4-二甲基吡咯(97%)、N-碘代丁二酰亚胺(NIS,99%)、2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ,98%)、对甲基苯磺酸(98%)、三氟甲磺酸三甲基硅酯(TMSOTf,99%)、3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四氮唑鎓溴化物(MTT,98%)、(+)-L-抗坏血酸钠(99%)、五水硫酸铜(CuSO4·5H2O,98%)、炔丙醇(99%)均于百灵威科技有限公司购买;9,10-蒽基-双(亚甲基)二丙二酸(ABDA)、4’,6-二脒基-2’-苯基吲哚(DAPI)购于sigma 试剂有限公司;D-甘露糖(D-Mannose,分析纯)、β-环糊精(β-CD,98%)购于国药集团化学试剂有限公司。
1.2 主要仪器
AVANCE 400M 型核磁共振仪,德国Bruker 公司生产;荧光分光光度计,美国Agilent 公司生产;Nano ZS 动态光散射仪(DLS),英国Malvern 公司生产;UV-3 900 紫外可见分光光度计,日本日立公司生产;JEM-2 100 透射电子显微镜(TEM),日本电子株式会社生产;激光共聚焦显微镜(CLSM),日本尼康株式会社生产;Enspire 多标记检测系统,美国PerkinElmer 公司生产。
1.3 D-甘露糖修饰的两亲性β-CD(C3-CDMan7)与光敏剂BTA 的合成
D-甘露糖修饰的丙酰化环糊精分子C3-CDMan7的化学合成方法参照文献[19]。共价键连金刚烷(Ad)的BODIPY 光敏剂分子(BTA)的合成方法参照文献[20]。
1.4 负载光敏剂BTA 胶束(BTA@C3-CD-Man7)的制备
采用透析冻干法制备高负载光敏剂胶束BTA@C3-CD-Man7。准确称取C3-CD-Man7(150 mg,41.44 μmol)和光敏剂BTA(12 mg,7.75 μmol);用3 mL DMSO 溶解C3-CD-Man7,室温下搅拌2 h,制得溶液①;另用3 mL DMSO 溶解BTA,室温下搅拌2 h,制得溶液②。然后将溶液②加入溶液①,再在室温下搅拌2 h,获得混合溶液。再向上述混合溶液中,缓慢滴加20 mL DD H2O,并于室温下搅拌30 min。然后将制备的BTA@C3-CD-Man7溶液转移到透析袋(MW 2 000)中透析2 d,每6 h 换一次水,除去DMSO。冷冻干燥所获澄清绿色溶液,获得BTA@C3-CD-Man7粉末。
1.5 胶束的TEM 与DLS 表征
对于TEM 样品的制备,分别称取C3-CD-Man7和BTA@C3-CD-Man7并配制两种胶束的水溶液(1 mg/mL);各取50 μL 上述溶液,滴加于电镜铜网上,并对胶束C3-CD-Man7的铜网用磷钨酸复染处理,待两种TEM 样品晾干后,于电镜下进行观察。对于DLS 样品的制备,分别配制浓度为200 μg/mL C3-CD-Man7和BTA@C3-CD-Man7的10%胎牛血清培养液,并各取上述溶液1 mL,通过DLS 在25°C 条件下测定其流体力学直径。
1.6 BTA@C3-CD-Man7中BTA 含量的测定
BTA@C3-CD-Man7中负载光敏剂BTA 的质量百分比通过紫外可见分光光度计(UV-3 900)进行准确测定。分别配制光敏剂BTA 的DMSO 溶液(1 mg/mL)和BTA@C3-CD-Man7的DMSO 溶液(1 mg/mL)待用。称取BTA 固体粉末,并配制浓度为5、10、15、20、25、30 μg/mL 的系列溶液,利用紫外可见分光光度计对BTA 在300~800 nm 波段内进行全波长扫描,测定其在最大吸收665 nm 处的吸光度。以吸光度A 与质量浓度c 作图,制作光敏剂BTA 的标准工作曲线,计算出BTA 的质量浓度与吸光度之间的线性关系,进而测定BTA@C3-CD-Man7中BTA 的百分含量。
1.7 BTA@C3-CD-Man7产单线态氧性能的测定
单线态氧捕获剂ABDA 能被氧化导致荧光强度降低,从而表征负载光敏剂的胶束产单线态氧的性能[21]。准确称取两份1 mg ABDA,分别用DMSO、DD H2O 溶解,配制成两种1 mg/mL 母液待用;再配制1 mg/mL BTA@C3-CD-Man7水溶液。通过荧光分光光度计测定,选取终质量浓度为0.5 μg/mL 的ABDA 溶液为宜。然后分别配制四种溶液:0.5 μg/mL ABDA 的水溶液、0.5 μg/mL ABDA 的DMSO 溶液,0.5 μg/mL ABDA+0.04 mg/mL BTA@C3-CD-Man7的水溶液和其DMSO 溶液。用LED 光源(665 nm,20 mW/cm2)分别对上述溶液进行10、20、30、40 min照射,在激发波长为380 nm 的条件下,分别测定上述各溶液在荧光波段(390~500 nm)处的荧光光谱。
1.8 甘露糖受体介导的细胞内吞
将人乳腺癌细胞MDA-MB-231 接种于细胞培养皿内,置于37 ℃、5% CO2的培养箱孵育24 h,使其贴壁生长。加入含有BTA@C3-CD-Man7(160 μg/mL)的培养液继续培养24 h。弃去培养液,用pH 7.4磷酸盐缓冲液(PBS)清洗2 次。将癌细胞用4.0% 甲醛在室温下固定15 min 后,移除甲醛溶液,1 mL PBS 清洗2 次,再用4’,6-二脒基-2’-苯基吲哚(DAPI,1 μg/mL)对细胞核进行染色15 min[22],最后用PBS 溶液清洗2 次。利用激光共聚焦显微镜(CLSM)观察BTA@C3-CD-Man7在细胞内部的分布状态(激发波长:408/561 nm;发射波长:417~477/570~1 000 nm)。
1.9 小分子甘露糖竞争性实验
与上述细胞摄取实验相似,先将MDA-MB-231癌细胞接种于细胞培养皿内,让其贴壁生长24 h。然后再加入含过量小分子甘露糖的新鲜培养液继续于孵育箱中培养4 h。移除旧的培养基,加入含有BTA@C3-CD-Man7(160 μg/mL)的培养液继续培养24 h。弃去培养液,用pH 7.4 的磷酸盐缓冲液(PBS)清洗2 次。对细胞样依次经4.0%甲醛固定,DAPI 染色15 min,PBS 缓冲液清洗处理。最后,利用激光共聚焦显微镜(CLSM)观察BTA@C3-CD-Man7被癌细胞吸收的情况(激发波长:408/561 nm;发射波长:417~477/570~1 000 nm)。
2.0 细胞毒性评价
采用MTT 法对空白胶束和负载光敏剂胶束的光暗细胞毒性进行评价[23]。将人乳腺癌细胞MDAMB-231 种植于96 孔板内,每孔约10 000 个细胞。在37 ℃、5% CO2的培养箱中孵育细胞24 h 后,加入含BTA@C3-CD-Man7或C3-CD-Man7的10%胎牛血清培养基,确定体系中所含光敏剂BTA 的质量浓度为20 μg/mL,继续于孵育箱中培养一段时间。待24 h 后,分别进行665 nm LED 光源照射30 min和黑暗环境处理后,移除培养液,用pH 7.4 的PBS缓冲溶液清洗2 次,每孔中加入100 μL MTT 培养液(0.5 mg/mL)继续培养4 h。移除每个孔内MTT 培养液,再加入100 μL DMSO,振荡10 min,用多功能酶标仪测量490 nm 处各孔的吸光值(OD),计算细胞存活率。
2 结果与分析
2.1 BTA@C3-CD-Man7的设计制备及其光动力治疗策略
通过β-CD 和金刚烷超分子识别作用将甘露糖功能化β-CD 固定到光敏剂纳米聚集体表面,从而制备了表面甘露糖功能修饰的光敏剂纳米粒子[20]。然而由于上述研究的纳米粒子在水溶液中的长期稳定性较差,因此需要进一步开发具有高稳定性的负载光敏剂输送载体材料。为了实现这一目标,本研究希望通过C3-CD-Man7自组装形成胶束,同时包载BTA 进入胶束的疏水性空腔,从而提高负载BTA 胶束的稳定性,并将其应用于靶向光动力治疗的研究中。
通过透析冻干法制得新型负载光敏剂胶束BTA@C3-CD-Man7,并将其应用于靶向光动力治疗人乳腺癌细胞MDA-MB-231 的研究中。如图1 所示,将所获具有靶向作用的BTA@C3-CD-Man7与MDA-MB-231 癌细胞共培养。利用甘露糖受体识别介导光敏剂BTA 被癌细胞内吞,并在665 nm LED灯照射下诱导胞质内的基态氧产生单线态氧,进而氧化杀伤癌细胞;这里细胞中基态氧主要以三线态氧(3O2)形式存在。

图1 BTA@C3-CD-Man7的结构及其应用于靶向光动力治疗的示意Fig.1 Schematic illustration of BTA@C3-CD-Man7for targeted PDT
2.2 胶束的DLS 与TEM 表征
优良的两亲性纳米载体需具有良好的结构外形和稳定性。通过TEM 观察胶束的形貌和粒径,用DLS 测定胶束的水合粒径分布以及一段时间内在生物溶剂中的稳定性,结果见图2。根据TEM 与DLS 的结果,空白胶束C3-CD-Man7在负载光敏剂BTA 后,平均粒径明显增大。由于在溶液中胶束表面会形成水合层,其流体力学粒径明显大于TEM测得的真实粒径,对比空白胶束的TEM 和DLS 的结果可知,其由TEM 测得真实直径30 nm 左右变为DLS 测得的流体力学直径110 nm 左右(图2(a)和图2(c));负载光敏剂胶束BTA@C3-CD-Man7也呈现类似的结果(图2(b))。而图2(c)则表示两种胶束的动态光散射实验结果,其中C3-CD-Man7的PDI 值 为0.210,BTA@C3-CD-Man7的PDI 值 为0.291,这表明两者均一性较好。另外,选取3 d 来考察空白胶束C3-CD-Man7以及负载光敏剂胶束BTA@C3-CD-Man7在含10%胎牛血清的培养基中稳定性,一般3 d 是药剂在生物体内循环作用的时间;从图2(d)中则可以看出,在培养基中两种胶束流体力学直径波动较小,在这段时间内胶束的整体结构较稳定,满足光动力治疗的要求。

图2 C3-CD-Man7和BTA@C3-CD-Man7的透射电镜照片,水溶液中的流体力学直径分布图以及在10%胎牛血清培养基中的长期稳定性Fig.2 TEM images,hydrodynamic size distributions in water and long-term colloidal stability in culture medium with 10% FBS of the micelles
2.3 BTA@C3-CD-Man7中BTA 含量的测定
胶束仅作为输送载体,介导光敏剂在肿瘤组织中富集并用于光动力治疗时需明确光敏剂的量。通过紫外分光光度计分别测定一系列浓度下光敏剂BTA 在最大吸收665 nm 处的最大吸光度,制定出BTA 的标准工作曲线,从而表征BTA 浓度与吸光度之间的线性关系。结果如图3 所示:从图3(a)中可以明显看出不同浓度下BTA 在665 nm 处均有最大吸光度;进而绘制其标准工作曲线,见图3(b)。这一实验结果表明光敏剂的浓度与其最大吸收处的吸光度两者之间具有良好的线性关系。根据朗伯比尔定律科:
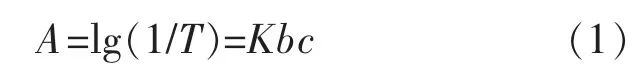
式中:A 为吸光度;T 为透射比;b 为吸收层厚度;c为吸光物质的质量浓度;K 为吸光系数,只与物质本身性质相关。光敏剂BTA 的吸光系数K 为0.048 6。
根据上述测定方法,取负载光敏剂胶束BTA@C3-CD-Man7加入1 mL DMSO 中破坏胶束,测定其吸光度,即可知道胶束中光敏剂BTA 浓度与吸光度之间的关系。通过计算,可知负载光敏剂胶束BTA@C3-CD-Man7中BTA 的质量百分比为14%。另外,本文对末端未共价键连金刚烷的BODIPY 光敏剂,按上述相同的方法制备另一种载光敏剂胶束,并对其确切的包载量进行测定。结果发现其包载率仅为5%左右,这些结果表明由于β-CD 与金刚烷之间的超分子识别作用,由C3-CDMan7自组装形成胶束包载BTA 的能力明显增强。
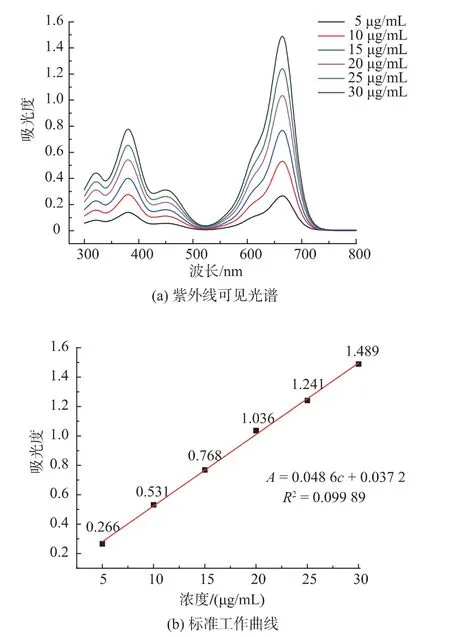
图3 B TA 的紫外可见光谱图和标准工作曲线Fig.3 UV -vis spectrum andthe standard curve of photosensitizer BTA in DMSO
2.4 BTA@C3-CD-Man7产单线态氧的研究
光敏剂产单线态氧(1O2)的能力是衡量其光动力治疗效果的重要指标。光敏剂在特定波长的光照下产生的单线态氧能将其捕获剂ABDA 氧化,进而导致ABDA 在其特征吸收光带(390~500 nm)处荧光强度降低,通过这种方式间接地表征单线态氧的产生。
实验结果如图4 所示:在有机溶剂DMSO 中在光照条件下下不断产生有单线态氧(1O2)产生,而ABDA 捕获1O2后导致结构改变,荧光猝灭,荧光强度下降,通过连续阶段的光照,ABDA 的荧光强度不断的降低(图4(a));而在去离子水中,即便给予长时间光照,也不能产生单线态氧,故而单线态氧捕获剂ABDA 的荧光强度不变(图4(b))。这一现象主要是由于BTA@C3-CD-Man7在两种溶剂中存在形式的不同引起:其在DMSO 中以分子状态存在,而在水中则以胶束的形式存在。
以上实验证明BTA@C3-CD-Man7以分子状态存在时能够在近红外光照射下不断产生单线态氧,满足光动力治疗杀伤癌细胞的条件。为了考察溶剂因素对实验结果的影响,另做两组空白对照实验验证:①ABDA 的水溶液在连续光照下荧光光谱;②ABDA 的DMSO 溶液在连续光照下荧光光谱。结果表明了单线态氧捕获剂ABDA 在水相或油相中稳定,荧光强度不会改变,也证实了上述实验中ABDA荧光强度的改变仅是光敏剂在起作用。
2.5 甘露糖受体介导的细胞内吞
利用激光共聚焦显微镜(CLSM),考察BTA@C3-CD-Man7经甘露糖受体介导被人乳腺癌细胞MDA-MB-231 内吞的性能,研究甘露糖的靶向作用。BTA@C3-CD-Man7与MDA-MB-231 癌细胞在5% CO2的孵育箱中共培养24 h 后,依次用4%甲醛固定,1 μg/mL DAPI 染色,pH 7.4 PBS 溶液清洗保存,然后使用激光共聚焦显微镜观察。结果见图5,癌细胞的细胞核经过DAPI 染色而呈现蓝色,光敏剂BTA 呈现红色荧光,通过两者叠加图,可以明显地看到BTA 被内吞进入细胞。
由于甘露糖受体介导的细胞内吞,负载光敏剂胶束BTA@C3-CD-Man7具有良好的靶向性。将BTA@C3-CD-Man7与人乳腺癌细胞MDA-MB-231共培养24 h 后,在癌细胞内有大量红色荧光,这些红色荧光是由于BTA@C3-CD-Man7被内吞入细胞后解组装释放BTA 分子所产生的(图5(a))。而通过提前用过量的小分子甘露糖对癌细胞表面的甘露糖受体进行竞争性实验,发现胶束靶向内吞受阻和光敏剂BTA 的内吞量减少,表现为细胞内红色荧光强度明显降低(图5(b))。上述靶向性细胞摄取实验和小分子甘露糖竞争性实验充分证实了甘露糖分子具有良好的靶向作用,也表明了负载光敏剂胶束BTA@C3-CD-Man7能够靶向识别乳腺癌细胞MDA-MB-231 表面的甘露糖受体,并通过受体识别内吞的方式进入癌细胞内,实现了良好的靶向输送光敏药物的目的。
2.6 光动力治疗的细胞评价
细胞水平上的光动力治疗效果,作为衡量光敏剂用于光动力疗法的必要指标。利用激光共聚焦显微镜(CLSM),研究BTA@C3-CD-Man7被内吞进入癌细胞的情况,进而在光动力治疗后对人乳腺癌细胞MDA-MB-231 进行细胞形态观察、评价。
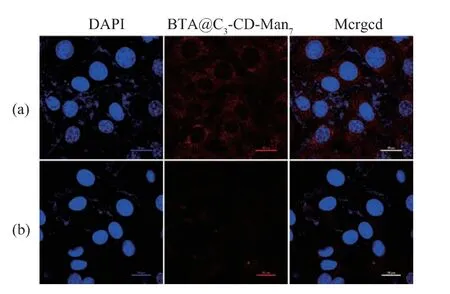
图5 BTA@C3-CD-Man7(160 μg/mL)与癌细胞MDAMB-231 共培养24 h 后分别在无甘露糖环境和有小分子甘露糖竞争下的激光共聚焦显微镜图Fig.5 CLSM images of MDA -MB -231 cancer cells incubated for 24 h with BTA@C3-CD-Man7(160 μg/mL)as indicated
结果如图6 所示:在不对癌细胞给予LED(665 nm,20 mW/cm2)灯照射的条件下,光敏剂不会产生单线态氧而杀伤细胞,此时细胞形态饱满,细胞核圆润,可以清晰地看见细胞整体外形(图6(a));而当对癌细胞给予LED 光照30 min 时,光敏剂BTA将能量转移给胞质中的基态氧而产生单线态氧(1O2),进而杀伤癌细胞,表现为细胞整体形态萎缩,细胞明显变小,细胞核也严重蜷缩变小,出现明显的光动力治疗效果(图6(b))。
实验通过CLSM 直接观察到MDA-MB-231 癌细胞在黑暗环境和给予光照条件下,癌细胞大小与形态以及细胞核大小与形态均出现明显差异。表明BTA@C3-CD-Man7在体外细胞水平上有明显的光动力治疗效果,初步满足光敏剂用于光动力治疗的要求。
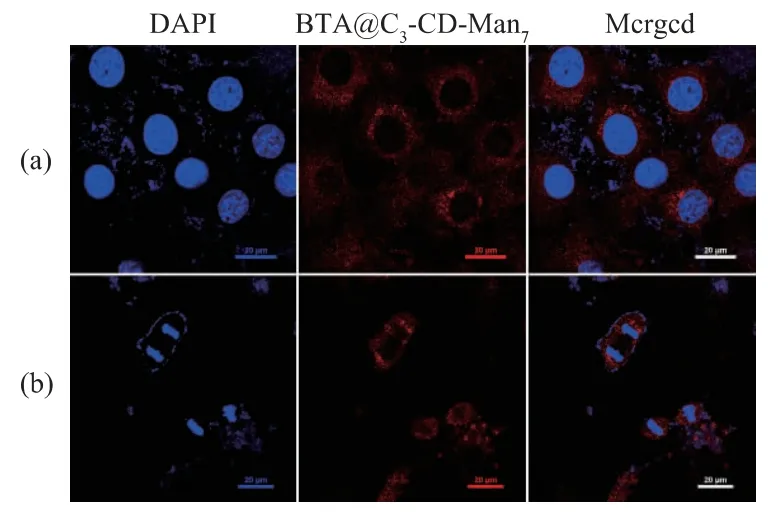
图6 B TA@C3-CD-Man77(160 μg/mL)与癌细胞MDAMB-231 共培养24 h 后在黑暗环境或665 nm LED灯光照30 min 条件下的激光共聚焦显微镜图Fig.6 CLSM images about PDT of MDA -MB -231 cancer cells incubated with BTA@C3-CD-Man7(160 μg/mL)for 24 h followed
2.7 细胞毒性评价
用于光动力治疗的光敏剂应具有低的暗毒性,以及高的光动力治疗性能[24]。实验采用MTT 法分别考察空白胶束C3-CD-Man7和负载光敏剂BTA 胶束BTA@C3-CD-Man7分别在黑暗和665 nm LED灯光照30 min 条件下对人乳腺癌细胞MDA-MB-231 的毒性,实验结果见图7。
由图7a 可知,随C3-CD-Man7和BTA@C3-CDMan7剂量的增加,在不给予LED 灯光照的黑暗条件下,MDA-MB-231 癌细胞存活率略有降低;当胶束的质量浓度达到200 μg/mL(此时BTA@C3-CDMan7中BTA 的质量浓度约为25 μg/mL)时,细胞存活率仍大于90%。这表明C3-CD-Man7具有良好的生物相容性,是一种优良的靶向输送载体;而且BTA@C3-CD-Man7表现为低暗毒性,满足光敏剂低暗毒性的条件。而由图7(b)可知,将甘露糖受体过度表达的人乳腺癌细胞MDA-MB-231 分别与相同剂量的两种胶束共同孵育后,在665 nm LED 光照条件下,癌细胞存活率表现出明显差异;孵育有BTA@C3-CD-Man7的癌细胞存活率大大降低,当其浓度达到200 μg/mL 时,细胞存活率仅为7%,表现出极高的光疗效果;而LED 灯光照对孵育有C3-CD-Man7的癌细胞几乎无毒副作用。
由于BTA@C3-CD-Man7能通过甘露糖受体介导的内吞作用将光敏剂BTA 输送进入癌细胞内,在特定波长(665 nm)光照下,BTA 能大量诱导单线态氧的产生,进而杀伤癌细胞,表现出优良的光动力治疗性能。因此,BTA@C3-CD-Man7是一种优良的光动力治疗材料,可以靶向性地光动力治疗人乳腺癌MDA-MB-231 细胞。
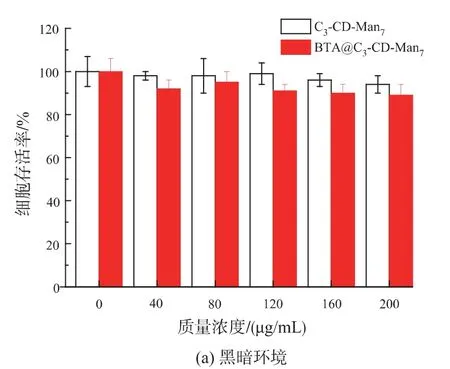
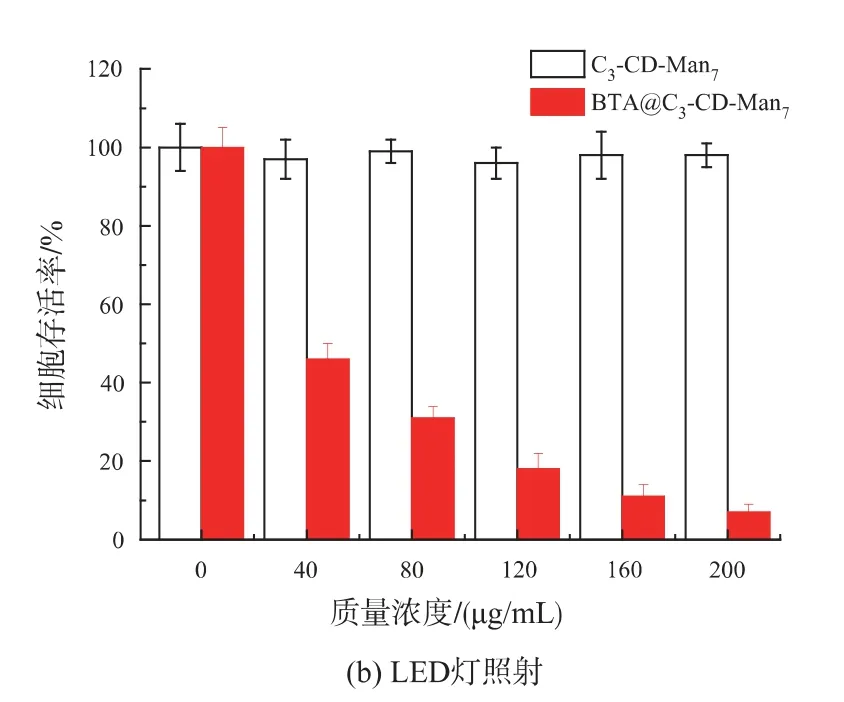
图7 C3-CD-Man7和BTA@C3-CD-Man7分别与MDAMB-231 癌细胞共培养24 h 后黑暗环境或665 nm LED 灯照射30 min 的细胞存活率(n=6)Fig.7 Viability of MDA-MB-231 cells after 24 h of incubation with C3-CD-Man7or BTA@C3-CDMan7at different doses followed byincubation in the dark or irradiation with LED light for 30 min(n=6)
3 结语
借助具有良好生物相容性的药物输送载体,靶向性地将用于光动力治疗的光敏剂输送进入到肿瘤细胞中,减少其在正常组织和细胞中的分布,可以提高光动力治疗效率,同时降低毒副作用。本研究利用β-CD 与Ad 之间主客体识别原理制备BTA@C3-CD-Man7,其负载BTA 的量明显提高,并将BTA@C3-CD-Man7应用于人乳腺癌MDA-MB-231 细胞的光动力治疗,考察其用于光动力治疗的性能。结果显示,BTA@C3-CD-Man7能与MDA-MB-231 癌细胞表面的甘露糖受体特异性识别,而被人乳腺癌细胞MDA-MB-231 大量摄入并释放BTA,在665 nm LED 光照下,表现出对乳腺癌细胞的靶向光动力治疗效果。因此,利用甘露糖的靶向作用以及环糊精与金刚烷的特异识别作用,新型高负载BTA 胶束BTA@C3-CD-Man7在乳腺癌的光动力治疗中具有极大的应用潜力。

