精子鞭毛缺陷导致弱精子症的研究进展
余 怡 王家雄 综述 杨慎敏 审校
南京医科大学附属苏州医院生殖遗传中心(江苏苏州 215002)
全世界目前约有8%~15%的夫妇婚后一年不育,其中男性因素导致的不育占到所有病例的50%。另外,弱精子症也是导致男性不育的一个重要因素,弱精子症的精子总数和浓度正常,但前向运动精子<32%或精子总活力<40%[1]。
部分弱精子症与精子尾部特异性的超微结构异常有关,如原发性纤毛运动障碍(primary ciliary dyskinesia, PCD)、精子鞭毛多发形态异常(multiple morphological abnormalities of the sperm flagella,MMAF)和常染色体显性多囊肾病(autosomal dominant polycystic kidney disease, ADPKD)等,它们与弱精子症的关系越来越受到学者的关注。临床上,与遗传缺陷有关的弱精子症采取经验性治疗往往收效甚微。光镜下的精子形态学分析和透射电镜观察能够甄别由于精子鞭毛畸形导致的精子运动障碍,为诊断和治疗提供重要依据。而该类患者的生育结局也是目前关注的重点。
一、弱精子症的部分病因
(一)精子鞭毛的超微结构概述
精子尾部又称鞭毛,长径约55μm,超微结构分4个部分:颈、中、主、末段。各段组成由内向外一般为轴丝、外周致密纤维、线粒体鞘和细胞膜。正常精子轴丝由中央两根单独的微管与周边9对双联微管组成,称9+2结构。动力蛋白臂存在着ATP酶,为A管与B管的滑动提供能量,带动鞭毛的运动。线粒体鞘螺旋盘绕在精子中段,参与能量代谢。这些结构中,主段最长,约50μm,但该段不含线粒体鞘。主段外周致密纤维周围有纤维鞘包绕,内有糖酵解酶,与精子能量的产生有关[2,3]。具体结构示意如图1。
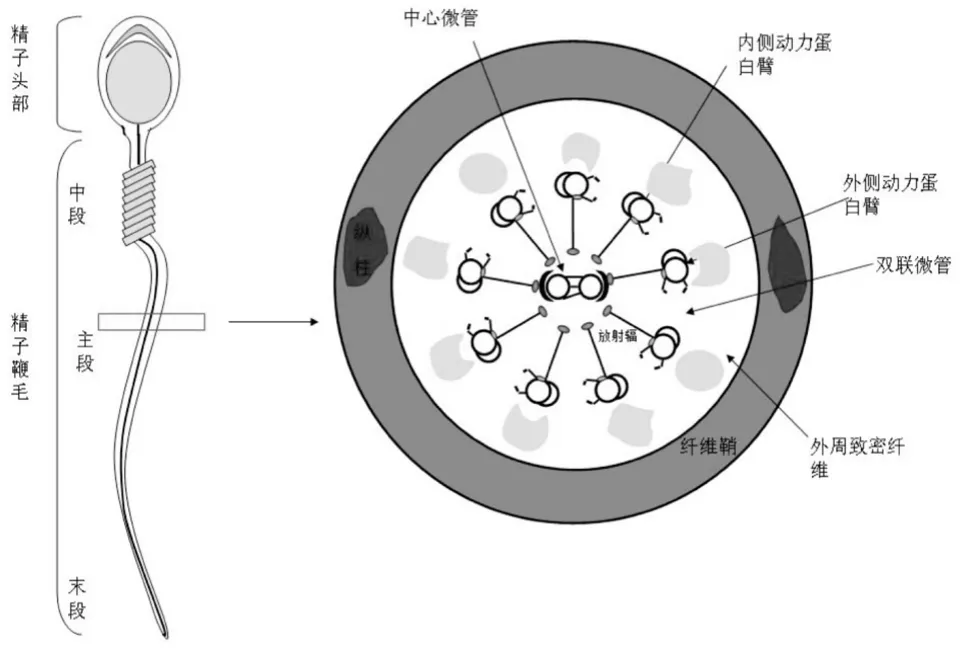
图1 正常精子鞭毛横截面结构示意图[3]
(二)纤毛/鞭毛缺陷导致的弱精子症
1. 原发性纤毛运动障碍(PCD):哺乳动物的纤毛种类包括初级纤毛与运动纤毛两大类,纤毛主要由纤毛膜、基质、轴丝三部分组成,当动力蛋白臂不能参与纤毛与鞭毛轴丝的组装时即引起PCD[2]。PCD主要表现为呼吸道症状,如慢性中耳炎、鼻窦炎、支气管扩张和肺部感染等,内脏反位(Kartagener综合征)、脑积水等,部分男性因精子受累而导致弱精子症和不育[4]。PCD患者呼吸道纤毛透射电镜下的超微改变主要为外侧动力蛋白臂或内侧动力蛋白臂缺陷等,少数患者纤毛超微结构未发现异常[4]。PCD的超微结构缺陷除动力蛋白臂外,还包括中心复合体(central complex,CC)的结构缺陷[5]。目前已经发现超过30个基因与PCD的发生有关,其编码的蛋白主要影响纤毛动力蛋白臂、轴丝、内部细胞骨架的组装[5]。由于运动纤毛和精子鞭毛具有共同的轴丝结构,大多数PCD的男性同时存在不育症[6]。法国的一项多中心多样本研究发现,其统计的49例PCD男性患者中有37例同时伴有不育,不育男性中精子鞭毛超微结构的改变又以内侧动力蛋白臂缺陷与微管结构紊乱最常见,达到43.2%(16/37),其次为内侧、外侧动力蛋白臂结构缺陷共存,比例为24.3%(9/37)[7]。PCD导致的严重弱精子症或100%不活动精子,其精子鞭毛的光镜下形态大致正常,超微结构可见动力蛋白臂缺损[8],但并非所有PCD患者都存在精子鞭毛超微结构异常,部分PCD伴不育的患者透射电镜观察正常[8,9]。
越来越多的PCD致病基因突变被鉴定出,相关蛋白定位于轴丝微管的放射辐头部、动力蛋白臂、中央微管等结构中,基因突变最终导致相关结构组装异常,纤毛/鞭毛运动功能丧失或严重受损[10]。Olcese等[11]研究发现PIH1D3的点突变,是导致早期轴丝动力蛋白臂组装中断的原因之一,P1H1D3蛋白的缺失会影响内侧动力蛋白臂相关结构的组装,从而引起PCD。部分DNAH11基因突变个体的纤毛超微结构在透射电镜下可表现为正常, Shoemark等[12]通过电子断层扫描发现,携带DNAH11突变基因的患者的近侧的外侧动力蛋白臂体积要比正常对照组小,提示DNAH11基因主要影响外侧动力蛋白臂的组装。EL等[13]的研究发现,并非所有的PCD患者均存在纤毛动力蛋白臂的结构缺损,其样本研究发现约有15%的PCD患者动力蛋白臂正常,而表现为中心复合体的结构异常,对其中一位患者测序发现了DNAJB13基因突变,该基因编码热休克蛋白40(heat shock protein40,HSP40),其同源蛋白在鞭毛虫体内定位于放射辐。体外实验发现,该基因突变后,热休克蛋白40家族的保守区域的残端蛋白稳定性下降,同时还诱发了溶酶体的降解,这一结果解释了该患者精子鞭毛动力蛋白臂正常而CC异常的现象。Vanaken等[7]的研究发现,在其研究的PCD伴随不育的病例中,CCDC39、CCDC40基因突变所致的不育比例最高,约为43.2%(16/37),其主要影响内侧动力蛋白臂与微管结构的组装,引起鞭毛活力下降,其余的致病基因包括LLRC6、DNAH11、DNAI1等,其中DNAH11突变的精子鞭毛在透射电镜下并未观察到超微结构的改变。后期Tang等[14]在中国MMAF患者中鉴定出了CCDC39突变,提示CCDC39基因在PCD与MMAF的致病中可能有共同的机制。
2. 精子鞭毛多发形态异常(MMAF):精子鞭毛多发形态异常,也称作精子纤维鞘发育不良。MMAF患者的精液体积和pH值大都在正常范围,但出现严重的精子鞭毛畸形和精子运动障碍。本课题组前期研究发现[15],患者光镜下正常尾部精子仅占0.5%~20.5%,异常尾部表现包括无尾、短尾,尾 部卷曲、弯折、粗细不规则等,其中以短尾最多见,约占40.5%~52%,前向运动精子率0%~3.6%。
透射电镜观察可进一步发现MMAF病变精子超微结构,中心微管缺失是MMAF的特征性表现之一,伴随线粒体鞘缺陷、纤维鞘增厚及动力蛋白臂缺失[15-17]。对MMAF的致病基因的研究近年来得益于测序技术而进展[18]。本课题组通过全外显子组测序的方法鉴定出中国MMAF患者的致病基因DNAH1、CCDC39、CFAP43、CFAP44和CFAP65[14]。其中DNAH1是最为常见的致病基因。DNAH1基因影响精子鞭毛的内侧动力蛋白臂结构,DNAH1敲除后的纯合小鼠表现为精子活动力下降、内侧动力蛋白臂缺失,而外侧动力蛋白臂存在,这与人类DNAH1突变的表型一致[19]。CFAP43和CFAP44等位基因敲除小鼠精子鞭毛表现为短尾、卷曲、缺失,与人类MMAF类似[14,16],Coutton等[16]的进一步研究发现,CFAP43和CFAP44基因主要影响Dnah5、Dnali1、Rsph1、Rsph4、Gas8、Spef2的蛋白合成,而这些蛋白分别是动力蛋白臂、放射辐、nexin链接的组成部分,这为CFAP43和CFAP44基因缺失导致的分子学水平缺陷提供了证据。该课题组还使用布氏锥虫这一模式生物验证了CFAP43、CFAP44蛋白的定位与功能,两者共同定位于PFR(para flagellar rod),该结构类似与哺乳动鞭毛的外周致密蛋白与纤维鞘,连接着双联微管,在鞭毛的运动中起到重要作用[16,20]。CEP135也是中国MMAF的致病基因[21]。Akap4、Tekt3、Tekt4和Cabyr的突变导致小鼠鞭毛的结构缺陷,CatSper1、Pgk2、Gapdhs和Ldhc突变会导致鞭毛的运动功能缺陷[21,22]。SPEF2基因影响精子尾部附属器官如轴丝、外周致密蛋白、线粒体鞘等的正常合成与组装,精子的活力进而受到影响[23,24]。Lorès等[25]的近期研究发现L673P错义突变会引发MMAF与男性不育,暂未发现其能导致PCD。
3. 常染色体显性多囊肾病(ADPKD):常染色体显性多囊肾病是一种遗传疾病,双侧肾脏出现广泛的囊性改变,其发病多出现在成年时期的40岁以后,临床表现为血尿、肾结石、尿路感染、夜尿增多等,疾病的进展往往导致严重的肾功能损伤,发病率约千分之一,其肾脏外表现可累及男性生殖器官,包括睾丸、附睾、精囊和前列腺的囊肿[26]。男性不育患者中伴有ADPKD的病例已被广泛报道[27],但ADPKD导致男性不育的具体机制尚未完全明确,而不仅仅是因为精子超微结构缺陷(动力蛋白臂结构缺陷、微管结构缺失或排列紊乱等)。其产生的机制可能包括:异常的多囊蛋白可能会对精液产生异常,ADPKD患者伴发精囊腺囊肿引起梗阻性少精或无精子症,ADPKD患者发生终末期肾病时导致不育,ADPKD患者精子鞭毛轴丝缺乏中心微管、多胱氨酸缺陷、PKD基因突变和AZF基因微缺失[28-31]。肾脏上皮细胞初级纤毛上有多囊蛋白(polycystin-1、2,PC-1、2)的存在,两者形成受体通道复合物,参与上皮细胞增殖分化的信号调控有关,动物实验发现,编码两种蛋白的PKD基因突变后,肾小管上皮细胞出现了过度增殖、管腔增大的多囊肾病理表现。进一步遗传研究发现,多囊蛋白调节未知的纤毛信号通路(cilia-dependent cyst activation, CDCA),该信号通常是肾单位结构稳态维持的一部分,ADPKD发生是由于完整纤毛缺乏多囊蛋白而失调时发生的,此时CDCA能够驱动囊肿的生长[32],而该通路是否在维持精子鞭毛超微结构稳定中起作用目前依然未知。
A D P K D的发生主要与多囊肾致病基因(polycystic kidney disease gene 1、2,PKD1、2,)有关。GANAB基因,其主要编码葡萄糖苷酶II亚基α(GIIα)对PC-1和PC-2的成熟和表面的纤毛定位是绝对需要的,GANAB基因敲除细胞中可见成熟PC-1减少,因此GANAB是ADPKD候选基因的一个重要补充[33]。
二、精子鞭毛缺陷所致弱精子症的辅助生殖治疗
卵胞浆内单精子注射(intracytoplasmic sperm injection, ICSI)是鞭毛缺陷所致弱精子症的有效助孕手段[30,34]。对于射精中100%无活动精子的情况,低渗肿胀试验、精子鞭毛灵活性测试、激光辅助筛选等技术可以挑选出活精子,采取睾丸精子也不失为一种有效方式[35,36]。PCD伴有不育的患者可通过辅助生殖技术使妻子成功妊娠,妊娠成功率可达到40.5%(15/37)[7]。MMAF患者可以通过ICSI使妻子成功妊娠[37,38],本中心MMAF患者ICSI受精率为51.5%(34/66),短期观察后代未见异常[38]。伴有ADPKD的严重弱精子症患者行ICSI治疗成功受孕的病例早在上世纪九十年代已有报道[30],苏煌等[34]报道的伴有ADPKD的严重弱精子症患者行ICSI治疗结局回顾性分析结果显示15例患者行28个ICSI周期后有10例取得了临床妊娠,但单周期妊娠成功率较低,且子代可能面临一定的遗传学风险,采取胚胎植入前遗传学诊断可以最大程度地降低后代患病的几率,目前已有成功案例报道[39]。
三、展望
对于严重的男性不育,往往存在明确的病理因素,需要仔细了解患者病史,并通过适当的辅助检查明确病因。PCD、MMAF和存在精子鞭毛结构缺陷的ADPKD,用非特异性治疗往往无效,而这些疾病与男性不育的关系以及其在男性不育中的机制依然没有得到深入研究。目前大多认为PCD、MMAF、ADPKD的共同病理机制为纤毛/鞭毛结构异常,但这三者在弱精子症的致病过程中的是否存在交叉因素依然未知。且当今对这三种疾病导致弱精子症的研究多局限于纤毛/鞭毛形态结构与遗传学分析,因此亟需更多研究从精子发生的角度去评判疾病发生的分子机制。日益更新的分子生物学技术将逐步揭示这些疾病发病的分子学机制,同时为选择合适的治疗方式提供理论依据。PCD、MMAF和存在精子鞭毛结构缺陷的多囊肾的弱精子症患者,通常选择ICSI得到受孕,但术前的遗传咨询尤为重要,子代的健康状况需要更多随访。

