先天性双侧无睾症1例报告(附文献复习)
杨文博 兰 轲 马伟国 张晓鹏 刘士军 徐 涛 白文俊*
1. 北京大学人民医院泌尿外科(北京 100044)2. 新疆克拉玛依市中心医院
先天性双侧无睾症(bilateral congenital anorchia,BCA)又被称为胚胎睾丸退化症(embryonic testicular regression),是指睾丸组织完全缺失,而性别分化正常,核型为46, XY[1,2]。BCA部分会有小阴茎或者外生殖器畸形,但青春期前大部分患者相对于同龄人外生殖器正常[3,4]。由于没有前瞻性的研究调查,尚未报告确切的发病率,据估计发病率约为1/20 000,但因为该病常被误诊为隐睾症,实际发病率可能更高,年龄在12个月或以上的隐睾患者中,体检时有五分之一的人被发现性腺无法触及[5-7]。然而关于该病的临床诊断和治疗尚无统一规范。本文结合1例成年未经任何正规治疗的BCA病例并回顾相关文献来探讨BCA的诊断和治疗经验以及研究进展。
资料与方法
患者,男,28岁,因阴囊双侧空虚28年伴阴茎短小就诊我院。患者自出生时阴囊内双侧空虚,未经正规诊治。4年前因包皮过长曾就诊外院行包皮环切术,患者父母非近亲结婚,患者本人经阴道自然分娩,体格检查示身高175 cm,胡须稀少,胸部呈男子乳腺发育,阴茎牵拉长度7.5 cm,外形正常,阴囊内双侧睾丸缺如,双侧腹股沟均未触及异常结构,骨龄检查呈阴性结果。性激素检查结果示黄体生成素20.99 IU/L,卵泡刺激素53.94 IU/L,睾酮2.5 nmol/L。腹盆腔CT扫描示双侧阴囊空虚,双侧腹股沟区及盆腔未见正常形态睾丸显示,双侧腹股沟管内口区0.5cm左右小结节影,考虑隐睾不除外;前列腺及精囊腺体积较小。染色体检查结果示正常核型46, XY。未见Y染色体AZF区域微缺失。
综合患者临床特点、影像学以及其他检查,诊断考虑可能阴囊内双侧睾丸缺如,先天性双侧无睾症,但不排除隐睾(睾丸萎缩),有手术探查指征,故于全麻下腹腔镜探查+双侧腹股沟探查。
结 果
术中未能视及或触及睾丸,仅在左右腹股沟管内精索末端各触及一结节,直径分别约为0.8cm×0.5 cm、0.7cm×0.4 cm,解剖上与血管、输精管等相连,且与周围淋巴结硬度不一致(见图1),将肿物切除后送病理。术后病理示送检组织纤维背景中可见少许导管成分,无明确睾丸组织(见图2)。结合术前资料、手术探查及术后病理结果,确诊为先天性双侧无睾症。患者术后2周开始每日口服十一酸睾酮量120mg,术后随访1个月,患者诉性欲增强,看到色情图片时阴茎可正常勃起。
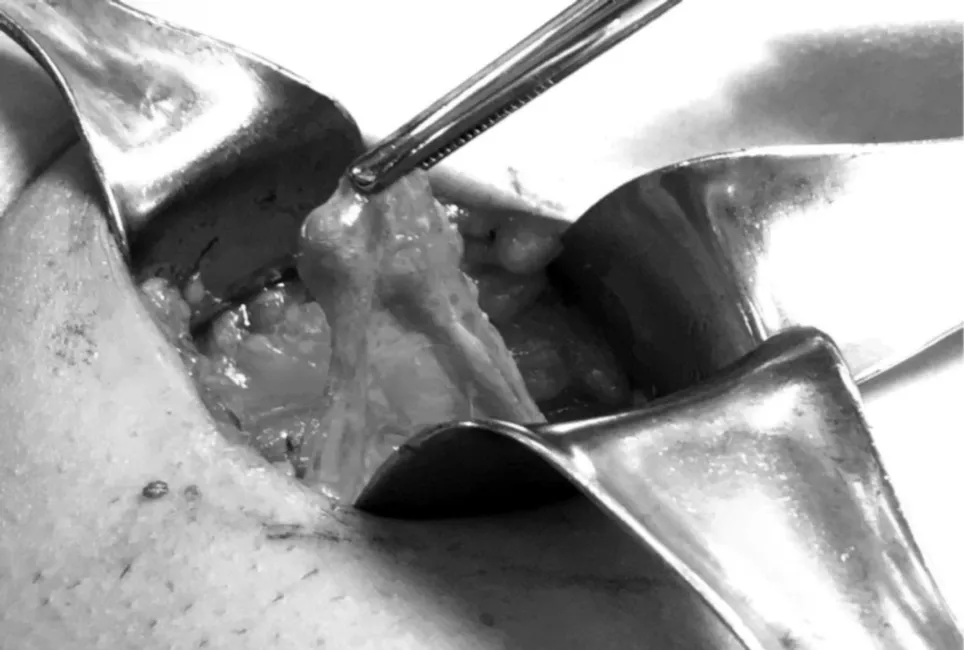
图1 左侧腹股沟内可疑结节(直径约为0.8cm×0.5 cm)

图2 可疑结节病理组织切片(HE染色,×40)A: 左侧; B: 右侧
讨 论
虽然国外报道的BCA症的文献并不少见,但是目前报道的患者往往在青春期前发现并开始规律治疗,青春期后才开始接受规律治疗的患者仅见3例报道,由于青春期前后男性发育和激素水平会有变化,导致未接受治疗的青春期后患者具有不同的临床特点,尤其是相对于同龄人的阴茎长度、性功能等。下面结合文献讨论其临床表现, 影像、 病理特征、鉴别诊断及治疗方法。
一、发病机制
目前机制不清。由于男性生殖道和外生殖器的分化依赖抗苗勒激素(anti-Mullerian hormone,AMH)和睾酮等[8],这表明在性别分化阶段,胚胎存在有分泌功能的睾丸,但是完成性别分化后患儿的睾丸由于某些因素萎缩退化。
男性的Y染色体睾丸决定因子(sex-determining region of Y chromosoine, SRY)决定了胚胎的原始未分化性腺分化为睾丸,但其内外生殖器的进一步分化是受胚胎发育到10~12 周性腺分泌激素控制的[9,10]。在孕10~12周时,胚胎性腺分化。泌尿生殖嵴在SRY以及一系列下游基因的共同作用下,睾丸支持细胞(Sertoli cell, SC)分化形成。性索间隙的间叶干细胞分化形成睾丸间质细胞(Leydig cell,LC)。孕10 周左右 LC 开始分泌胎儿雄性化所需的雄性激素[9]。类固醇生成因子1(SF1)调控睾丸支持细胞分泌AMH,诱导苗勒管退化。人绒毛膜促性腺激素(HCG)控制着LC的分化,并促进胎儿类固醇的生成;在胎儿睾丸雄激素存在的情况下,沃尔夫管持续发育,形成附睾、输精管和精囊。LC 产生的睾酮被类固醇-5α-还原酶(SRD5A)转化为二氢睾酮(DHT),并加速内生殖器的形成,而DHT则决定了男性外生殖器的分化。在DHT的作用下,在12~14周时,生殖结节发育为阴茎,阴唇-阴囊褶皱融合发育为阴囊。这一过程涉及多种激素和因子的自/旁分泌方式调控,如生长因子、GC和雄激素(以睾酮为主)等[11]。本例患者无睾丸组织,而有小阴茎,这提示妊娠12~14 周后,母体体内激素或者基因表达等可能存在异常,导致阴茎分化发育完成后,睾丸退化萎缩。
(一)遗传信息决定理论
虽然国内外学者提出了可能是遗传信息突变导致患者睾丸萎缩退化,但是均未阐明具体的详细机制。有文献报告BCA发病呈家庭式聚集,例如Rai等[12]报告在一个双亲为非近亲结婚的家庭中,兄弟三人均证实为BCA症,这些报告提示先天性双侧无睾症可能和遗传因素有关。然而虽然有很多研究探讨其病因,但是其分子机制并不清楚。根据此前的报道发现SRY在先天性双侧无睾症患者中并未发生突变[13-15]。据报道,核受体亚家族5组A成员1(nuclear receptor subfamily 5 group A member 1, NR5A1)基因突变与许多的表型有关,包括外生殖器两性畸形、无精子症、双侧先天性无睾症[16-18]和女性生殖器。NR5A1基因位于9q33处[19],编码的 SF1 是一种调节肾上腺和性腺发育的蛋白质。SF1可以调节正常生殖生理和内分泌功能所必需的很多基因[20,21]。然而SF1以剂量依赖性的方式发挥生理作用。由于NR5A1拷贝数对其生物学功能很重要,一些文献报道某些密码子的突变导致SF1单倍体功能不全[17]。然而,NR5A1基因是如何导致睾丸萎缩退化,还不清楚。而且,法国的一个研究报道了在24个先天性双侧无睾症患者中只有1个患者检测到NR5A1基因突变[22]。Brauner等[23]检测了26名患无睾症的男孩的SRY、NR5A1、胰岛素样因子3(insulin-like 3, INSL3)和MAMLD1(mastermindlike domain containing 1)基因,均未发现突变。
(二)子宫内的机械性因素致睾丸扭转
除了“遗传因素决定论”外,子宫内睾丸扭转导致睾丸供血血管损伤和先天性双侧无睾症,通常被认为是另一种先天性双侧无睾症病因机制。这种假设认为妊娠期或出生前、后不久睾丸扭转或者精索血管栓塞,致使睾丸血流供应受阻而使睾丸缺血,逐渐完全萎缩退化[24]。然而目前没有通过栓塞睾丸血管引起动物BCA症的相关报道。有学者提出睾丸下降不良导致睾丸扭转进而引起血管系统受损的假说,以及睾丸最初的下降不良可能是由遗传突变引起的[25]。在人类中,已知基因INSL 3和富含亮氨酸的G蛋白偶联受体(leucine rich repeat containing G protein coupled receptor 8, LGR8)与睾丸下降有关。 Vinci等[25]检测了14位先天性双侧无睾症患者的基因,然而并未发现INSL 3和LGR8基因的突变。
二、诊断方法
(一)体格检查
BCA症患者阴囊内睾丸缺如,双侧腹股沟触诊一般为阴性。根据文献报道,和同龄男性相比,青春期前BCA症患者阴茎长度可在正常范围内,青春期后患者可表现为阴茎短小[26,27]。之所以有这种差别,可能是由于青春期前正常男性的雄性激素、促性腺激素是处于低水平的负反馈平衡,而此时阴茎也发育缓慢,而青春期时正常男性性腺轴则处于高水平负反馈平衡,睾酮水平显著升高,是青春期前的20~40倍,阴茎发育较快,BCA症患者的阴茎长度的区别则显现出来。若未经治疗,青春期患者可无胡须或者胡须稀少,身体发胖,发音尖锐。先天性双侧无睾症还可能与其他异常有关,包括严重的智力发育异常[28]以及其他身体异常,如颅面部异常[29]。
(二)内分泌学检查
BCA症具有典型的内分泌学特点:FSH基础浓度升高、睾酮浓度减低、hCG试验结果阴性。超过50%青春期前的BCA症患者基础血浆FSH浓度升高,而LH浓度则因人而异,总体上没有增高。根据目前文献报道,0~12岁患者的睾酮水平一般小于0.17 nmol/ L[3,4,30,31],大于12岁的患者睾酮水平可以达到3.46 nmol/L[25]。然而根据前列腺癌男性成人切除双侧睾丸后睾酮水平应小于1.9 nmol/L[32],故可以粗略推测患者是否有功能性的睾丸组织。本病例中患者睾酮水平达到2.5 nmol/L,可能来源于肾上腺雄激素的分泌,然而,根据目前的文献报道,无睾症患者的睾酮水平达到2.5 nmol/L及以上的病例非常罕见,但超过睾酮去势水平的无睾症患者均为到成年后仍未经治疗的患者,这反映了长期睾酮去势水平对下丘脑-垂体-肾上腺轴(Hypothalamus-Pituitary-Adrenal Axis,HPA轴)的作用[33],这提示成人型BCA症可以作为长期低睾酮水平对基础HPA轴作用的理想研究模型。
血清AMH反映了支持细胞的功能,并可用于对男性体内Sertoli细胞功能和生精管完整性的评估[34]。因此,对睾丸缺如的男性患者查体时可发现血清AMH水平与患者是否存在功能性睾丸组织有关。正常男性血清AMH值范围分别为360~638 pmol/L(1.01~4岁)和309~566 pmol/L(4.01~7岁)[35-37]。血清AMH水平若无法检测到,则提示患者可能无功能性睾丸[38-40]。而Misra等[39]检测了156位诊断为隐睾的男性患者,血浆AMH浓度无法检测到的有24例,12例未发现任何性腺组织,10例发现纤维残留,2例有正常睾丸,但却伴有永久性副中肾管综合征(Mullerian duct syndrome, MDS)(AMH基因缺陷)。虽然AMH检测技术经过20余年的发展,但是目前由于受实验方法与试剂、类风湿因子、补体、脂质过高、胆红素浓度过高、样本发生溶血、样本细菌污染、样本是否添加及添加何种抗凝剂等众多因素的影响,AMH检测易出现假阳性[41,42]。关于AMH检测的稳定性仍没有确定的结论。因此,本例患者并没有选择AMH检测。
值得注意的是,hCG试验是通过升高促性腺激素的方式来检验睾丸组织内分泌功能,而基础血清LH水平升高与hCG对睾酮分泌的影响相似[43],当患者血清FSH和LH水平均明显升高时, 如果进行hCG试验,其结果一般是睾酮水平无反应性升高[23],因此这种情况下hCG试验是不必要做的,否则徒增患者经济负担而没有意义。
因此,在大多数情况下,测定血清AMH、FSH、LH和睾酮的水平将有助于鉴别是否存在有功能性睾丸组织。而本病例中,由于患者基础血清FSH和LH水平均显著升高,考虑hCG试验无临床意义,而血清睾酮水平虽然明显低于正常值,但根据目前报道的病例,血清睾酮浓度达到2.5 nmol/L以上的BCA症病例非常罕见。而结合影像学检查结果,手术探查指征明确。
(三)影像学检查
影像学检查对于无睾症和隐睾鉴别有重要价值,超声检查、CT、MRI发现睾丸可以确诊为隐睾,睾丸的同位素扫描也有助于隐睾的诊断,但临床应用较少。然而通过这些检查隐睾患者只有40%的概率发现睾丸,因此单纯依赖影像学检查的阴性结果,也不能排除隐睾的诊断。而且根据目前的文献报道,随着影像学技术的进展,BCA症的患者影像学可以发现腹股沟等部位残留结节样组织,这些组织结节在术中和术后病理确认为精索末端的纤维组织[30]。而阴囊和双侧腹股沟超声和腹部CT扫描、MRI等影像学检查一旦发现明确的睾丸结构,则可以排除该诊断。
(四)染色体和基因检查
如前所述,外周血染色体检查核型为男性正常核型46,XY。而基因突变检查NR5A1和SRY、INSL3和MAMLD1基因突变结果常为阴性。本例患者核型正常,常规基因检测未见突变。结合以往病例报道和研究,对于BCA症患者的诊断,染色体核型分析结果正常是BCA症诊断的前提,然而目前常规基因的检测对于患者的临床治疗没有明显意义。
(五)手术探查
对BCA症患者腹股沟和腹股沟管的检查仅能在精索末端发现有纤维组织残余,而无睾丸组织或睾丸血管。腹腔镜探查未能发现睾丸组织。对于经内分泌学检查诊断明确的BCA症患者,近年来有学者提出手术探查是否有必要的问题[3,40]。Teo等[1]回顾性分析了11位BCA症患者的内分泌学检查和手术探查结果,发现内分泌学检查和手术探查结果一致率较高,但是,由于缺乏研究、证据不足目前尚不能得出定论。此外,对于无睾症残留的无功能组织的自然病程尚不清楚,尤其是影像学检查提示在精索末端有结节样组织时,需要与无功能的隐睾鉴别,而目前的内分泌学检查并不能完全确认,所以至少对于睾酮水平大于1.9 nmol/L 且影像学提示腹股沟或者腹腔残留异常结节时,推荐手术探查。本病例中,患者内分泌学检查提示无功能性睾丸组织或者睾丸睾丸功能低下,CT提示双侧腹股沟有0.5cm左右椭圆形小结节影,对于残留的组织性质不明,手术探查对于明确诊断、解除患者对隐睾恶变的担忧以及后续治疗具有重要意义。
三、治疗方案
睾酮对性发育、身高以及骨骼生长有重要作用,然而对于性腺功能低下的儿童,何时补充外源性睾酮和补充剂量能激发青春期发育,以达到正常成人身高以及骨骼密度尚有争议。正常生理情况下,青春期前睾酮处于较低水平,且对于青春期前儿童的骨质发育并不显著[44]。Vandewalle等[45]比较了1例男性同卵双胞胎,其中1位出生时诊断为先天性双侧无睾症,小剂量睾酮替代(睾酮酯类25 mg/2周)是自正常双生子青春期发育开始时启动的,然后逐渐增加。18岁时相对于正常的双胞胎兄弟,受影响的男孩有较大肌肉横截面积,腰椎和全身的骨密度两者相似。这提示对于先天性双侧无睾症青春期前患者,低剂量补充睾酮足以激发青春期发育,和到达正常成人身高和阴茎长度[46]。迄今为止,肌肉注射睾酮、口服睾酮类药物和外用睾酮凝胶是男性最常用的3种睾酮替代疗法[47,48]。有学者提出为了患者的阴茎长度和心理健康,在婴儿期就应开始适量补充睾酮,青春期开始时足量补充睾酮,如果经济条件允许,可以植入睾丸假体[4]。综上,对于12~16岁的患者,可以每两周肌注睾酮(初始剂量25 mg),发育停止后每21d肌注250mg睾酮,或者每日口服十一酸睾酮,发育停止后每天口服十一酸睾酮120mg,用药期间定期根据复查性激素水平、身高,调整药量。本例患者自出生后未接受任何正规治疗,阴茎发育短小,但身高发育基本正常,患者术后有结婚意愿,可通过补充睾酮维持第二性征、提高性欲,改善患者生活质量。患者术后每日口服十一酸睾酮,随访术后1个月,患者有性欲,阴茎可正常勃起。然而需要注意长期睾酮补充治疗有可能会增加胆系结石的风险[49]。
四、结论
对于长期未经任何正规治疗的成年BCA症患者,其血清睾酮水平可以超过睾酮去势水平。而BCA症患者的影像学表现可以发现部分纤维组织残留,对于BCA症残留的无功能组织的自然病程尚不清楚,尤其是影像学检查提示在精索末端有结节样组织时,需要与无功能的隐睾鉴别,而目前的内分泌学检查并不能完全确认,所以至少对于部分患者推荐手术探查。对于阴茎外形接近正常的成年性无睾症患者,合理补充睾酮可以改善患者性欲、维持勃起和提高生活质量。然而由于BCA症并不常见,尚缺乏资料积累,今后需要进一步研究。

