砷胁迫下甘蓝型油菜苗期根、下胚轴和鲜重的全基因组关联分析
曲存民 马国强 朱美晨 黄小虎 贾乐东 王书贤 赵会彦 徐新福 卢 坤 李加纳,* 王 瑞,*
砷胁迫下甘蓝型油菜苗期根、下胚轴和鲜重的全基因组关联分析
曲存民1,2,**马国强1,2,**朱美晨1,2黄小虎1,2贾乐东1,2王书贤1,2赵会彦1,2徐新福1,2卢 坤1,2李加纳1,2,*王 瑞1,2,*
1西南大学农学与生物科技学院, 重庆 400715;2重庆市西南大学农业科学研究院, 重庆 400715
油菜是修复土壤重金属污染的理想作物, 为筛选甘蓝型油菜耐砷性的显著关联单核苷酸多态性位点及相关候选基因, 本研究以140份不同来源的甘蓝型油菜自交系为材料, 测定和利用油菜60K SNP芯片对正常和砷胁迫条件下的相对根长(RRL)、相对下胚轴长(RHL)和相对鲜重(RFW)进行了全基因组关联分析。结果表明, 与RRL、RHL和RFW显著关联的SNP位点分别为15、20和35个, 单个SNP位点表型贡献率分别介于13.31%~24.39%、18.04%~33.82%和20.19%~25.06%之间; 其中在A02、A07和C02染色体上同时存在与RRL、RHL和RFW显著关联的LD区间。基于油菜基因组信息在LD区间内共筛选到61个可能与砷胁迫相关的候选基因, 其中、、、、和等与重金属吸收和转运相关。实时荧光定量PCR分析结果表明,和是与甘蓝型油菜砷离子吸收转运相关的重要候选基因。本研究结果对于甘蓝型油菜耐砷胁迫机理的研究、性状的改良具有重要参考价值。
甘蓝型油菜; 耐砷性; 全基因组关联分析; 候选基因
随着工农业和城市化进程的发展, 以及化肥农药的不合理利用, 使我国农田土壤日益恶化。砷是广泛存在于自然界的一种微量元素, 有剧毒且有致癌作用, 同时会抑制植物生长, 从而严重影响作物产量, 且可食部分砷的积累会对食物链造成污染[1-2]。植物响应重金属元素胁迫的机制包括阻止和控制重金属的吸收、体内螯合解毒、体内区室化分隔以及代谢平衡等生物学过程[3]。在土壤中, 砷主要以砷酸盐和亚砷酸盐的形式存在, 在有氧条件下, 植物从土壤中吸收利用的主要是砷酸盐, 而在厌氧条件下, 亚砷酸盐的吸收占主导地位[4]。研究表明, 磷酸盐转运蛋白(Pht)和水通道蛋白的亚家族(NIPs)是砷酸盐进入植物体的主要通道蛋白, 拟南芥中、、、和都是参与As3+吸收和转运的重要基因[5-7], 在水稻中,参与侧根对As3+吸收和转运[8];和均具有运输As3+的能力, 过量表达后水稻地上部的砷含量显著受到抑制[9]。然而大多数植物体内对重金属的解毒途径是以谷胱甘肽为还原剂, 在砷酸盐氧化还原酶类作用下将体内的砷酸盐还原成亚砷酸盐, 从而降低其毒性[4]。在拟南芥中, 还原酶ATQ1/HAC1突变显著增加了其对砷酸盐的敏感性, 同时显著降低了亚砷酸盐和砷酸盐的比率, 从而使As3+从根部流出的能力降低[10]。另外, 植物体内的金属硫蛋白(metallotioneins, MTs) 和植物螯合蛋白 (PCs) 等与重金属形成螯合物质, 并在ATP结合盒(ABC)转运蛋白作用下转移到液泡中, 能够缓解As3+对植物细胞的毒害[11]。同时, 为了应对胁迫, 植物体内产生的抗氧化酶(CAT、POD、SOD、APX)及非酶抗氧化剂[谷胱甘肽(GSH)、抗坏血酸(AsA)等]能够消除自由基, 抵抗ROS对细胞的损伤, 同时会主动积累一些可溶性溶质, 如可溶性蛋白、可溶性糖等来降低胞内渗透势, 以保证重金属胁迫条件下水分的正常供应, 维持细胞正常的生理功能[11]。
十字花科植物是用于植物修复重金属污染土壤的理想物种[12-13]。油菜作为良好的冬闲田作物, 因具有生长速度快、生物量高、对重金属有较强的耐受性及吸收积累能力等特点, 被认为是修复土壤重金属污染的优良作物之一, 但研究主要集中于Cd、Cu、Zn等重金属离子方面[12,14-15]。此外, 宋俊英等[16]通过对不同甘蓝型油菜和芥菜型油菜品种的水培试验筛选获得砷排异型品种, 证明低浓度的砷胁迫在一定程度上能够促进排异型油菜的生长, 并增加其产量, 但具体的分子机制有待进一步分析。为解析砷胁迫下影响甘蓝型油菜耐砷性的关键位点和候选基因, 本研究对140份甘蓝型油菜在砷胁迫后的相对根长、相对下胚轴长和相对鲜重进行了全基因组关联分析, 确定显著关联的SNP标记和候选区间, 进一步筛选控制性状变异的候选基因, 并通过实时荧光定量PCR验证候选基因在砷胁迫下表达的特性, 明确其基本的生物学功能。本研究为甘蓝型油菜耐砷胁迫的油菜资源的鉴定提供分子标记, 对于砷污染土壤的修复及砷污染土壤上农产品的安全生产具有重要意义。
1 材料与方法
1.1 供试材料
140份甘蓝型油菜材料(附表1)的遗传背景来源广泛, 其中国内品种131份, 大部分在长江流域的重庆、四川、湖北、湖南等地种植, 国外品种9份, 主要在加拿大和德国种植。上述材料均由西南大学重庆市油菜工程技术研究中心保存提供。
1.2 试验设计及表型数据考察
随机选取10份材料, 分别用不同浓度的砷酸钠溶液(0、2.5、5、7.5、10、15和20 mg L–1)预处理, 以获得最佳处理浓度(15 mg L–1)。然后选取每份材料健康饱满的100粒种子, 共分为2组。以蒸馏水为对照, 分别将材料播种于培养盘中, 并用保鲜膜封口。将培养盘置培养间, 培养条件为昼夜温度为25℃, 光照/黑暗时间为16 h/8 h, 光照强度为100 µmol m–2s–1, 相对湿度为60%[17]。培养7 d后, 选取每份材料长势一致的幼苗5株照相, 用AdobeScan移动应用程序读取根和下胚轴长, 用万分之一天平分别称量5株幼苗的鲜重和干重。
各表型性状的相对值 = 处理组测定值/对照组测定值[18], 其中相对根长(relative root length)、相对下胚轴长(relative hypocotyl length)和相对鲜重(relative fresh weight)分别用RRL、RHL和RFW表示。
1.3 供试材料基因型、群体结构及亲缘关系分析
参照卢坤等[19]方法, 利用油菜60K SNP芯片对140份甘蓝型油菜材料进行SNP基因型分析, 最终获得32,542个在甘蓝型油菜基因组中具有唯一位置的SNP 标记(MAF < 0.05)用于群体性状的关联分析。
基于贝叶斯数学模型, 利用Structure V2.3.4软件[20]对140份材料的关联群体进行群体结构分析。假设群体内存在的亚群数目的范围为1~10, 运用该软件对每个值进行5次模拟运算, 将模拟参数迭代(length of burn-in period)和蒙特卡罗迭代(markov chain monte carlo MCMC)均设置为10,000次循环, 并在混合模型下运算。最后根据STRUCTUREV 2.3.4软件运算得到的后验概率值和2个连续的后验概率值的变化速率(Δ)来确定群体中存在的亚群数目[21]。利用SPAGeDi v1.4 软件进行亲缘关系(kinship)分析, 并计算亲缘关系值的矩阵(K矩阵)[22]。
1.4 全基因组关联分析与LD区间分析
参照Wang等[23]方法, 利用R语言程序包的MRMLM (Multi-Locus Random-SNP-Effect Mixed Linear Model)方法进行砷胁迫相关性状 GWAS分析,参数设置均为默认值[23-24]。
显著关联SNP标记阈值以1/标记数设定为1/32,542 = 3.0E–5, 同时采用Haploview 4.2计算显著关联SNP所在染色体上的LD区间, 设定HW阈值(Hardy Weinberg-value cutoff)为0.001, 非缺失标记的比例为75%, MAF为0.05, 参照卢坤等[19]方法进行, 最终以显著关联的SNP所在的单倍型块作为候选基因预测区间, SNP标记未在单倍型块内的, 则以标记两侧100 kb侧翼序列作为LD候选区域, 用于候选基因的预测和功能注释。
1.5 候选基因预测与qRT-PCR分析
根据已知的甘蓝型油菜基因组测序数据库(http://www.genoscope.cns.fr/blat-server/cgi-bin/colza/webBlat)信息[25], 筛选获得LD区间内的候选基因, 利用Geneious 4.8.5软件进行本地BlastP分析, 与拟南芥进行BlastP比对分析的阈值E-value ≤1E–10, 最终以获得的同源性最高的拟南芥功能基因注释候选基因功能[19]。
为进一步明确候选基因的功能, 利用qRT-PCR方法, 检测砷胁迫后候选基因在根、下胚轴和子叶中表达量变化差异。参照Zhou等[26]方法提取根、下胚轴和叶片总RNA, 合成cDNA和进行qRT-PCR扩增, 反应结束后, 根据参照基因用2–DDCT法计算目的基因相对表达量, 3次重复。候选基因扩增的特异性引物源自qPrimerDB数据库[27](表1)。
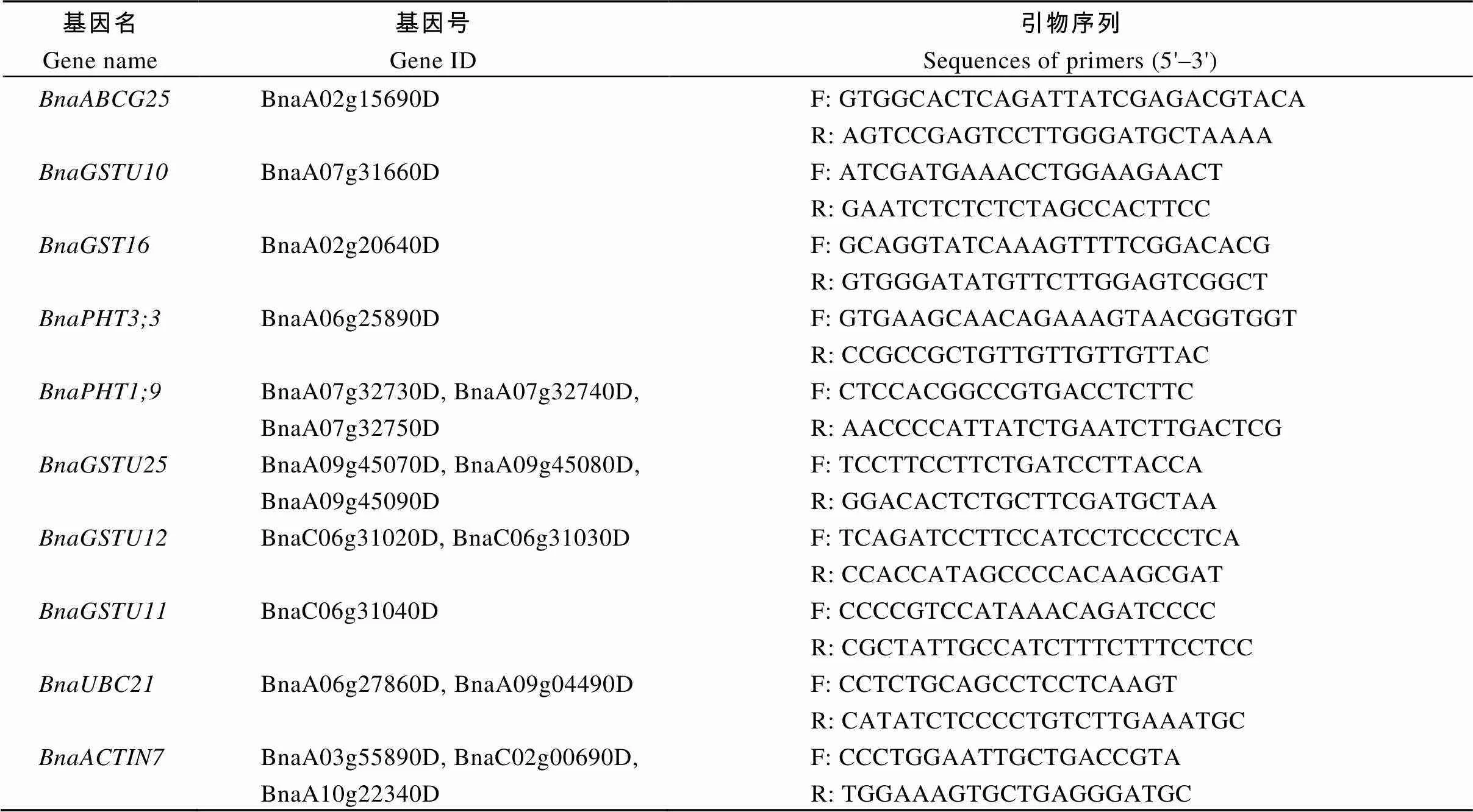
表1 候选基因qRT-PCR特异性引物序列
2 结果与分析
2.1 砷胁迫相关性状的表型变异分析
在正常和砷胁迫处理下(表2), 油菜根长的变异幅度分别介于1.41~15.80 cm和0.61~13.39 cm之间, 变异系数分别为25.91%和28.91%, 其相关系数为0.986 (<0.01); 下胚轴长变异幅度分别介于2.68~ 7.99 cm和1.75~6.48 cm之间, 变异系数分别为16.87%和17.79%, 其相关系数为0.955 (<0.01); 鲜重变异幅度分别为0.026~0.093 g和0.019~0.087 g之间, 变异系数分别为21.93%和26.68%, 相关系数为0.996 (<0.01), 上述结果表明, 甘蓝型油菜发芽期根长、下胚轴长和鲜重在砷胁迫后受到不同程度的抑制作用, 以相对根长、相对下胚轴长和相对鲜重作为油菜受抑制程度的衡量指标, 其变异系数分别为31.09%、20.62%和20.27%, 说明受砷胁迫后供试材料在萌发期存在较大的性状变异。
统计分析(图1)表明, 各性状值均呈连续性变异, 符合多基因控制的数量性状遗传特点, 适于用GWAS方法进行有效的基因定位分析。
2.2 耐砷胁迫相关性状的全基因组关联分析
用MRMLM模型对60K SNP芯片获得的基因型数据与140份甘蓝型油菜耐砷性指标进行全基因组关联分析(图2), 共获得15个RRL的显著关联SNP位点, 分别位于A02、A03、A04、A05、A06、A07、A08、C02、C03、C05、C06、C07和C08染色体, 单个SNP可解释表型变异的17.31%~24.39% (图2-A和表3); 20个与RHL性状显著关联的SNP位点, 分别位于A01、A02、A03、A07、C02和C04染色体上, 单个SNP位点可解释18.04%~33.82%的表型变异(图2-B和表3); 35个与RFW紧密关联的SNP位点, 分别位于A01、A02、A07、A09、C02、C04和C07染色体上, 其中, 在A02染色体上检测到20个成簇分布, 单个SNP可解释表型变异的20.19%~25.06% (图2-C和表3)。
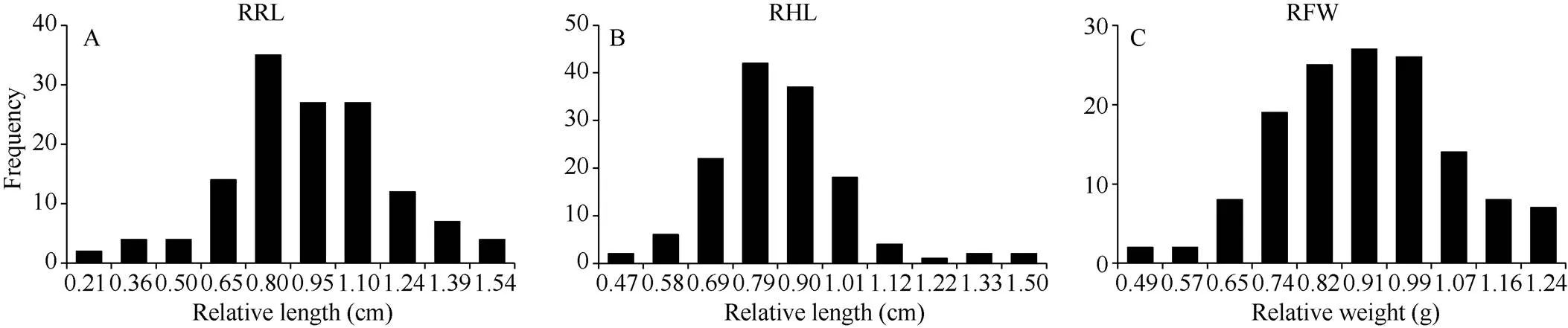
图1 砷胁迫下甘蓝型油菜相对根长、下胚轴和鲜重的频次分布
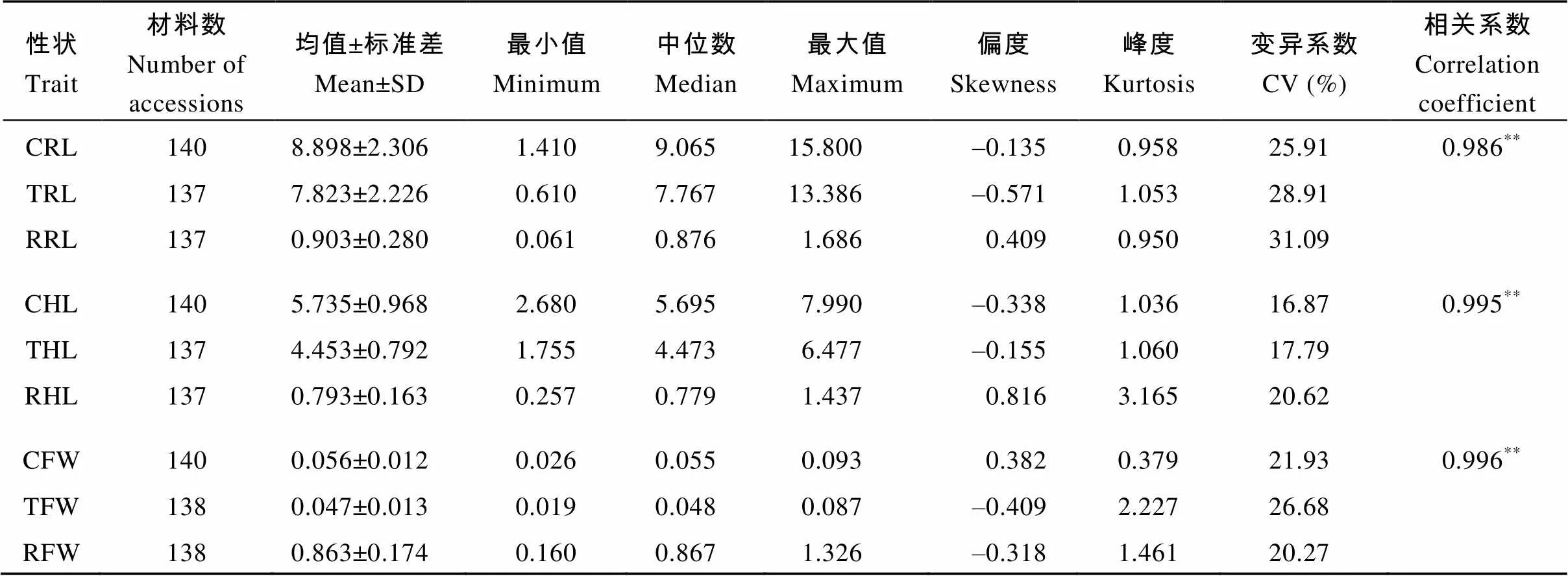
表2 砷胁迫下甘蓝型油菜苗期性状统计分析
CRL、CHL和CFW: 正常条件下的根长、下胚轴长和鲜重; TRL、THL和TFW: 砷胁迫下的根长、下胚轴长和鲜重; RRL、RHL和RFW: 正常与砷胁迫下相对根长、相对下胚轴长和相对鲜重;**< 0.01。
RL, CHL, and CFW: the length of root, hypocotyl, and fresh weight under normal condition; RL, THL, and TFW: the length of root, hypocotyl, and fresh weight under As stress; RRL, RHL, and RFW: the relative length of root, hypocotyl, and fresh weight under normal and As stress;**< 0.01.
在检测到的显著关联SNP位点中, 在A02、A07和C02染色体上存在与RRL、RHL和RFW重合的LD连锁区间, 对这些区间的功能注释表明, 可能存在影响甘蓝型油菜参与响应砷胁迫相关的基因位点。
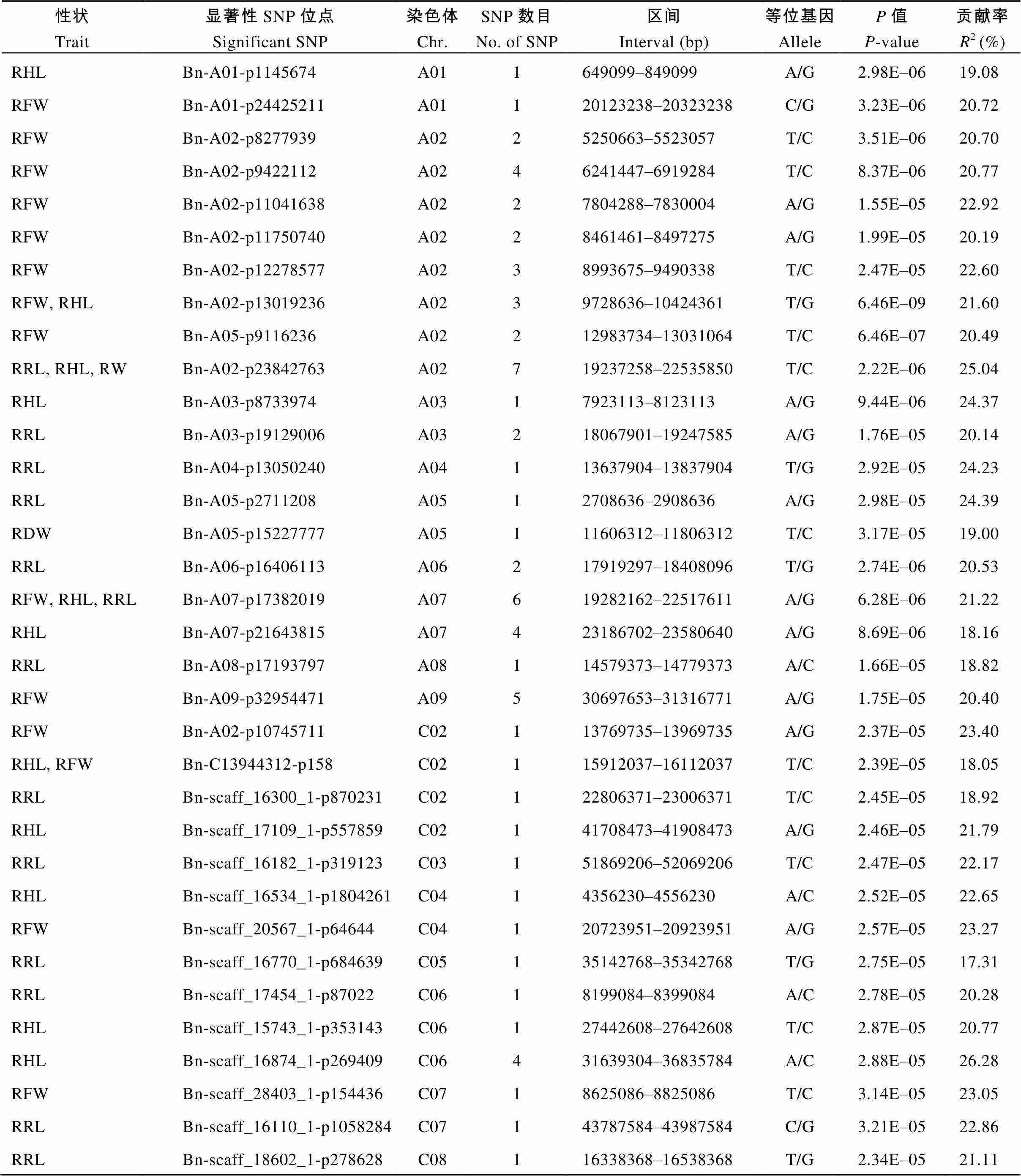
表3 砷胁迫下甘蓝型油菜相关性状的显著关联SNPs
RRL、RHL和RFW: 正常与砷胁迫下相对根长、相对下胚轴长和相对鲜重。
RRL, RHL, and RFW: the relative length of root, hypocotyl, and fresh weight under normal and As stress。

图2 砷胁迫下甘蓝型油菜相对根长、相对下胚轴长和相对鲜重全基因组关联分析的曼哈顿图
2.3 响应砷胁迫相关候选基因分析
根据已公布的油菜“Darmor-”基因组信息[25], 分别将确定的LD置信区间和未在LD区间内的显著连锁SNP标记上下游各100 kb侧翼序列作为候选区间, 通过本地BlastP将其候选基因蛋白序列比对到拟南芥中进行基因的注释, 筛选出目标基因组区段内与砷相关的油菜同源基因。结果共注释了61个与重金属胁迫或代谢相关的候选基因, 主要包括、、、、、等(表4)。其中在A02染色体上, 与RRL、RHL和RFW均显著关联的LD区间(20.77~23.58 Mb)内注释了一个与重金属转运相关的候选基因(), 而在A02染色体关联SNP标记覆盖的5.25~13.03 Mb候选区段内, 还包括重要候选基因和, 其功能分别为谷胱甘肽转移酶(Glutathione S-Transferase 16, GST16[28])和种子特异性的水孔通道蛋白(ALPHA-TONOPLAST Intrinsic Protein, TIP3[29]), 以及注释基因与种子萌发相关(ATP-Binding Cassette G25, AtABCG25[30])等。在A07染色体与RRL、RHL和RFW均显著关联的LD区间(19.28~23.58 Mb)内, 共注释到16个相关候选基因(表4), 其中4个串联重复基因、、和, 与拟南芥MATE基因家族蛋白为同源基因, 距Bn-A07-p20935217标记下游78.98~ 90.77 kb存在3个串联重复基因、和D, 与拟南芥(phosphate transporter 1,)为同源基因, 其注释功能为与砷离子跨膜运输及磷酸盐离子运输相关(表4), 为本研究的重要候选基因。同时, 还包括、和等相关基因的同源基因(表4), 而在C02染色体的LD置信区间内并未发现注释的相关功能的候选基因。
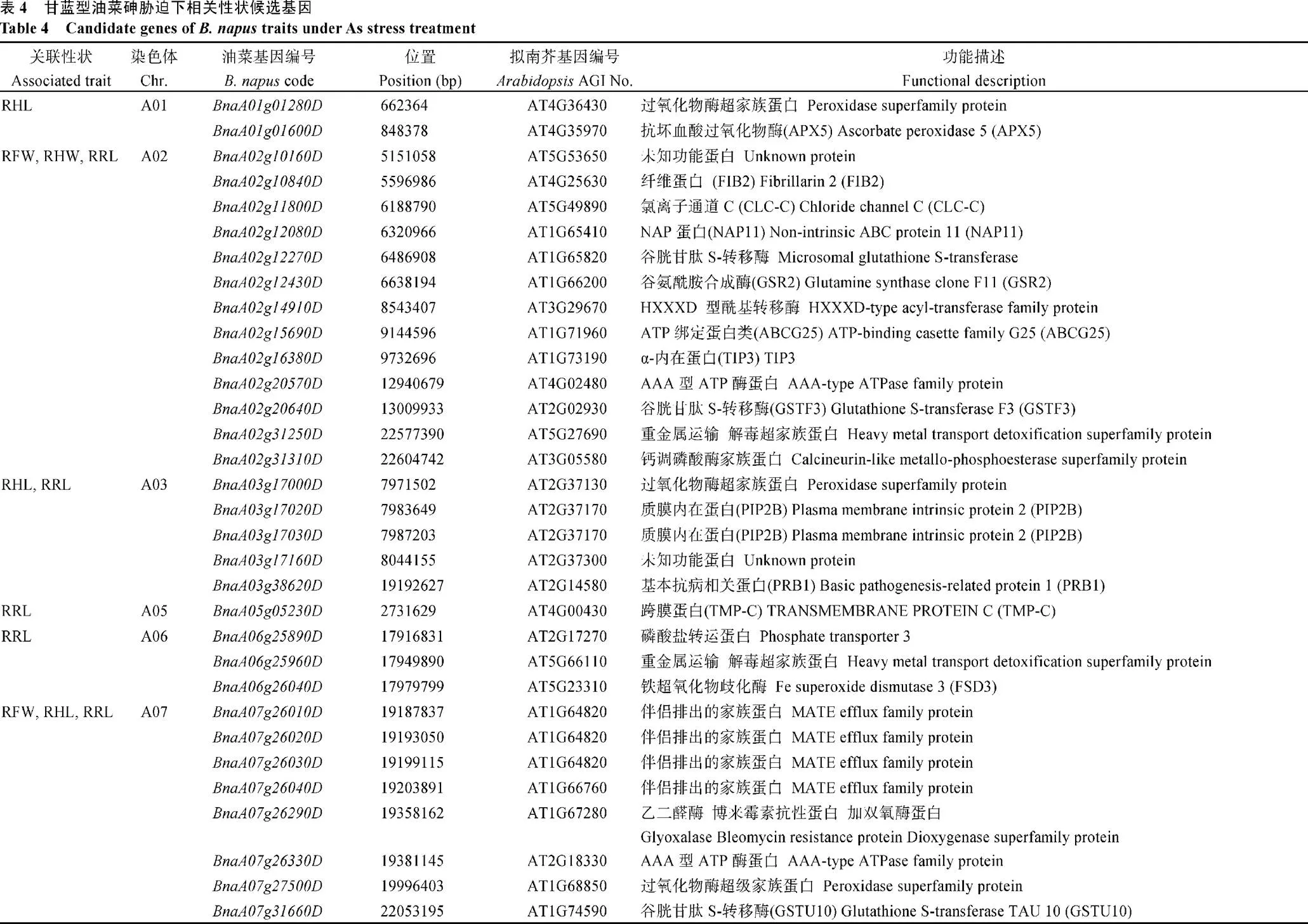
另外, 候选基因中在A03、A09和C06染色体上存在重要的与重金属离子相关的串联重复基因, 其中A03染色体的2个串联重复基因和与拟南芥水通道活性蛋白()同源; 在A09染色体的2个串联重复基因和与拟南芥()和()为同源基因, 都属于ABC转运蛋白, 3个串联重复基因、和与拟南芥中的()为同源基因, 具有谷胱甘肽转移酶活性; C06染色体上的3个串联重复基因均与谷胱甘肽转移酶活性相关, 分别与拟南芥()和()为同源基因, 而和与拟南芥()为同源基因, 具有碳水化合物跨膜转运活性。因此, 本研究为深入解析甘蓝型油菜响应砷胁迫的分子机制提供了基础。
2.4 砷胁迫下候选基因的差异表达分析
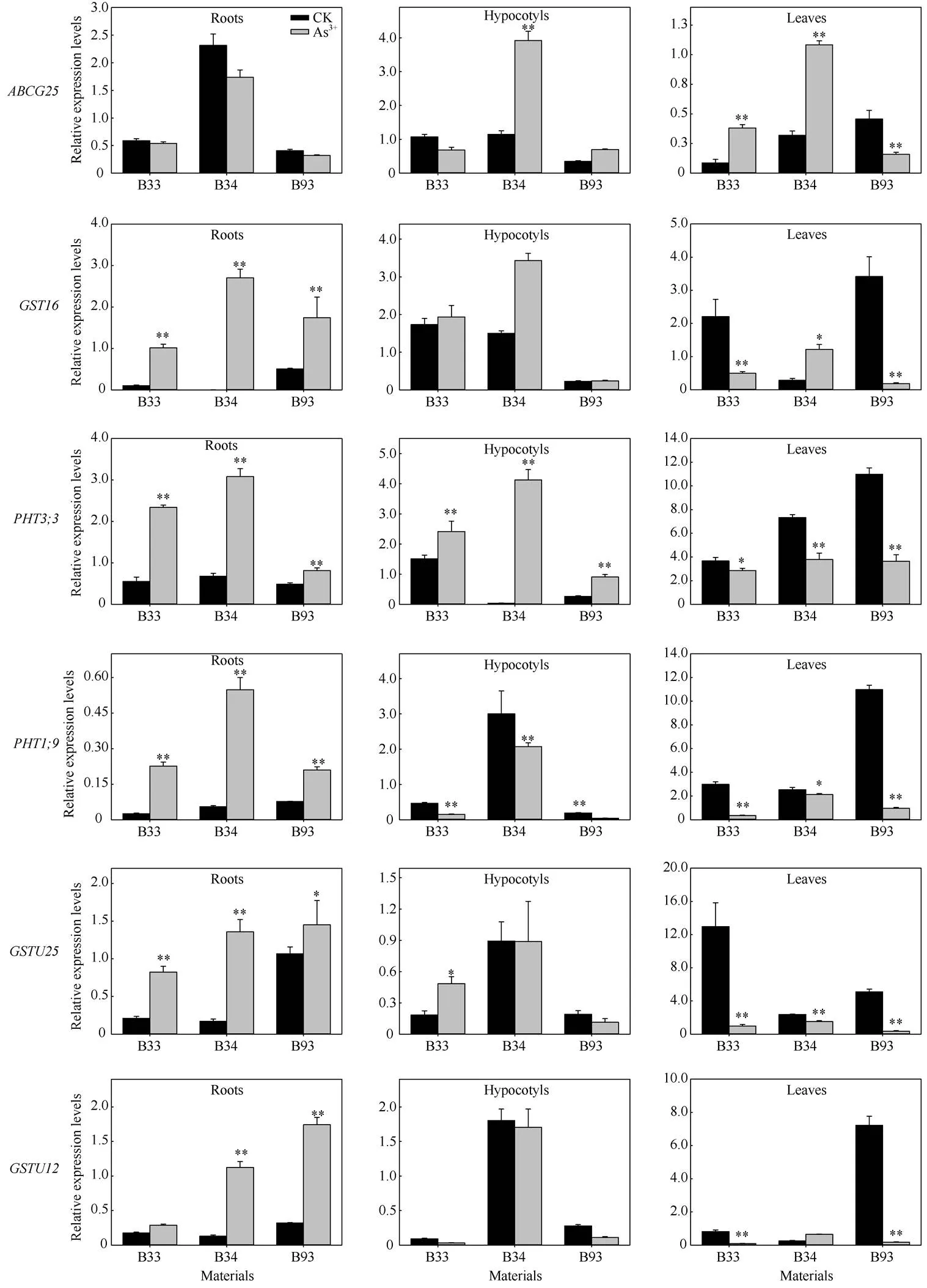
通过qRT-PCR方法分析了LD候选区间内8个关键候选基因在砷胁迫下的表达模式(图3), 这些候选基因在甘蓝型油菜根、下胚轴和叶中具有不同的表达模式。其中6个基因家族成员在根中的表达量显著高于对照, 这些基因与砷离子的吸收密切相关。基因和在下胚轴中显著下调表达, 基因在所有材料中显著上调表达, 但叶中均表现为显著下调表达, 基因、和可能为油菜响应砷胁迫的重要基因。
3 讨论
在自然界中, 砷作为一种非必须微量元素, 被认为是I级致癌物, 对动植物的生长发育和人们的健康产生危害[31]。十字花科植物对重金属镉、铅、锌、汞、砷等均具有较强的耐受性, 但对于甘蓝型油菜响应砷胁迫分子机制的研究相对缺乏。随着油菜60K基因芯片开发及甘蓝型油菜基因组测序的完成[25], 通过GWAS分析并结合基因组信息挖掘油菜重要数量性状的候选基因在油菜研究中已成为常规手段[17,19,32-34]。本研究通过对正常和砷胁迫条件下RRL、RHL和RFW 3个性状的全基因组关联分析, 共检测到67个显著关联的SNP位点, 分别分布在油菜的15条染色体上。其中, A02和A07的关联SNP标记分别与Chen等[35]报道的镉离子相关性状的关联SNP标记位点相近, 关联区间距离分别为202.81 kb和404.37 kb, 很可能为同一位点; 其余位点则与本研究的位点未能重叠, 可能与考察的性状及鉴定的方法存在差异相关联, 也可能是由于甘蓝型油菜响应镉和砷胁迫的分子作用机制存在差异性。
通过关联SNP标记在油菜基因组中的物理位置及确定的关联LD置信区间, 根据已公布的甘蓝型油菜“Darmor-”基因组信息[25], 我们共注释了61个可能与响应耐砷胁迫相关的候选基因。在植物中, 研究表明磷酸盐和砷酸盐采用相同吸收系统[36]。同时, 砷酸盐主要通过磷酸盐转运蛋白(Pht)进入植物体, 且与磷酸盐是化学类似物, 在提高磷酸盐含量同时可减少砷的吸收[37-39], 从而降低砷对油菜的毒害作用。在A07染色体SNP标记Bn-A07-p20935217下游78.98~90.77 kb区域内注释了3个串联重复基因、和,与拟南芥()为同源基因, 该基因与砷的吸收转运与磷酸盐存在紧密关联性[39,40]。此外, 在A06染色体上SNP标记Bn-A06-p16406113上游24~2254 bp的区间内筛选到一个基因, 其拟南芥同源基因为()[41-42], 均具有磷酸盐离子跨膜转运活性。同时在砷胁迫后,和在根中的表达量显著升高, 说明这2个基因可能与砷离子的吸收相关联。另外,在下胚轴中的表达量也显著升高, 说明该基因可能是砷离子吸收转运相关的重要影响因子。
(图3)
误差线表示平均值的标准差(=3); *和**分别表示在0.05和0.01水平上差异显著。
Error bar represents the standard error of the mean (=3); * and ** indicate significant difference at the 0.05 and 0.01 probability levels, respectively.
植物在受到高盐、重金属等胁迫时, 体内的植物ATP结合盒(ABC)转运蛋白在离子吸收、累积、转运和外排过程中发挥重要作用[43]。本研究在关联候选区间内注释的6个ABC转运蛋白相关的候选基因(、、、、和)分别与拟南芥()、()、()、()、()和()为同源基因。在砷胁迫后, 本研究发现在叶中的表达量显著升高, 而在根和下胚轴中的变化不明显(图4), 说明该基因可能参与了砷离子的转运, 其具体的机理有待进一步验证。另外, 谷胱甘肽-S-转移酶(gluthione S-transferase, GST)是植物体内重要的解毒酶类物质, 也是植物螯合肽(Phytochelatin, PC)合成前体, 对重金属有较大的亲和力和重金属离子鳌合能力, 是植物自身解毒机制形成的重要因子[44]。同时, 高浓度的GSH可提高植物体对重金属的耐受能力, 对植物抗重金属过程中的作用进行了广泛研究[45-46], 但是在甘蓝型油菜中的相关报道还较少。本研究在A07, A09和C06染色体的关联LD区间内注释到7个编码谷胱甘肽转移酶相关的候选基因 (、、、、、和)和1个谷胱甘肽巯基转移酶活性相关基因()。在砷胁迫下, 本研究中, 除外,、、和在根中显著上调表达(图4), 说明这些基因功能可能与根对砷离子的吸收相关联。然而在下胚轴中、和在叶中均显著下调表达(图4), 说明它们可能与砷离子的吸收转运及降解相关联。因此, 进一步深入开展上述关联候选基因的功能分析将有助于揭示甘蓝型油菜发芽期适应砷胁迫的响应机制, 为甘蓝型油菜重金属耐受性新品种的选育提供理论基础。
4 结论
共获得70个油菜砷胁迫性状相关的显著关联SNP标记位点, 其中与相对根长、相对下胚轴长和相对鲜重显著关联的位点分别为15、20和35个。在显著关联的候选区间内共注释到61个砷胁迫相关的候选基因, 其中和可能是参与甘蓝型油菜砷离子吸收转运的重要候选基因。
附表 请见网络版: 1) 本刊网站http://zwxb.chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuowxb. aspx。
[1] Panaullah G M, Alam T, Hossain M B, Loeppert R H, Lauren J G, Meisner C A, Ahmed Z U, Duxbury J M. Arsenic toxicity to rice (L.) in Bangladesh., 2008, 317: 31.
[2] Finnegan P M, Chen W. Arsenic toxicity: the effects on plant metabolism., 2012, 3: 182.
[3] 谭万能, 李志安, 邹碧. 植物对重金属耐性的分子生态机理. 植物生态学报, 2006, 30: 703–712. Tan W A, Li Z A, Zou B. Molecular mechanisms of plant tolerance to heavy metals., 2006, 30: 703–712 (in Chinese with English abstract).
[4] Lindsay E R, Maathuis F J M. New molecular mechanisms to reduce arsenic in crops., 2017, 22: 1016–1026.
[5] Isayenkov S V, Maathuis F J M. Theaquaglyceroporinis a pathway for arsenite uptake., 2008, 582: 1625–1628.
[6] Xu W, Dai W, Yan H, Li S, Shen H, Chen Y, Xu H, Sun Y, He Z, Ma M.plays an important role in arsenic uptake and root-to-shoot translocation under arsenite stress conditions., 2015, 8: 722–733.
[7] Kamiya T, Tanaka M, Mitani N, Ma J F, Maeshima M, Fujiwara T., an aquaporin homolog, determines the arsenite sensitivity of., 2009, 284: 2114–2120.
[8] Chen Y, Sun S K, Tang Z, Liu G, Moore K L, Maathuis F J M, Miller A J, McGrath S P, Zhao F J. The Nodulin 26-like intrinsic membrane proteinis involved in arsenite uptake by lateral roots in rice., 2017, 68: 3007–3016.
[9] Sun S K, Chen Y, Che J, Noriyuki K, Tang Z, Miller A J, Ma J F, Zhao F J. Decreasing arsenic accumulation in rice by overexpressingandthrough disrupting arsenite radial transport in roots., 2018, https://doi.org/ 10.1111/nph.15190.
[10] Chao D Y, Chen Y, Chen J, Shi S, Chen Z, Wang C, Danku J M, Zhao F J, Salt D E. Genome-wide association mapping identifies a new arsenate reductase enzyme critical for limiting arsenic accumulation in plants., 2014, 12: e1002009.
[11] 李洋, 于丽杰, 金晓霞. 植物重金属胁迫耐受机制. 中国生物工程杂志, 2015, (9): 94–104. Li Y, Yu L J, Jin X X. Mechanism of heavy metal tolerance stress of plants., 2015, (9): 94–104 (in Chinese with English abstract).
[12] Cojocaru P, Gusiatin Z M, Cretescu I. Phytoextraction of Cd and Zn as single or mixed pollutants from soil by rape ()., 2016, 23: 10693–10701.
[13] Gasic K, Korban S S. Expression ofphytochelatin synthase in Indian mustard () plants enhances tolerance for Cd and Zn., 2007, 225: 1277–1285.
[14] Marchiol L, Assolari S, Sacco P, Zerbi G. Phytoextraction of heavy metals by canola () and radish () grown on multicontaminated soil., 2004, 132: 211.
[15] Touiserkani T, Haddad R. Cadmium-induced stress and antioxidative responses in differentcultivars., 2012, 14: 929–937.
[16] 宋俊英. 芸薹属植物对砷胁迫的反应及其机理研究. 华中农业大学硕士学位论文, 湖北武汉, 2010. Song J Y. Responses ofSpecies to Arsenic Stress and Their Mechanisms. PhD Dissertation of Huazhong Agriculture University, Hubei, Wuhan, China, 2010.
[17] 张蕊, 邓文亚, 杨柳, 王亚萍, 肖芳枝, 禾健, 卢坤. 盐胁迫下甘蓝型油菜发芽期下胚轴和根长的全基因组关联分析. 中国农业科学, 2017, 50: 15–27. Zhang R, Deng Y W, Yang L, Wang Y P, Xiao Y Z, He J, Lu K. Genome-wide association study of root length and hypocotyl length at germination stage under saline conditions in., 2017, 50: 15–27 (in Chinese with English abstract).
[18] Munns R, James R A. Screening methods for salinity tolerance: a case study with tetraploid wheat., 2003, 253: 201–218.
[19] 卢坤, 王腾岳, 徐新福, 唐章林, 曲存民, 贺斌, 梁颖, 李加纳. 甘蓝型油菜结角高度与荚层厚度的全基因组关联分析. 作物学报, 2016, 42: 344–352. Lu K, Wang T Y, Xu X F, Tang Z L, Qu C M, He B, Liang Y, Li J N. Genome-wide association analysis of height of podding and thickness of pod canopy in., 2016, 42: 344–352 (in Chinese with English abstract).
[20] Pritchard J K, Stephens M, Donnelly P. Inference of population structure using multilocus genotype data., 2000, 155: 945.
[21] Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software structure: a simulation study., 2005, 14: 2611–2620.
[22] Hardy O, Vekemans X. SPAGeDi: a versatile computer program to analyse spatial genetic structure at the individual or population levels., 2002, 2: 618–620.
[23] Wang S B, Feng J Y, Ren W L, Huang B, Zhou L, Wen Y J, Zhang J, Dunwell J M, Xu S, Zhang Y M. Improving power and accuracy of genome-wide association studies via a multi-locus mixed linear model methodology., 2016, 6: 19444.
[24] Tamba C L, Ni Y L, Zhang Y M. Iterative sure independence screening EM-Bayesian LASSO algorithm for multi-locus genome-wide association studies., 2017, 13: e1005357.
[25] Chalhoub B, Denoeud F, Liu S, Parkin I A, Tang H, Wang X, Chiquet J, Belcram H, Tong C, Samans B, and 72 others. Early allopolyploid evolution in the post-Neolithicoilseed genome., 2014, 345: 950–953.
[26] Zhou Y, Xu D, Jia L, Huang X, Ma G, Wang S, Zhu M, Zhang A, Guan M, Lu K. Genome-wide identification and structural analysis of bZIP transcription factor genes in., 2017, 8: 288.
[27] Lu K, Li T, He J, Chang W, Zhang R, Liu M, Yu M, Fan Y, Ma J, Sun W. qPrimerDB: a thermodynamics-based gene-specific qPCR primer database for 147 organisms., 2018, 46: D1229–D1236.
[28] Lee S H, Li C W, Koh K W, Chuang H Y, Chen Y R, Lin C S, Chan M T.reverses oxidation ofto confertolerance ofto oxidative stress., 2014, 65: 5049–5062.
[29] Mao Z, Sun W.seed-specific vacuolar aquaporins are involved in maintaining seed longevity under the control of Abscisic acid insensitive 3., 2015, 66: 4781–4794.
[30] Kang J, Yim S, Choi H, Kim A, Lee K P, Lopezmolina L, Martinoia E, Lee Y. Abscisic acid transporters cooperate to control seed germination., 2015, 6: 8113.
[31] Pandey C, Khan E, Panthri M, Tripathi R D, Gupta M. Impact of silicon on Indian mustard (L.) root traits by regulating growth parameters, cellular antioxidants and stress modulators under arsenic stress., 2016, 104: 216–225.
[32] Hatzig S V, Frisch M, Breuer F, Nesi N, Ducournau S, Wagner M H, Leckband G, Abbadi A, Snowdon R J. Genome-wide association mapping unravels the genetic control of seed germination and vigor in., 2015, doi: 10.3389/fpls.2015.00221.
[33] Luo X, Ma C, Yue Y, Hu K, Li Y, Duan Z, Wu M, Tu J, Shen J, Yi B. Unravelling the complex trait of harvest index in rapeseed (L.) with association mapping., 2015, 16: 379.
[34] Li F, Chen B, Xu K, Wu J, Song W, Bancroft I, Harper AL, Trick M, Liu S, Gao G. Genome-wide association study dissects the genetic architecture of seed weight and seed quality in rapeseed (L)., 2014, 21: 355–367.
[35] Chen L, Wan H, Qian J, Guo J, Sun C, Wen J, Yi B, Ma C, Tu J, Song L. Genome-wide association study of cadmium accumulation at the seedling stage in rapeseed (L).,2018, 9: 375.
[36] Meharg A A, Macnair M R. An altered phosphate uptake system in arsenate-tolerantL., 1990, 116: 29–35.
[37] Shin H, Shin H S, Dewbre G R, Harrison M J. Phosphate transport in:andplay a major role in phosphate acquisition from both low- and high-phosphate environments., 2004, 39: 629–642.
[38] Nagarajan V K, Jain A, Poling M D, Lewis A J, Raghothama K G, Smith A P.mobilizes phosphate between source and sink organs and influences the interaction between phosphate homeostasis and ethylene signaling., 2011, 156: 1149.
[39] Remy E, Cabrito T R, Batista R A, Teixeira M C, Sá-Correia I, Duque P. Theandtransporters mediate inorganic phosphate acquisition by theroot during phosphorus starvation., 2012, 195: 356–371.
[40] Lapis-Gaza H R, Jost R, Finnegan P M.Phosphate transporter1 genesandare involved in root-to-shoot translocation of orthophosphate., 2014, 14: 334.
[41] Zhu W, Miao Q, Sun D, Yang G, Wu C, Huang J, Zheng C. The mitochondrial phosphate transporters modulate plant responses to salt stress via affecting ATP and gibberellin metabolism in., 2012, 7: e43530.
[42] Hamel P, Saint-Georges Y, de Pinto B, Lachacinski N, Altamura N, Dujardin G. Lachacinski N, Altamura N, Dujardin G. Redundancy in the function of mitochondrial phosphate transport inand., 2004, 51: 307–317.
[43] Ortiz D F, Kreppel L, Speiser D M, Scheel G, McDonald G, Ow D W. Heavy metal tolerance in the fission yeast requires an ATP-binding cassette-type vacuolar membrane transporter.1992, 11: 3491–3499.
[44] 孙瑞莲, 周启星. 高等植物重金属耐性与超积累特性及其分子机理研究. 植物生态学报, 2005, 29: 497–504. Sun R L, Zhou Q X. Heavy metal tolerance and hyperaccumulation of higher plants and their molecular mechanisms: a review., 2005, 29: 497–504 (in Chinese with English abstract).
[45] Mohamed S, Kheireddine O, Wyllia H M, Roquia R, Aicha D, Mourad B. Proportioning of biomarkers (GSH, GST, ache, catalase) Indicator of pollution at(TeleosteiFish) exposed to cadmium., 2012, 2: 177–181.
[46] Guo J, Dai X, Xu W, Ma M. Over-expressingandsimultaneously increases the tolerance and accumulation of cadmium and arsenic in., 2008, 72: 1020–1026.
Genome-wide association of roots, hypocotyls and fresh weight at germination stage under as stress inL.
QU Cun-Min1,2,**, MA Guo-Qiang1,2,**, ZHU Mei-Chen1,2, HUANG Xiao-Hu1,2, JIA Le-Dong1,2, WANG Shu-Xian1,2, ZHAO Hui-Yan1,2, XU Xin-Fu1,2, LU Kun1,2, LI Jia-Na1,2,*, and WANG Rui1,2,*
1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;2Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China
is an optimum crop for repairing the heavy metal pollution of soil. To identify the associated SNP locus and candidate genes with arsenic (As) stress tolerance in, we measured and performed genome-wide association studies (GWAS) on relative root length (RRL), relative hypocotyl length (RHL), and relative fresh weight (RFW) of 140 rapeseed accessions by the60K Illumina Infinium SNP array. In total, 15 SNPs significantly associated with RRL, 20 loci with RHL, and 35 SNP with RFW were identified, and each of SNP explained 13.31%–24.39%, 18.04%–33.82%, and 20.19%–25.06% of observed phenotypic variation, respectively. The most notable significant SNPs were located on chromosomes A02, A07, and C02, which were repeatedly detected and associated with RRL, RHL, and RFW simultaneously. Based on the rapeseed genome annotation of the linkage disequilibrium (LD) regions, we predicted 61 As resistance of candidate genes, among them,,,,,, and, were related to the heavy metal absorbing and transporting. With the results of qRT-PCR, theandwere obviously induced by As stress treatment in roots, hypocotyls and leaves, indicating that they were the important candidate genes related to As absorption and transport in. These results provide a reference for elucidating the regulation mechanism of candidate genes and improving agronomic traits inunder As stress.
L.; As stress resistance; genome-wide association studies (GWAS); candidate genes
2018-07-05;
2018-10-08;
2018-11-06.
10.3724/SP.J.1006.2019.84093
王瑞, E-mail: ruiwang71@163.com; 李加纳, E-mail: ljn1950@swu.edu.cn, Tel: 023-68250642
**同等贡献(Contributed equally to this work)
曲存民, E-mail: drqucunmin@swu.edu.cn; 马国强, E-mail: mgq12358@163.com
本研究由国家重点研发计划项目(2018YFD0100505), 国家自然科学基金项目(31401412, 31571701), 重庆市基础与前沿研究计划重点项目(cstc2015jcyjBX0001, cstc2016shms-ztzx80010, cstc2017jcyjAX0321), 国家现代农业产业技术体系建设专项(CARS-12), 111人才引智基地建设项目(B12006)和中央高校基本科研业务费专项资金(XDJK2016A005, XDJK2016B030)资助。
This study was supported by the National Key Research and Development Plan (2018YFD0100505), the National Natural Science Foundation of China (31401412, 31571701), Chongqing Basic Scientific and Advanced Technology Research (cstc2015jcyjBX0001, cstc2016shms- ztzx80010,cstc2017jcyjAX0321), the China Agriculture Research System (CARS-12), the 111 Project (B12006), and the Fundamental Research Funds for the Central Universities (XDJK2016A005, XDJK2016B030).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20181105.1326.018.html

