挥发性抑芽物质对马铃薯块茎萌芽的影响及其作用机制
邹 雪 丁 凡 余金龙 彭 洁 邓孟胜 王 宇 刘丽芳 余韩开宗 陈年伟 王西瑶,*
挥发性抑芽物质对马铃薯块茎萌芽的影响及其作用机制
邹 雪1,2丁 凡1余金龙1彭 洁2邓孟胜2王 宇2刘丽芳1余韩开宗1陈年伟1王西瑶2,*
1绵阳市农业科学研究院, 四川绵阳 621023;2四川农业大学农学院, 四川成都 611130
马铃薯块茎过早萌芽会降低商品价值, 本试验比较挥发性物质的抑芽效应, 并从转录和蛋白水平分析其作用机制。结果表明, 抑芽能力薄荷醇>樟脑>萘, 萌芽受抑降低代谢消耗, 薄荷醇处理180 d时的重量损失只有对照损失的36%。樟脑处理萌芽块茎3 d引起表达显著上调(或下调)的基因和蛋白分别有1227 (299)和296 (204)个, 主要参与响应刺激、防御反应。贮藏期间, 果胶代谢基因、、, 角质合成基因、、, 乙烯合成基因以及转录因子编码基因的表达量随时间升高。樟脑早期不同程度地刺激这些基因表达, 中后期则抑制, 49 d时只有对照的0.68%~23.35%。薄荷醇使上述基因表达保持低水平, 但可提高细胞周期负控基因的表达, 为对照的15.9倍。植物病原菌互作通路中的基因、-、表达受樟脑诱导并在后期高表达。樟脑和薄荷醇均能抑制生长发育基因的表达, 造成芽死亡, 降低贮藏损耗。前者早期能促进合成保护性物质, 萌芽时有更强烈的抗菌反应; 后者则阻碍细胞分裂。
马铃薯; 贮藏; 抑芽物质; 转录组; 蛋白组
马铃薯(L.)适应性强、产量稳定、营养全面, 既可菜用又能加工成薯条、薯片、面食等。种植马铃薯是贫困地区脱贫增收的有效保证, 至2016年在中国的种植面积已达581.51万公顷, 总产9912.24万吨, 均列世界第一(FAO, 2016)。与水稻、小麦、玉米等籽粒型作物的种子相比, 块茎水分含量高, 贮藏期相对较短。种薯过早萌芽会造成薯块老化, 减产10%~30%[1]; 菜用或加工用, 薯块过早萌芽则消耗水分和营养物质, 降低商品价值。调控块茎萌芽, 减少贮藏损耗, 延长贮藏期对产业健康发展至关重要。
不同基因型的块茎休眠期各异, 休眠过后则萌芽, 2~5℃冷藏在一定时间内可延长休眠期但不能阻止萌芽, 常需配合使用抑芽剂来最大限度地延长贮藏期。目前用于加工、鲜食类块茎贮藏的抑芽剂主要是化学试剂氯苯胺灵(3-氯氨基甲酸异丙基酯, CIPC)。虽然CIPC属低毒类物质, 但随着人们对食品安全的重视, 市场可接受度在下降, 并且从1962年商业化到现在已有50多年, 它的降解物以及对环境的交叉污染引起越来越多的担忧[2-3]。从植物挥发性物质中寻找使用方便、无毒的绿色新型抑芽物质延长块茎贮藏, 是解决这一问题的理想方式。研究表明, 从一些芳香植物中提取的精油对马铃薯块茎萌芽具有不同程度的抑制作用。薄荷(L.)、芫荽(L.)和尤加利(L.)精油处理马铃薯块茎10 d后均能不同程度地延缓发芽, 但后两种精油中含有的柠檬烯会引起薯块大量腐烂[4]。另有研究表明留兰香(L.)精油及其主要成分R-香芹酮能抑制马铃薯块茎发芽以及真菌和细菌活性[5-7]。1,4-二甲基萘是马铃薯休眠过程中自身产生的挥发性物质, 外源施用可抑制发芽, 但块茎表面残留量降低到1.4~2.7 mg kg–1时则会恢复发芽, 已证实该物质是通过提高细胞周期负控基因和的表达量, 阻碍细胞分裂, 从而抑制块茎发芽[8-10]。樟树叶中的主要成分樟脑(1,7,7-三甲基二环[2.2.1]庚烷-2-酮)对马铃薯块茎具有抑芽可逆效应, 分析块茎在休眠、萌芽、樟脑处理50 d及恢复萌芽4种状态下的转录组和蛋白组差异, 发现它并没有延长休眠状态, 而是使芽组织产生类似抵抗病原菌侵染的致死过程, 直接对芽造成损伤[11], 因处理时间过长, 并不清楚基因早期响应情况。
高通量测序技术(high-throughput mRNA sequencing, RNA-seq)是全面解析特定条件下基因表达变化的有效工具, 利用该技术共测得马铃薯休眠解除过程中的5912个差异表达基因, 其中生长素、赤霉素、细胞分裂素和油菜素内酯合成相关基因的过量表达占主导, 且伴随逆境响应和氧化还原调节[12]。同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantification, iTRAQ)是目前蛋白组学分析中应用效果较好的标记技术之一, 利用该方法从马铃薯块茎中鉴定出4453个蛋白, 在低温贮藏糖化过程中发现46个差异表达蛋白[13]。
本试验选用萘(1,4-二甲基萘的相似物)、樟脑、薄荷醇(2-异丙基-5-甲基环己醇, 薄荷精油主要成分) 3种挥发性物质处理马铃薯, 比较它们对块茎的抑芽效应; 同时, 用樟脑处理萌芽块茎3 d, 测定转录组和蛋白组, 挖掘早期响应的关键基因和蛋白; 根据组学分析, 结合基因表达量的变化幅度、基因的生物学意义和前人关于休眠和萌芽研究, 选择涉及细胞壁和表皮物质合成、植物病原菌互作等生理过程中的12个基因, 检测贮藏期间樟脑、薄荷醇处理对这些基因表达的影响。试验旨在确认具有潜在价值的抑芽物质, 初步认识其作用机制, 为马铃薯的绿色安全贮藏提供参考。
1 材料与方法
1.1 试验材料和试剂
马铃薯短休眠品种‘费乌瑞它’(Favorita)原原种, 由四川农业大学农学院马铃薯研究开发中心提供。2月底移栽试管苗于网室, 基质栽培, 于5月中下旬植株发黄时收获。
萘购自成都科龙化工试剂厂, 樟脑(纯度96%)、薄荷醇(纯度98%)购自Sigma-Aldrich。TRIzol购自Invitrogen, 反转录试剂盒RevertAid First Strand cDNA Synthesis购自Thermo。引物及荧光染料套装SGExcel FastSYBR Mixture购自生工生物工程(上海)股份有限公司。
1.2 试验设计
挑选新收原原种(约7~10 g 粒–1), 常温下愈伤化14 d后以200 g L–1的量装入8 L密封硬纸盒。根据初筛结果, 设萘(Naphthalene, NAP)、樟脑(Camphor, CAM)、薄荷醇(Menthol, MEN) 3种试剂的浓度为0.2 g L–1, 分别称取固体颗粒用纱布包裹置盒中(不与薯块直接接触), 以不作任何处理为对照(CK)。每处理5盒, 于(23±2)℃室内贮藏。从贮藏0 d起, 每隔15~20 d观察统计其中3盒薯块发芽情况并称重, 芽长超过2 mm即认为该薯块已解除休眠而萌芽。调查每盒20个薯块的芽长, 统计时以1盒为整体计算平均芽长和标准差(= 3)。贮藏0、7、21、35和49 d (此时CK的芽长多在2 mm)时, 从剩余2盒中分别取样冻存于–80℃用于1.4荧光定量检测, 樟脑和薄荷醇处理继续贮藏至70 d时取样。取样方式为, 以顶芽芽眼为中心, 用直径3 mm硬质塑料管打孔, 取从表皮起5 mm的圆柱体。
1.3 RNA-seq和iTRAQ测序及分析
如图1所示, 贮藏到对照块茎芽长1~2 mm时, 用0.2 g L–1樟脑处理3 d后取样, 以顶芽芽眼为中心, 取直径3 mm, 高5 mm的圆柱体, 以8个圆柱体提取1管RNA或蛋白, 为1个生物学重复, 各3重复, 送深圳华大基因科技服务有限公司和杭州景杰生物科技有限公司完成RNA-seq和iTRAQ测序分析, 将3次重复的RNA或蛋白等量混合后建库测序。
使用比对软件SOAPaligner/soap2将clean reads分别比对到马铃薯参考基因组和参考基因序列(http://potato.plantbiology.msu.edu/pgsc_download.shtml)[14], 以RPKM (Reads Per kb per Million reads)代表基因表达量, RPKM = (1,000,000×C)/(N×L×1000), 其中C为唯一比对到基因A的reads数, N为比对到所有参考基因的总reads数, L为基因A的碱基数[15]。使用Blastx将序列比对到KEGG、GO和NR数据库, 进行基因功能注释。对差异检验的-value作多重假设检验校正, 通过控制 FDR (False Discovery Rate)来决定-value的域值, 规定差异表达基因为倍数差异在2倍以上且FDR≤0.001。Gene Ontology功能显著性富集分析(GO分析)和Kyoto Encyclopedia of Genes and Genomes (KEGG) Pathway显著性富集分析同常规方法。规定蛋白丰度水平差异倍数大于1.3, 且经检验其值<0.05的蛋白为差异蛋白。在Gene Ontology数据库(http.//www.geneontology.org/)计算每个term的差异蛋白数目, 确定出差异蛋白显著富集的GO条目, Pathway的显著性分析同GO功能富集分析相似。将蛋白组和转录组作关联分析, 找出蛋白所关联到的基因, 即iTRAQ检测到的蛋白所对应的编码基因在RNA-seq水平也同样被检测到。设置差异蛋白和差异表达基因的筛选条件与前述相同, 进一步分析这些基因在iTRAQ和RNA-seq水平上的表达变化是否相同, 以及GO条目、代谢通路富集情况。

图1 用作转录组和蛋白组测序的处理方式
利用荧光定量验证测序结果准确性, 选择表1所示12个基因和、、等7个基因验证RNA-seq, 选择Transport protein Sec61、Heat shock protein 90-6、Protochlorophyllide reductase-like、TSI-1 protein、Glutathione S-transfera等5个蛋白的编码基因验证iTRAQ, 相关序列及引物参见文献[11], 基因序列http://solanaceae.plantbiology. msu.edu/cgi-bin/annotation_report.cgi参考文献[14]。RNA提取、荧光定量体系和计算方法参考文献[16]。
1.4 Real-time PCR检测贮藏期间基因表达变化
根据组学分析获得的差异基因和富集的代谢通路信息以及关于块茎萌芽的文献报道[10-11], 选择12个基因利用Oligo 6.0软件设计特异性引物(表1), RNA提取、荧光定量体系和计算方法同上。以贮藏0 d时的ΔCt值为对照, 将3次试验重复所提的3管RNA混合后反转录所得cDNA作3次荧光定量重复。
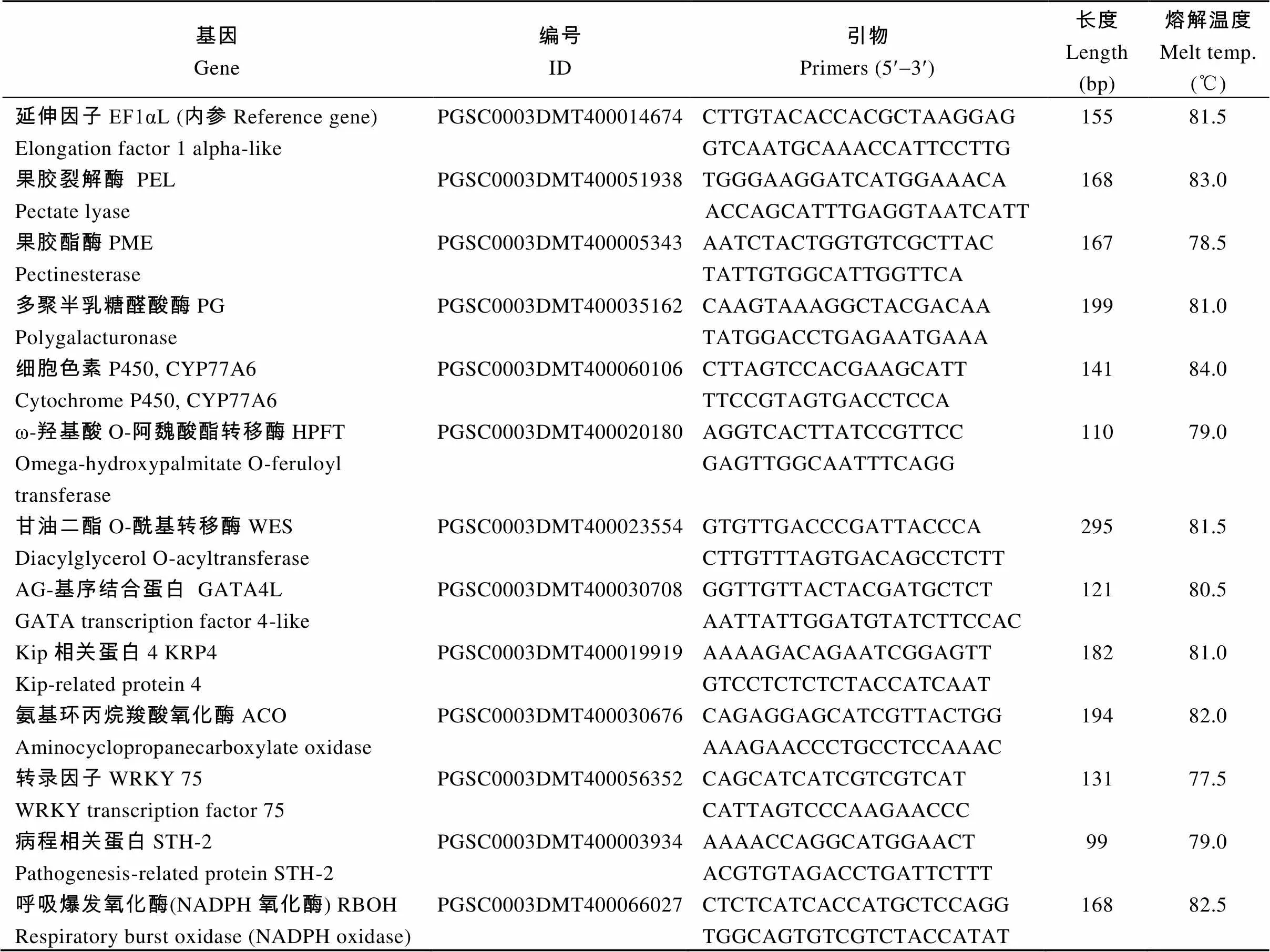
表1 试验选择基因的引物序列
2 结果与分析
2.1 抑芽能力对比
贮藏50 d时各处理差异明显, CK有70.90%长出约2 mm完整小芽, 萘处理长出分化不明显的畸形芽, 樟脑处理的芽顶端发黑坏死, 薄荷醇处理仅能见到内部死亡组织(图2)。80 d时CK的芽长已达14.29 mm, 而萘处理使芽生长受抑保持在2 mm左右, 樟脑处理的芽已全部死亡, 薄荷醇处理的薯块在整个贮藏期间均无芽生长(表2)。据此得出抑芽能力为薄荷醇>樟脑>萘。
贮藏期间块茎的重量损失包括呼吸消耗、水分利用和散失等。休眠期间块茎重量损失小且各处理间差异不大, 随着对照萌芽和芽生长对营养物的消耗, 重量损失明显, 180 d时已达22.78% (表2)。3种物质对芽有不同程度的抑制作用, 减少了物质消耗, 使重量损失变缓。180 d时抑芽能力最强的是薄荷醇, 其损失率约只有对照的1/3, 具有延长块茎贮藏期的潜力。

图2 贮藏50 d时各处理的抑芽作用比较
CK: 对照; NAP: 萘处理; CAM: 樟脑处理; MEN: 薄荷醇处理。
CK: control; NAP: naphthalene treatment; CAM: camphor treatment; MEN: menthol treatment.

表2 贮藏期间各处理的平均芽长及块茎重量损失
表中数据为平均值±标准差, 采用新复极差法进行多重比较, 同一列标注不同大小写字母的值分别在0.01和0.05水平上差异显著, 缩写同图2。
Data in the table are mean ± SD, values followed by different capitals or lowercases within the same column are significantly different at the 0.01 or 0.05 probability levels according to Duncan’s multiple comparison; the abbreviations are the same as those given in Fig. 2.
2.2 差异表达基因和蛋白分析
由上述结果可知, 3种物质均对芽的生长具有直接抑制效应, 萘的作用较弱, 薄荷醇的致死效应则太强, 所以选择樟脑作进一步研究。芽长1~2 mm是块茎解除休眠萌芽的标志, 前期体视镜检表明直接处理萌芽块茎3 d造成顶端褐化, 说明芽开始受抑制, 试验检测此时的mRNA和蛋白变化, 以探寻樟脑抑芽效应早期在分子层面的影响。通过RNA-seq检测到23,553个基因, 其中有1227个基因表达显著上调, 299个显著下调; 用iTRAQ鉴定出2510个蛋白, 处理共造成296个蛋白显著上调, 204个显著下调。
2.2.1 qRT-PCR验证测序结果 为验证RNA-seq测序结果的可靠性, 选择19个基因进行qRT-PCR, 由图3可知, 两种方式检测到基因表达变化趋势相似, 相关系数达0.9260**, 说明RNA-seq获得的基因表达信息具有较高的准确性和可信度。但qRT-PCR验证iTRAQ的蛋白表达则不一致, 有2个基因的表达变化趋势在转录和蛋白层面上出现相反情况(结果未列出)。推测蛋白合成、加工修饰滞后于mRNA转录, 两者在时间和空间上的差异造成变化趋势的不同步, qRT-PCR不适合用于验证iTRAQ。

图3 荧光定量验证转录组测序
2.2.2 差异表达基因和蛋白的GO、KEGG分析
Gene Ontology(GO)是一个国际标准化的基因功能分类体系, 分为生物过程(biological process, BP)、细胞组成(cellular component, CC)和分子功能(molecular function, MF)。将差异基因和蛋白通过GO富集分析, 在1526个差异表达基因中, 分别有712、622和780个被注释到BP、CC和MF条目中, 而差异蛋白则分别注释到289、129和361个。通过RNA-seq技术找出的差异基因编码蛋白显著富集的GO条目(<0.05)表明, 差异蛋白主要在膜和细胞周围, 具有氧化还原酶活性、糖基转移酶活性、铁离子结合等功能, 主要参与响应刺激、胁迫、防御反应等过程。与转录组信息相比, 蛋白组可提供更下游的信息, 即直接起作用或受影响的蛋白。差异蛋白在细胞器内膜、线粒体内膜、染色体等多个部位均有分布。与转录组结果相似, 这些蛋白具有氧化还原酶活性、磷酸转移酶活性, 同样参与响应刺激、胁迫和防御反应。转录和蛋白水平都表明樟脑引起了芽响应刺激、胁迫和防御反应, 从分子水平上证明仅处理3 d即对芽产生了不利影响(图4)。
通过KEGG分析, 差异表达基因共富集到113个代谢通路, 其中18个达显著水平(<0.05), 表3列出了前10个通路。除次生代谢物生物合成外, 植物病原菌互作通路富集的基因最多, 其中的病程相关蛋白STH-2、PR2和转录因子WRKY75在mRNA和蛋白水平都升高。谷胱甘肽代谢通路富集的24个基因中, 有 22个均编码谷胱甘肽S-转移酶并上调表达, 已知谷胱甘肽作为生物体内的一种重要抗氧化剂, 其主要作用是清除自由基, 保护蛋白质和酶等分子中的巯基, 相关酶的mRNA上调可以合成更多的抗氧化物质。二苯乙烯、黄酮类化合物等植物次生代谢产物具有抗氧化、抑菌等多种生理活性[17]。本试验中, 樟脑处理使上调表达基因显著富集到异黄酮、二苯乙烯类、黄酮和黄酮醇的生物合成通路, 相关基因如大豆异黄酮7-O-葡糖基转移酶基因、类黄酮3’-单加氧酶基因、反式白藜芦醇-di-O-甲基转移酶基因的表达均极显著升高。由此推测块茎首先通过促进合成不同种类的保护性物质, 缓解处理引起的活性氧紊乱来应对胁迫。

图4 樟脑处理的差异表达基因和蛋白的显著GO富集
iTRAQ测得的差异蛋白显著富集到8个代谢通路, 核糖体(ko03010)、苯丙素生物合成(ko00940)、过氧化物酶体(ko04146)等与保护性次生物质合成、抗氧化相关通路中的蛋白上升, 而参与正常生理功能的泛素介导蛋白水解(ko04120)、内质网蛋白质加工(ko04141)等通路中的蛋白下降, 说明处理3 d已影响到正常的蛋白代谢和生理功能。
2.2.3 差异蛋白和mRNA关联分析 将iTRAQ检测到的2510个蛋白在转录组中进行关联分析, 其中458个差异蛋白对应的mRNA没有显著变化, 32个变化一致, 10个变化相反, 还有78个仅在mRNA水平变化, 也说明通过RNA-seq检测到的1526个显著表达变化的mRNA中, 仅有42个对应的蛋白变化, 其余蛋白则没有变化或没有检测到。
在两水平变化趋势相同的基因主要参与响应逆境、刺激、氧化胁迫、过氧化氢分解代谢、防御反应等生物过程, 发挥过氧化物酶活性、抗氧化活性、氧化还原活性等功能(图5)。关联基因的KEGG分析表明, 樟脑短期处理主要引起苯丙素生物合成(ko00940)通路中的多数基因表达上调, 相关蛋白升高。已知苯丙素生物合成的代谢产物包括木质素合成所需单体, 如香豆醇、松泊醇、5-羟基松柏醇、芥子醇, 而木质素是保护植物体的第一道防线表皮和细胞壁的重要组成物质。樟脑处理芽3 d使这些物质合成的酶表达量升高, 有利于表皮的合成和修复, 推测是前期抵抗外源侵害的重要响应方式之一。
2.3 贮藏期间抑芽物质对关键基因表达的影响
根据差异基因的变化幅度和主要富集的代谢通路信息, 选择参与保护性物质合成、生长发育、植物病原菌互作的基因12个, 检测它们在樟脑、薄荷醇处理下随贮藏时间的变化模式, 进一步明确两种抑芽物质的作用效应。
2.3.1 参与细胞壁代谢、表皮物质合成基因的表达
果胶是植物细胞壁的主要构成物质, 果胶裂解酶(PEL)、果胶酯酶(PME)和多聚半乳糖醛酸酶(PG)参与果胶代谢, 从而导致胞壁降解, 细胞分离, 组织软化。已知果实成熟过程中这些基因的表达量和酶活性显著升高, 使果实软化。块茎贮藏过程中、表达量随贮藏时间升高, 并在萌芽时达到最高值, 分别为0 d时的94、85、133倍(图6), 说明块茎休眠解除过程伴随薯肉贮藏细胞的胞壁软化, 推测这更利于物质运输和营养供给。
樟脑处理下, 这3个基因的表达量在前期呈波动变化, 随着块茎解除休眠萌芽, 樟脑处理抑芽的同时使得这些基因的表达水平远低于同期对照, 49 d时只有同期对照的1.77%、18.19%和15.17%, 但都高于0 d的表达量。说明樟脑处理使芽的生长受抑, 对贮藏细胞的营养需求减少, 因此参与胞壁软化的基因表达量在贮藏中后期没有急剧上升。薄荷醇处理下, 除在21 d时升至对照同等水平外, 其余时期各基因的表达量均保持极低水平, 49 d时与仍处于休眠期的4℃贮藏块茎的表达量相似。

图5 转录组和蛋白组表达模式相同的基因GO富集
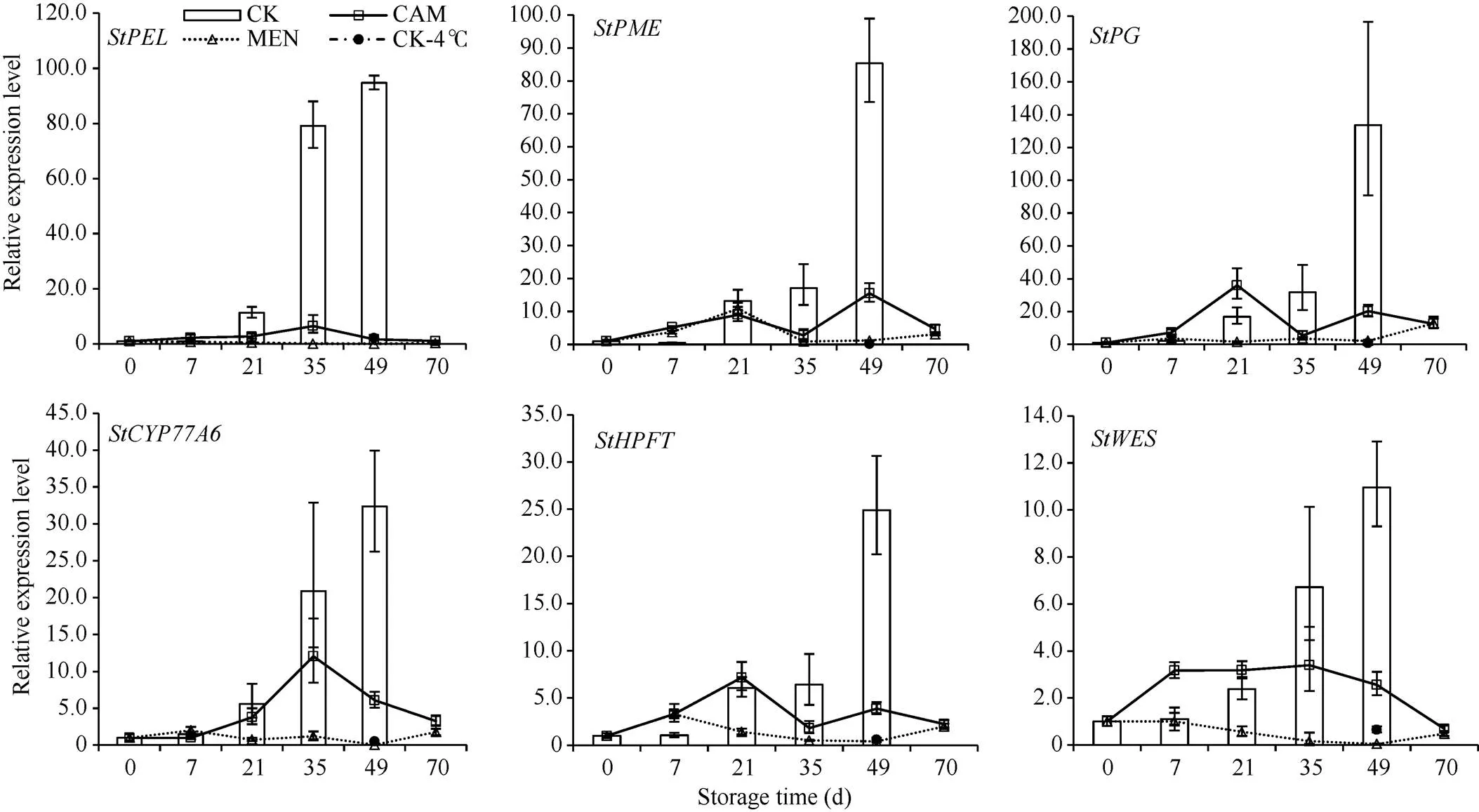
图6 抑芽物质对果胶代谢、角质、木栓和蜡质合成相关基因表达的影响
CK: 对照; CAM: 樟脑处理; MEN: 薄荷醇处理; CK-4℃: 对照4℃冷藏; 误差线为3个重复值的标准差。
CK: control; CAM: camphor treatment; MEN: menthol treatment; CK-4℃: control tuber storage at 4℃; the error line was the standard deviation of three repeated values.
新生芽表皮角质层的形成对于防止水分散失和抵御外界胁迫至关重要, 角质层由角质、木栓、蜡质组成。、、基因参与形成角质、木栓和蜡质。由图6可知, 这3个基因在贮藏期间的变化趋势仍是升高, 特别在贮藏后期即休眠解除芽形成时。樟脑处理在早期引起这些基因表达量升高且高于同期对照, 7 d时和的表达量是同期对照的3.17倍和2.88倍, 但随时间增加, 这些基因的表达量没有继续升高, 而是保持不变或下降, 在35 d之后均低于同期对照。薄荷醇处理下, 除在7 d外整个贮藏期间都与0 d时的表达量相似或更低。推测樟脑、薄荷醇处理在早期不同程度地刺激这些基因的表达上调, 以促进保护层物质合成, 抵抗外界胁迫, 但随时间增加, 细胞结构受到破坏, 影响了这些物质合成, 继而加剧了芽死亡。
2.3.2 生长发育相关基因表达模式分析 由图7可知, 转录因子GATA4L的编码基因表达量随贮藏时间呈线性上升, 两者的相关系数达0.9450, 说明它与块茎休眠解除和萌芽密切相关。樟脑处理除35 d外其余时间点的表达量与0 d的相似, 而薄荷醇处理则更强烈地抑制该基因表达, 整个贮藏期间都只有0 d时的2%~8%。
1-氨基环丙烷-1-羧酸氧化酶ACO是乙烯形成的关键酶, 随块茎休眠的解除表达量升高, 到萌芽时为0 d的114倍(图7)。樟脑处理刺激该基因表达量提早升高, 7 d时达到同期对照的8.58倍, 但之后没有进一步上升, 随着对照表达量上升而低于同期对照, 到49 d时只有对照的1.65%。而无发芽迹象的薄荷醇处理中,的表达量始终保持在低水平。

图7 抑芽物质对生长相关基因表达的影响
各处理的缩写同图6; 误差线为3个重复值的标准差。
The abbreviations of different treatments are the same as those given in Fig. 6; the error line was the standard deviation of three repeated values.
KRPs是细胞周期蛋白激酶抑制子, 负调控细胞分裂。尽管樟脑抑制萌芽, 但和对照相比,基因表达量在贮藏期间相近, 都呈下降趋势, 在49 d时的表达量均下降到0 d时的1/10。薄荷醇处理使该基因表达量显著升高, 在各时间点均高于同期对照(1.6~15.9倍)。随着细胞分裂负控基因的表达下降, 分生组织细胞分裂加快使休眠解除而萌芽, 推测薄荷醇通过提高的转录本, 起到阻碍细胞分裂抑制萌芽的作用。
2.3.3 植物病原菌互作相关基因表达模式分析
前述分析表明差异表达基因和蛋白参与防御反应, 选择植物病原菌互作通路中的3个基因, 分析它们在贮藏期间的表达变化特点。转录因子WRKY75传递MPK4信号, 诱导防御相关基因表达,75的表达在前期受樟脑和薄荷醇诱导, 21 d时分别升高至0 d的22.53倍和12.23倍, 但在21 d后薄荷醇处理的75表达量下降并一直保持低水平, 而樟脑处理的75表达量则在49 d时升高到0 d的100.55倍。STH-2属病程相关蛋白(PRP), 本试验中转录本在贮藏期间无明显变化, 但樟脑处理刺激该基因上调表达, 7 d 即达到0 d时的5.76倍, 在49 d块茎萌芽时的表达量增到0 d的343倍, 薄荷醇处理对该基因也有一定诱导作用但不如樟脑的明显。呼吸氧爆发氧化酶RBOH在互作通路中受钙调蛋白激酶激活, 产生活性氧, 引起过敏反应, 应答外界胁迫[18]。在贮藏中、后期表达量升高并伴随块茎休眠解除, 49 d萌芽时为0 d的6.87倍; 樟脑处理能刺激该基因上调表达, 在各时间点均高于同期对照, 49 d时达到最高值; 薄荷醇处理的最高值出现在第7天, 为0 d的17.76倍之后下调并保持较低水平(图8)。可以看出这3个基因在贮藏期间均受樟脑诱导表达, 并且都在块茎萌芽时达到最高值, 说明相对于休眠块茎, 这些基因更多地参与代谢更活跃的萌芽阶段对胁迫的响应, 随着芽死亡回到低水平。与樟脑不同的是, 薄荷醇能诱导基因在休眠期高表达, 说明休眠期的块茎可能受到薄荷醇较大的刺激作用。

图8 抑芽物质对植物病原菌互作相关基因表达的影响
各处理的缩写同图6; 误差线为3个重复值的标准差。
The abbreviations of different treatments are the same as those given in Fig. 6; the error line was the standard deviation of three repeated values.
3 讨论
樟脑具有杀虫、消肿、止痛等多种医疗作用, 目前尚无在植物抑芽方面的研究; 薄荷醇可用作饮料和糖果等的赋香剂, 2003年首次发现它对离体芽有抑制作用, 但没有后续研究和应用[19]。本试验表明, 这两种物质都能抑制块茎萌芽, 而马铃薯自身的抑芽物质1,4-二甲基萘的相似物萘的抑芽能力则相对较弱。樟脑对块茎的抑芽效应可逆, 具有应用于种薯潜力; 薄荷醇的抑芽能力更强, 它本身也用于食品, 相对更安全, 具有用于商品薯贮藏的潜力。本试验采用自然挥发的处理方式, 所需试剂浓度较高, 下一步可通过雾化、熏蒸等方法, 增强试剂本身的附着效率来降低使用浓度以减少成本。
樟脑长期处理薯块(50 d)主要引起与生长发育组织构成相关的基因下调表达[11]。本试验中, 樟脑处理芽3 d引起的上调基因居多, 它们具有合成保护性物质和抗氧化功能, 主要参与防御反应、响应逆境胁迫。上述对比表明, 在与抑芽物质接触早期, 芽组织积极应对胁迫, 而后期芽组织已受侵害甚至死亡, 生长发育相关基因表达下调。无论是休眠还是萌芽阶段, 植物病原菌互作通路中的病程相关蛋白STH2、PR2、转录因子WRKY75等的编码基因表达量都受樟脑诱导表达, 但萌芽阶段的表达量最高, 说明这些基因更多地参与代谢更活跃的萌芽阶段对胁迫的响应。关联分析除了找到蛋白与mRNA变化相同的32个基因, 多数基因表现出变化不同步现象, 在以qRT-PCR验证蛋白测序结果时也发现两者变化不同步, 这与马进等[20]以qRT-PCR验证iTRAQ不符的情况相同。拟南芥的天冬氨酸蛋白酶猪笼草蛋白酶基因在不同组织如叶片、茎、种子和豆荚均有表达, 认为这类蛋白涉及多种功能如细胞程序性死亡、蛋白前体加工、病害和逆境抗性、叶片衰老等[21]。本试验中天冬氨酸蛋白酶猪笼草蛋白酶1转录下调而蛋白升高, 推测上述现象是转录和翻译在时间上不同步, 蛋白后期加工修饰造成了其变化滞后于转录应答, 使得mRNA变化已趋于平稳或下调后, 蛋白水平才上调以抵抗外界胁迫。
乙烯是植物的内源激素之一, 在调节衰老、果实成熟以及器官脱落等过程中发挥促进作用[22]。Coleman和Dioxide[23]研究表明外源乙烯能降低块茎的脱落酸含量, 促进休眠的解除, Hartmann等[24]研究证实休眠块茎分生组织活化与生长素及乙烯信号转导、细胞周期调控等的转录变化密切相关。将乙烯和典型的催芽剂赤霉素共同处理马铃薯促进长休眠品种萌芽[25]。本试验证实块茎贮藏过程伴随乙烯合成关键酶基因表达量的百倍增加, 从mRNA水平验证乙烯合成是块茎解除休眠所经生理过程。乙烯可启动果实代谢发生质的变化, 如淀粉水解为糖、多聚半乳糖醛酸酶含量上升引起的组织软化、香气成分的合成等, 是果实成熟的重要启动因子。用乙烯处理芒果、玫瑰花等均观察到基因转录本增加和酶活性升高及果胶增溶现象[26-27]。马铃薯块茎休眠解除过程与果实成熟有相似之处, 两者都涉及淀粉的降解, 贮藏细胞胞壁的软化和分解等。本试验中乙烯合成关键酶和果胶降解酶表达量都随着贮藏时间而升高, 推测块茎休眠解除过程中合成乙烯并促进胞壁降解相关酶的基因表达, 加快营养物质运输, 这可能也是贮藏后期薯肉软化的原因之一。樟脑和薄荷醇处理抑制了这些基因的表达使块茎细胞壁在贮藏期间保持更好地完整性, 有效降低水分散失和保持薯块硬度。
属GATA转录因子家族, 已知拟南芥GATA家族成员有29个, 参与种子萌发、下胚轴伸长、叶序和花器官起始、开花和衰老等生理功能[28]。基因与拟南芥GATA家族中的、相似性最高, 但它们编码的氨基酸序列相似性也仅有50%。则能介导油菜素内酯和光信号的相互交流, 参与形态建成[29]。通过融合抑制子基因沉默技术抑制下游靶基因转录, 转基因拟南芥在缺氮胁迫下有更高的根毛密度和健壮的地上部, 认为参与根系发育[30]。本试验中表达量与块茎生理状态的转变密切相关, 它在块茎萌芽中的作用以及在功能上是否与拟南芥有相似性还需要进一步研究。KRPs通过抑制活化的CYCD-CDKA复合物, 阻碍细胞分裂由G1期向S期的过渡[31]。提高KRPs表达会造成生长缓慢、器官变小、结实下降; 反之则植株器官、种子变大[32-33]。Campbell等[10]利用芯片和定量RT-PCR证实马铃薯产生的挥发性抑芽物1,4-二甲基萘是通过增加和的转录本阻碍细胞分裂达到抑芽效果的。本试验中薄荷醇处理同样提高了的转录本, 并表现出较强抑芽作用, 推测两者有相似的作用机制。
低浓度晚疫病菌孢子侵染时马铃薯STH-2蛋白在抗病品种中的升高速度快于感病品种, 积累量也高于后者, 将其归为病程相关蛋白PRP, 但通过转基因技术过量表达该基因并不能增强植株的晚疫病抗性, 但可提高马铃薯细胞对盐和渗透胁迫的耐性[34-36]。最近的研究表明青枯病菌侵染时, STH-2蛋白在抗病品种中大量积累[37]。上述研究说明STH-2参与马铃薯生物和非生物胁迫反应, 但具体功能和作用方式仍不清楚。本试验中, 樟脑处理不仅引起萌芽块茎STH-2转录本和蛋白水平极大的升高, 同时植物病原菌互作通路中的病程相关蛋白PR2、转录因子WRKY75等108个基因转录水平也升高, 推测该处理引起块茎产生与抵抗病菌侵染相似的应答。
通过上述分析, 认为樟脑处理首先引起防御反应, 使角质、蜡质等表皮保护层物质和黄酮、谷胱苷肽等抗菌、抗氧化物质合成相关基因的表达上调, 抵抗逆境胁迫; 随着樟脑处理伤害的加剧, 这些物质合成基因的表达下降, 与生长发育相关基因的表达受抑, 但植物病原菌互作通路中的各基因表达量进一步升高, 引起与抵抗病原菌侵染相似的应激反应, 芽逐渐坏死(图9)。薄荷醇处理的变化模式较为单一, 在整个贮藏期间表达量都较低, 除了引起和基因的表达量呈现出不同于樟脑处理的升高, 说明它和樟脑的抑芽机制不同。推测它对细胞周期蛋白的抑制作用是阻止块茎萌芽的重要原因, 而涉及的其他响应基因和生理过程, 还需进一步研究。

图9 樟脑作用于块茎引起的响应模式推测
实线箭头: 处理与同期对照相比上调; 虚线箭头: 处理与同期对照相比下调, 箭头粗细代表变化程度。
Solid arrows: expression levels up-regulated compared with control; dotted arrows: expression levels down-regulated compared with control, the size of the arrow represented the degree of variability.
4 结论
樟脑和薄荷醇均能抑制生长发育相关基因的表达, 使萌发的芽死亡, 降低贮藏损耗。樟脑处理早期引发防御反应, 上调表达参与角质、抗氧化、抗菌等保护性物质合成的基因; 萌芽时造成与抵抗病原菌相似的强烈互作。薄荷醇提高表达阻碍细胞分裂是分生组织坏死的原因之一。
[1] 肖关丽, 郭华春. 不同生理年龄马铃薯种薯芽中的内源激素含量变化及其对马铃薯植株生长发育的影响. 植物生理学报, 2007, 43: 818–820. Xiao G L, Guo H C. Changes in endogenous hormone contents in bud of seed potato (L.) with different physiological ages and its effect on growth and development., 2007, 43: 818–820 (in Chinese with English abstract).
[2] Daniels-Lake B J, Pruski K, Prange R K. Using ethylene gas and chlorpropham potato sprout inhibitors together., 2011, 54: 223–236.
[3] Vijay P, Ezekiel R, Pandey R. Use of CIPC as a potato sprout suppressant: health and environmental concerns and future options., 2018, 10: 17–24.
[4] Gómez-Castillo D. Effects of essential oils on sprout suppression and quality of potato cultivars., 2013, 82: 15–21.
[5] Hartmans K J. The use of carvone in agriculture: sprout suppression of potatoes and antifungal activity against potato tuber and other plant diseases., 1995, 4: 3–13.
[6] Oosterhaven K, Poolman B, Smid E J. S-carvone as a natural potato sprout inhibiting, fungistatic and bacteristatic compound., 1995, 4: 23–31.
[7] Teper-Bamnolker P, Dudai N, Fischer R, Belausov E, Zemach H, Shoseyov O, Eshel D. Mint essential oil can induce or inhibit potato sprouing by differential alteration of apical meristem., 2010, 232: 179–186.
[8] Weerd J W, Thornton M K, Shafii B. Sprout suppressing residue levels of 1,4-dimethylnaphthalene (1,4DMN) in potato cultivars., 2010, 87: 434–445.
[9] Campbell M A, Gleichsner A, Alsbury R, Horvath D, Suttle J. The sprout inhibitors chlorpropham and 1,4-dimethylnaphthalene elicit different transcriptional profiles and do not suppress growth through a prolongation of the dormant state., 2010, 73: 181–189.
[10] Campbell M A, Gleichsner A, Hilldorfer L, Horvath D, Suttle J. The sprout inhibitor 1,4-dimethylnaphthalene induces the expression of the cell cycle inhibitors KRP1 and KRP2 in potatoes., 2012, 12: 533–541.
[11] Li L Q, Zou X, Deng M S, Peng J, Huang X L, Lu X, Fang C C, Wang X Y. Comparative morphology, transcription, and proteomics study revealing the key molecular mechanism of camphor on the potato tuber sprouting effect., 2017, 18: 2280.
[12] Liu B L, Zhang N, Wen Y K, Jin X, Yang J W, Si H J, Wang D. Transcriptomic changes during tuber dormancy release process revealed by RNA sequencing in potato., 2015, 198: 17–30.
[13] Yang Y, Qiang X, Owsiany K, Zhang S, Thannhauser T W, Li L. Evaluation of different multidimensional LC-MS/MS pipelines for isobaric tags for relative and absolute quantitation (iTRAQ)- based proteomic analysis of potato tubers in response to cold storage., 2011, 10: 4647–4660.
[14] The Potato Genome Sequencing Consortium. Genome sequence and analysis of the tuber crop potato., 2011, 475: 189–195.
[15] Mortazavi A, Williams B A, McCue K, Schaeffer L, Wold B. Mapping and quantifying mammalian transcriptomes by RNA-Seq., 2008, 5: 621–628.
[16] 邹雪, 邓孟胜, 李立芹, 余金龙, 丁凡, 黄雪丽, 彭洁, 帅禹, 蔡诚诚, 王西瑶. 油菜素内酯合成和信号转导基因在马铃薯块茎贮藏期间的表达变化及对萌芽的影响. 作物学报, 2017, 43: 811–820. Zou X, Deng M S, Li L Q, Yu J L, Ding F, Huang X L, Peng J, Shuai Y, Cai C C, Wang X Y. Expression changes of genes related to brassinosteroid biosynthesis and signal transduction during potato storage and its effect on tuber sprouting., 2017, 43: 811–820 (in Chinese with English abstract).
[17] Dixon R A. Natural products and plant disease resistance., 2001, 411: 843–847.
[18] Kobayashi M, Ohura I, Kawakita K, Yokota N, Fujiwara M, Shimamoto K, Doke N, Yoshioka H. Calcium-dependent protein kinases regulate the production of reactive oxygen species by potato NADPH oxidase., 2007, 19: 1065–1080.
[19] Baydar H, Karadoğan T. The effects of volatile oils onpotato sprout growth., 2003, 46: 1–8.
[20] 马进, 郑钢, 裴翠明, 张振亚. 基于iTRAQ质谱分析技术筛选南方型紫花苜蓿根部响应盐胁迫差异表达蛋白. 农业生物技术学报, 2016, 24: 497–509. Ma J, Zheng G, Pei C M, Zhang Z Y. Screening differentially expressed proteins in southern type alfalfa (‘Millenium’) root upon salt stress by iTRAQ protein mass spectrometry., 2016, 24: 497–509 (in Chinese with English abstract).
[21] Takahashi K, Niwa H, Yokota N, Kubota K, Inoue H. Widespread tissue expression of nepenthesis-like aspartic protease genes in., 2008, 46: 724–729.
[22] 李合生. 现代植物生理学(第3版). 北京: 高等教育出版社, 2012. pp 245–246. Li H S. Modern Plant Physiology,3rd edn. Beijing: Higher Education Press, 2012. pp 245–246 (in Chinese).
[23] Coleman W K, Dioxide C. Oxygen and ethylene effects on potato tuber dormancy release and sprout growth., 1998, 82: 21–27
[24] Hartmann A, Senning M, Hedden P, Sonnewald U, Sonnewald S. Reactivation of meristem activity and sprout growth in potato tubers require both cytokinin and gibberellin., 2011, 155: 776–796.
[25] Külen O, Stushnoff C, Davidson R D, Holm D G. Gibberelllic acid and ethephon alter potato minituber bud dormancy and improve seed tuber yield., 2011, 88: 167–174.
[26] Amita C, Sane V A, Nath P. Differential expression of pectate lyase during ethylene-induced postharvest softening of mango (var. Dashehari)., 2006, 128: 546–555.
[27] Singh A P, Pandey S P, Rajluxmi, Pandey S, Nath P, Sane A P. Transcriptional activation of a pectate lyase gene,, during petal abscission in rose.2011, 60: 143–148.
[28] Ranftl Q L, Bastakis E, Klermund C, Schwechheimer C. LLM- domain containing B-GATA factors control different aspects of cytokinin-regulated development in., 2016, 170: 2295–2311.
[29] Luo X M, Lin W H, Zhu S W, Zhu J Y, Sun Y, Fan X Y, Cheng M L, Hao Y Q, Oh E, Tian M M, Liu L J, Zhang M, Xie Q, Chong K, Wang Z Y. Integration of light- and brassinosteroid-signaling pathways by a GATA transcription factor in., 2010, 19: 872–883.
[30] Shin J M, Chung K M, Sakamoto S, Kojima S, Yeh C M, Ikeda M, Mitsuda N, Ohme-Takagi M. The chimeric repressor for the GATA4 transcription factor improves tolerance to nitrogen deficiency in Arabidopsis., 2017, 34: 151–158.
[31] Leene J V, Hollunder J, Eeckhout D, Persiau G, Slijke E V D, Stals H. Targeted interactomics reveals a complex core cell cycle machinery in., 2010, 6: 397.
[32] Sang E J, Yoko O, Jaesung N, Masaaki U, Gyung-Tae K. Kip-related protein 3 is required for control of endoreduplication in the shoot apical meristem and leaves of., 2013, 35: 47–53.
[33] Cheng Y, Cao L, Wang S, Li Y P, Shi X Z. Downregulation of multiple CDK inhibitorgenes upregulates the E2F pathway and increases cell proliferation, and organ and seed sizes in., 2013, 75: 642–655.
[34] Constabel C P, Brisson N. The defense-relatedgene product of potato shows race-specific accumulation after inoculation with low concentrations ofzoospores., 1992, 188: 289–295.
[35] Constabel C P, Bertrand C, Brisson N. Transgenic potato plants overexpressing the pathogenesis-relatedgene show unaltered susceptibility toand potato virus X., 1993, 22: 775–782.
[36] El-Banna A, Hajirezaei M R, Wissing J, Ali Z, Vaas L, Heine-Dobbernack E, Jacobsen H J, Schumacher H M, Kiesecker H. Over-expression of PR-10a leads to increased salt and osmotic tolerance in potato cell cultures., 2010, 150: 277–287.
[37] Park S, Gupta R, Krishna R, Kim S T, Lee D Y, Hwang D J, Bae S C, Ahn I P. Proteome analysis of disease resistance againstin potato cultivar CT206-10., 2016, 32: 25–32.
Suppression mechanism of volatile sprout-inhibitors on potato tuber sprouting
ZOU Xue1,2, DING Fan1, YU Jin-Long1, PENG Jie2, DENG Meng-Sheng2, WANG Yu2, LIU Li-Fang1, YU-HAN Kai-Zong1, CHEN Nian-Wei1, and WANG Xi-Yao2,*
1Mianyang Academy of Agricultural Sciences, Mianyang 621023, Sichuan, China;2College of Agronomy, Sichuan Agricultural University, Chengdu 611130, Sichuan, China
Tuber sprouting losses commercial value. In this experiment, the sprout inhibition abilities of naphthalene, camphor, menthol were researched and the acting mechanism by RNA-seq, iTRAQ was explained. The inhibition abilities showed a trend of menthol > camphor > naphthalene. The metabolic consumption was reduced due to sprouting inhibition and the tuber weight loss of menthol treatment was only 36% of the control loss in 180 days storage. Compared with the control, about 1227 (299) and 296 (204) genes and proteins whose expression levels were significantly up-regulated (or down-regulated) were detected respectively in sprouting tuber with camphor treatment for three days. Those genes and proteins mainly involved in response to stimulus and defense response. Transcripts of,,related to pectin degradation,,,related to cutin synthesis,related to synthesis of ethylene, andcoding transcription factor were upward with dormancy release during storage. Relative expression of those genes was stimulated at different degrees in camphor treatment at the early stage, but significantly inhibited at the middle and late stages, showing 0.68%–23.35% of the control expression at 49 days. Menthol treatment maintained these genes with low level expression in tuber, but significantly increased the expression of cell cycle inhibitor geneto 15.9 times of control. Camphor treatment increased transcripts of genes,-,participating in plant-pathogen interaction pathway to the highest levels at sprouting stage. Therefore, we can conclude that camphor and menthol suppress the growth and development of sprouting tuber, eventually kill the bud and reduce the tuber weight loss during storage. Camphor treatment promotes the biosynthesis of protective substances to resist stress at the early stage and strengthen the resistance to pathogen infection at the sprouting stage; menthol treatment prevents bud sprouting by increasingexpression to inhibit cell division.
potato; storage; sprout-inhibitors; transcriptome; proteome
2018-04-29;
王西瑶, E-mail: wxyrtl@163.com
E-mail:zou_xue_2008@aliyun.com
2018-08-20;
2018-09-26.
10.3724/SP.J.1006.2019.84063
本研究由四川省科技厅公益性育种攻关项目(2016NYZ0032)和绵阳市农业科学研究院创新基金项目(cxjj462016-2019)资助。
This study was supported by the Breeding Program for Public Welfare of Science & Technology Department of Sichuan Province (2016NYZ0032), and the Innovation Fund of Mianyang Academy of Agricultural Sciences (cxjj462016-2019).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180921.1036.002.html

