RKIP对前列腺癌PC3细胞侵袭、转移的影响及机制
赵鹏程,杨 栋,任 乐,何朝宏
(河南省肿瘤医院,郑州大学附属肿瘤医院泌尿外科,河南郑州 450003)
前列腺癌是常见的男性生殖系统恶性肿瘤之一[1],西方发达国家前列腺癌的发病率和死亡率较高,据文献资料统计,2013年美国前列腺癌新增病例约为24万、死亡人数约为3万人,2012年我国肿瘤登记地区前列腺癌的发病率为9.92/10万,居于男性恶性肿瘤的第6位[2],还有研究表明,预计到2050年前列腺癌的发病率将增加2.5倍[3],严重威胁男性患者身体健康和生命安全。前列腺癌具有远端转移和浸润生长的特性,严重影响患者的生存率,因此,采取有效的措施抑制癌细胞的侵袭和转移是治疗前列腺癌的重要环节。Raf激酶抑制蛋白(Raf kinase inhibitory protein,RKIP)是一种肿瘤转移抑制基因[4],有研究表明,RKIP与子宫内膜癌的转移密切相关[5]。然而,RKIP对前列腺癌细胞侵袭、转移的影响及相关机制的研究还较少,本研究以人前列腺癌细胞系PC3为研究对象,探究RKIP对前列腺癌细胞侵袭、转移及磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K)/苏氨酸蛋白激酶(threonine protein kinase,Akt)/核转录因子(nuclear transcription factor-kB,NF-kB)通路的影响。
1 材料与方法
1.1材料
1.1.1组织标本及细胞系 随机选取2015年5月至2017年5月在河南省肿瘤医院行根治性切除术的前列腺癌组织标本及对应癌旁前列腺组织标本各103例,术后经组织病理检查均确认为前列腺腺癌患者。人前列腺癌细胞系PC3购自美国ATCC公司。
1.1.2主要试剂与仪器 改良Eagle培养基(dulbecco’s modified eagle medium,DMEM)培养基购自美国GIBCO公司;脂质体Lipofectamine 2000转染试剂盒购自美国Thermo Fisher Scientific公司;TrIzol 试剂购自美国Invitrogen公司;反转录试剂盒和实时定量试剂盒购自英国NEB公司;鼠抗人PI3K、Akt、磷酸化蛋白激酶B(phosphorylated Akt,p-Akt)和NF-kB多克隆抗体购自艾比玛特医药科技(上海)有限公司;48孔细胞培养板和transwell小室购自美国Corning公司;基质胶购自美国BD公司;超低温离心机(型号3K15)购自德国Sigma公司;奥林巴斯荧光倒置显微镜购自日本Olympus公司;荧光定量PCR仪器购自德国Eppendorf;脱氧核糖核酸(deoxyribonucleic acid,DNA)序列和目标载体由苏州金唯智生物科技有限公司合成、构建。
1.2方法
1.2.1细胞培养 将购买的人前列腺癌细胞PC3解冻复苏,接种于含10%胎牛血清DMEM培养基中,置于37℃、5% CO2的潮湿培养箱中培养,待细胞长满瓶底85%左右时,弃去培养液,加入胰蛋白酶消化处理后,进行传代培养和细胞冻存。
1.2.2细胞转染及分组 取对数期人前列腺癌细胞PC3接种于48孔细胞培养板(100 μL/孔),待细胞融合度达到85%以上时,用胰蛋白酶消化处理后,按照Lipofectainine2000转染剂说明书将购买的pcDNA3.0-RKIP、pcDNA3.0、RKIP-shRNA和shRNA-NC转染至前列腺癌细胞,命名为pcDNA3.0-RKIP组、pcDNA3.0组、RKIP-shRNA组、shRNA-NC组,每组重复9孔,以未经转染的细胞作为对照组,对照组加入等量的二甲亚砜(dimethylsulfoxide,DMSO),各组细胞均培养48 h。
1.2.3实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)检测人前列腺癌细胞PC3中RKIP mRNA表达水平 用TrIzol 试剂提取人前列腺癌细胞PC3的总RNA,并将其反转成cDNA,根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上提交的RKIP的理论序列设计引物,RKIP:上游引物F1,5′-TTGGTGGTGAATATGAAAGG-3′,下游引物R1,5′-TAAGAGTCGTTGGCGAGT-3′;3-磷酸甘油醛脱氢酶(glyceraldehyde-3phosphate dehydrogenase,GAPDH)上游引物F2,5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物R2,5′-ATGGTGGTGAAGACGCCAGT-3′;以GAPDH为内参进行qRT-PCR。反应体系:5×缓冲液 5 μL,TaqDNA聚合酶 0.5 μL,上游引物F 1 μL,下游引物R 1 μL,10 mmol/L脱氧核苷三磷酸混合液(deoxyriboNucleotide triphosphate mix,dNTP mix)0.5 μL,互补DNA(complementary DNA,cDNA)1 μL,灭菌蒸馏水 16 μL;反应条件:预变性:95 ℃ 5 min,变性:95 ℃ 30 s,延伸:62℃ 15 s,40个循环,采用最大二阶导数法(2-△△Ct)对数据进行统计,计算RKIP mRNA的相对表达量。
1.2.4Transwell小室检测人前列腺癌细胞PC3侵袭能力 用DMEM无血清培养基将Matrigel胶稀释至1 mg/mL,然后取40 μL均匀铺于transwell小室,37℃静置30 min。取各组人前列腺癌细胞PC3消化处理后制成单细胞悬液,调整细胞数目为1×106/mL,按每孔100 μL加入到transwell小室,常规培养48 h后取出小室,弃去培养液,用磷酸缓冲液(phosphatic buffer solution,PBS)溶液清洗细胞,每孔加入500 μL 95%乙醇固定15~20 min,经0.1%结晶紫溶液染色30 min后,用棉签擦拭未穿膜细胞,风干后置于显微镜观察,并记录穿膜细胞数目,以此作为评判细胞侵袭能力的指标。
1.2.5划痕实验检测人前列腺癌细胞PC3迁移能力 将各组人前列腺癌细胞PC3制成单细胞悬液,调整细胞数目为1×106/ mL接种于细胞培养板(100 μL/孔),培养24 h,细胞密度达80%时,用灭菌过的200 μL枪头划线,用PBS洗去划痕中的细胞,加入空白培养基,培养24 h后,置于倒置显微镜下观察发生迁移的细胞数目。
1.2.6Western blot检测RKIP、PI3K、Akt、p-Akt及NF-kB表达情况 分别加入细胞裂解液提取人前列腺癌组织、癌旁组织蛋白及人前列腺癌细胞PC3总蛋白,将蛋白样品进行加热煮沸和离心。以GAPDH为内参,取20 μL蛋白质样品,进行十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel,PAGE),电泳结束后,半干转膜仪转膜50 min,滴加鼠抗人RKIP、PI3K、Akt、NF-kB多克隆抗体,置于4℃下过夜,滴加二抗37℃放置1 h。采用电化学发光(electrochemiluminescence,ECL)分析法,加入ECL发光剂进行显影,利用自动凝胶成像系统采集图像。采用Image J 软件对 Western blot 条带进行灰度分析。
1.3统计学分析
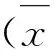
2 结 果
2.1RKIP在前列腺癌组织表达情况前列腺癌组
织RKIP蛋白相对表达为(0.64±0.11)显著低于癌旁组织(1.12±0.22),差异有统计学意义(P<0.05)。
2.2转染后人前列腺癌细胞PC3中RKIPmRNA和蛋白表达水平shRNA-NC组和pcDNA3.0组PC3细胞中RKIP mRNA和蛋白表达水平与对照组相比,差异无统计学意义(P>0.05),RKIP-shRNA组PC3细胞中RKIPmRNA和蛋白表达水平显著低于对照组和shRNA-NC组(P<0.05),pcDNA3.0-RKIP组PC3细胞中RKIP mRNA和蛋白表达水平显著高于对照组和pcDNA3.0组(P<0.05),pcDNA3.0-RKIP组PC3细胞中RKIP mRNA和蛋白表达水平显著高于RKIP-shRNA组(P<0.05,表1、图1)。
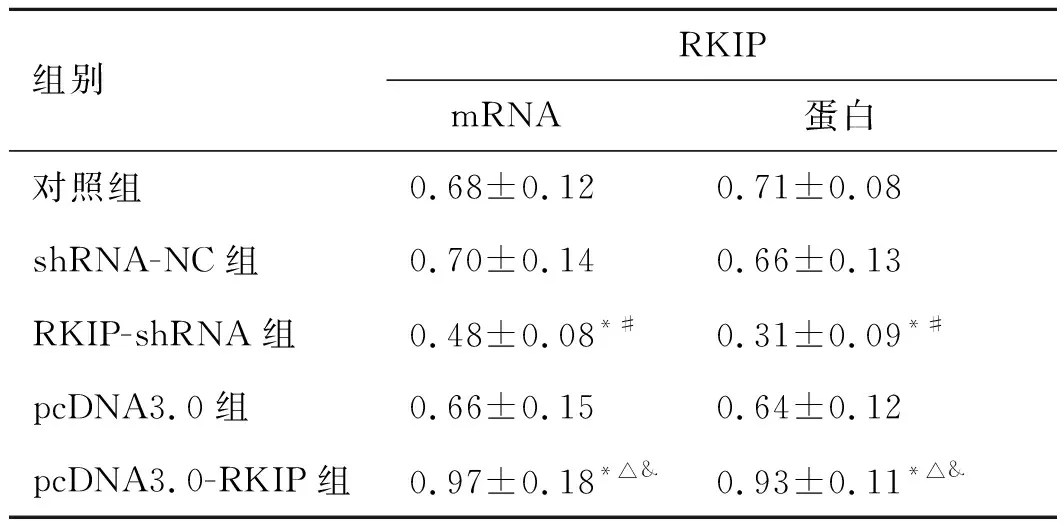
组别RKIPmRNA蛋白对照组0.68±0.120.71±0.08shRNA-NC组0.70±0.140.66±0.13RKIP-shRNA组0.48±0.08*#0.31±0.09*#pcDNA3.0组0.66±0.150.64±0.12pcDNA3.0-RKIP组0.97±0.18*△&0.93±0.11*△&
RKIP:Raf激酶抑制蛋白。与对照组相比,*P<0.05;与shRNA-NC组相比,#P<0.05;与pcDNA3.0组相比,△P<0.05;与RKIP-shRNA组相比,&P<0.05。

图1 各组人前列腺癌细胞PC3中RKIP 表达水平
A:各组RKIP mRNA相对表达水平;B:各组RKIP蛋白相对表达水平;C:转染后人前列腺癌细胞PC3中RKIP蛋白表达情况。RKIP:Raf激酶抑制蛋白;GAPDH:3-磷酸甘油醛脱氢酶。与对照组相比,*P<0.05;与shRNA-NC组相比,#P<0.05;与pcDNA3.0组相比,△P<0.05;与RKIP-shRNA组相比,&P<0.05。
2.3transwell小室检测人前列腺癌细胞PC3侵袭能力shRNA-NC组和pcDNA3.0组PC3细胞侵袭能力与对照组相比差异无统计学意义(P>0.05),RKIP-shRNA组PC3细胞侵袭能力显著高于对照组和shRNA-NC组(P<0.05),pcDNA3.0-RKIP组PC3细胞侵袭能力显著低于对照组和pcDNA3.0组(P<0.05),pcDNA3.0-RKIP组PC3细胞侵袭能力显著低于RKIP-shRNA组(P<0.05,表2、图2)。


组别侵出细胞数目(个)对照组135.12±21.32shRNA-NC组146.37±23.41RKIP-shRNA组476.45±53.72*#pcDNA3.0组128.67±21.24pcDNA3.0-RKIP组 84.27±22.82*△&
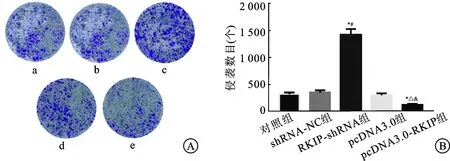
图2 transwell小室检测人前列腺癌细胞PC3侵袭能力(×400)
2.4划痕实验检测人前列腺癌细胞PC3迁移能力shRNA-NC组和pcDNA3.0组PC3细胞迁移能力与对照组相比,差异无统计学意义(P>0.05),RKIP-shRNA组PC3细胞迁移能力显著高于对照组和shRNA-NC组(P<0.05),pcDNA3.0-RKIP组PC3细胞迁移能力显著低于对照组和pcDNA3.0组(P<0.05),pcDNA3.0-RKIP组PC3细胞迁移能力显著低于RKIP-shRNA组(P<0.05,表3、图3)。
2.5Westernblot检测PC3细胞中PI3K、Akt及NF-kB表达情况各组间Akt的表达水平相比,差异无统计学意义(P>0.05)。shRNA-NC组和pcDNA3.0组PC3细胞中PI3K、p-Akt和NF-kB的表达水平与对照组相比,差异无统计学意义(P>0.05),RKIP-shRNA组PC3细胞中PI3K、p-Akt和NF-kB的表达水平显著高于对照组和shRNA-NC组(P<0.05),pcDNA3.0-RKIP组PC3细胞中PI3K、p-Akt和NF-kB的表达水平显著低于对照组和pcDNA3.0组(P<0.05),pcDNA3.0-RKIP组PC3细胞中PI3K、p-Akt和NF-kB的表达水平显著低于RKIP-shRNA组(P<0.05,图4、表4)。


组别发生迁移的细胞数目(个)对照组432.46±68.52shRNA-NC组457.36±52.34RKIP-shRNA组942.38±154.28*#pcDNA3.0组405.56±58.37pcDNA3.0-RKIP组116.52±21.34*△&
与对照组相比,*P<0.05;与shRNA-NC组相比,#P<0.05;与pcDNA3.0组相比,△P<0.05;与RKIP-shRNA组相比,&P<0.05。

图3 细胞划痕实验检测人前列腺癌细胞PC3迁移能力(×400)
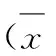

组别PI3KAktp-AktNF-kB对照组0.58±0.120.62±0.110.64±0.120.72±0.13shRNA-NC组0.61±0.100.59±0.100.62±0.130.69±0.15RKIP-shRNA组0.83±0.17*#0.60±0.120.86±0.20*#0.95±0.23*#pcDNA3.0组0.56±0.130.63±0.110.66±0.130.74±0.14pcDNA3.0-RKIP组0.41±0.07*△&0.57±0.100.41±0.08*△&0.51±0.10*△&
PI3K:磷脂酰肌醇激酶;Akt:苏氨酸蛋白激酶;NF-kB:核转录因子。与对照组相比,*P<0.05;与shRNA-NC组相比,#P<0.05;与pcDNA3.0组相比,△P<0.05;与RKIP-shRNA组相比,&P<0.05。
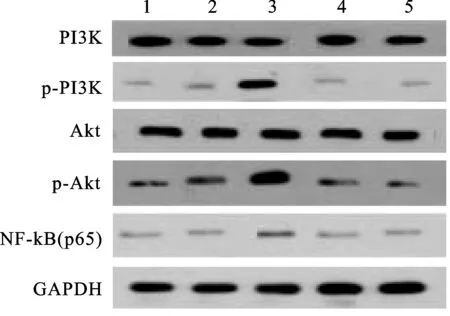
图4 Western blot检测PC3细胞中PI3K、Akt、p-Akt和NF-kB表达情况
3 讨 论
前列腺癌是临床常见的恶性肿瘤,可发生远端转移和浸润生长,侵袭膀胱和精囊,引起阳痿、血尿、血精等症状[6],前列腺癌还会发生骨转移,进而导致骨痛、骨折或截瘫[7],严重影响患者的身体健康,因此,采取有效的措施抑制前列腺癌的侵袭和转移是治疗前列腺癌的重要环节。RKIP作为磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP)家族中一个成员,能够与Raf结合抑制其激活[8]。本研究发现,前列腺癌组织RKIP蛋白相对表达显著低于癌旁组织,且前列腺癌PC3细胞中RKIP蛋白表达显著低于正常细胞,提示RKIP在前列腺癌中可能为抑癌基因。另有研究表明,RKIP与细胞增殖和侵袭密切相关[9]。张晓梅等[10]研究表明,上调胃癌细胞SGC7901中RKIP基因表达,能够抑制胃癌细胞的增殖、侵袭和转移能力,并促进胃癌细胞凋亡。褚静等[11]研究表明,上调宫颈癌细胞RKIP基因的表达,能够抑制宫颈癌细胞的增殖、侵袭和转移能力,是宫颈癌治疗的新靶点。为进一步明确RKIP在前列癌疾病进展中作用,本研究采用RKIP表达较低的PC3细胞作为研究载体,分别用RKIP-shRNA和pcDNA3.0-RKIP转染PC3细胞,结果表明,pcDNA3.0-RKIP组PC3细胞RKIP mRNA表达水平显著高于RKIP-shRNA组和对照组,pcDNA3.0-RKIP组PC3细胞侵袭和迁移能力显著低于RKIP-shRNA组和对照组,表明上调PC3细胞RKIP基因的表达,能够抑制前列腺癌细胞的侵袭和转移能力,与张晓梅等[10]在胃癌细胞中研究一致,但其机制尚不清楚。
RKIP的表达水平与生物体中重要的信号通路密切相关[12]。PI3K/Akt是生物体内重要的信号通路,其活性涉及多个基因的调控,参与肿瘤细胞的增殖、迁移、凋亡等过程[13]。黄海等[14]研究表明,激活前列腺癌细胞LNcap中PI3K/Akt信号通路的活性能够促进前列腺癌细胞的增殖,并抑制前列腺癌细胞凋亡。贾艳菊等[15]研究表明,抑制前列腺癌细胞中PI3K/Akt信号转导通路,能够抑制前列腺癌细胞的生长、增殖以及分化。NF-kB是PI3K/Akt信号转导通路下游的关键蛋白,与细胞增殖、分化、侵袭和转移密切相关。BUFU等[16]研究表明,南蛇藤酮可通过抑制PI3K/Akt 信号通路活性抑制直肠癌细胞MMP蛋白表达,进而抑制细胞增殖和迁移能力,促进细胞凋亡。CHIU 等[17]研究表明,下调前列腺癌细胞中Akt/NF-kB信号通路活性,能够抑制人前列腺癌细胞的侵袭。LIU等[18]发现,RKIP过表达可显著抑制NF-kB通路的激活,增强胃癌细胞对顺铂的敏感性。本研究显示,pcDNA3.0-RKIP组PC3细胞中PI3K、p-Akt和NF-kB的表达水平显著低于RKIP-shRNA组,表明RKIP过表达能够抑制PI3K/Akt/NF-kB信号通路的活性,提示RKIP过表达对前列腺癌细胞侵袭和转移的抑制作用可能与抑制PI3K/Akt/NF-kB信号通路激活有关。
综上所述,RKIP过表达能够抑制前列腺癌细胞侵袭和转移,可能通过抑制PI3K/Akt/NF-kB通路激活实现,为前列腺癌的靶向治疗提供一定的理论依据。

