肾脏集合管癌12例诊治分析
刘海浪,王桎仙,王少刚,杜广辉,陈 忠,宋晓东,杨为民
(华中科技大学同济医学院附属同济医院泌尿外科,湖北武汉 430030)
肾脏集合管癌(collecting duct carcinoma,CDC)是众多肾细胞癌病理亚型中极为罕见的一种,约占肾细胞癌的1%~2%[1],恶性程度高,预后差,大部分患者发现时已有肾外转移。由于该类型肿瘤罕见,国内既往少有超过10例的相关文献报道,且较少有学者将此类型肿瘤的临床、影像及病理学特征结合起来进行临床研究,本文通过回顾性分析我院于2008年8月至2017年8月期间收治的12例肾集合管癌患者的临床资料,结合随访信息,以求达到全面认识肾集合管癌的目的,更好地完成对CDC的诊治。
1 资料与方法
1.1临床资料本组患者男7例,女5例,年龄30~75岁,平均(54.75±12.89)岁;肿瘤位于左侧者7例,位于右侧者5例;肿瘤最大径2.8~12.3 cm,平均(6.02±2.92)cm;体质量指数(body mass index,BMI)16.65~31.77;所有患者中因肉眼血尿就诊者5例,因发热就诊者2例,因腰腹疼痛就诊者3例,例行体检发现肿瘤者3例,其中1例患者同时表现为腰痛及发热;所有CDC患者均依据UICC/AJCC 2010版TNM分期标准进行分期,Ⅰ期3例,Ⅱ期0例,Ⅲ期7例,Ⅳ期2例;最后随访时间2018年3月(表1)。
表1患者一般资料及随访结果
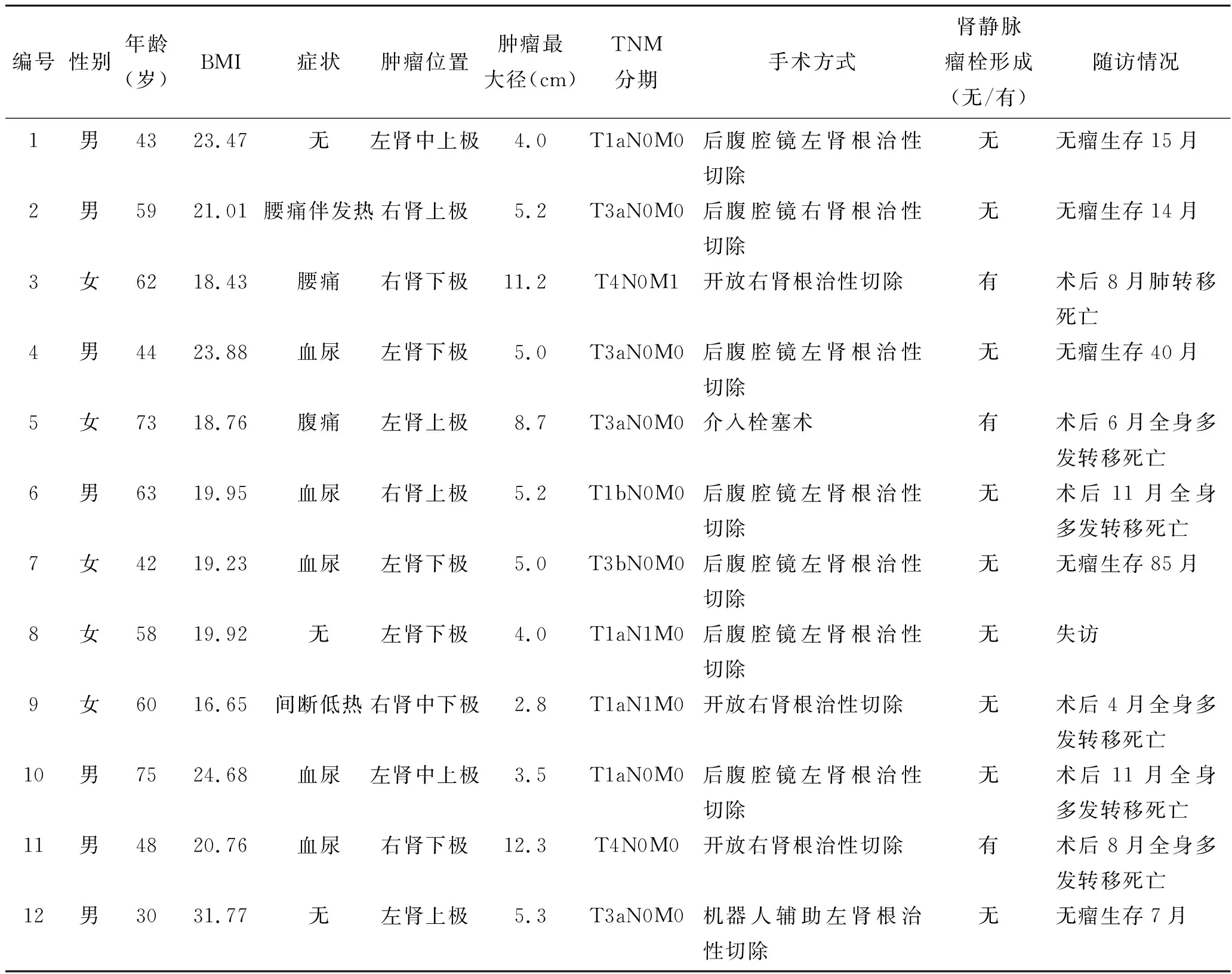
编号性别年龄(岁)BMI症状肿瘤位置肿瘤最大径(cm)TNM分期手术方式肾静脉瘤栓形成(无/有)随访情况1男4323.47无左肾中上极4.0T1aN0M0后腹腔镜左肾根治性切除无无瘤生存15月2男5921.01腰痛伴发热右肾上极5.2T3aN0M0后腹腔镜右肾根治性切除无无瘤生存14月3女6218.43腰痛右肾下极11.2T4N0M1开放右肾根治性切除有术后8月肺转移死亡4男4423.88血尿左肾下极5.0T3aN0M0后腹腔镜左肾根治性切除无无瘤生存40月5女7318.76腹痛左肾上极8.7T3aN0M0介入栓塞术有术后6月全身多发转移死亡6男6319.95血尿右肾上极5.2T1bN0M0后腹腔镜左肾根治性切除无术后11月全身多发转移死亡7女4219.23血尿左肾下极5.0T3bN0M0后腹腔镜左肾根治性切除无无瘤生存85月8女5819.92无左肾下极4.0T1aN1M0后腹腔镜左肾根治性切除无失访9女6016.65间断低热右肾中下极2.8T1aN1M0开放右肾根治性切除无术后4月全身多发转移死亡10男7524.68血尿左肾中上极3.5T1aN0M0后腹腔镜左肾根治性切除无术后11月全身多发转移死亡11男4820.76血尿右肾下极12.3T4N0M0开放右肾根治性切除有术后8月全身多发转移死亡 12男3031.77无左肾上极5.3T3aN0M0机器人辅助左肾根治性切除无无瘤生存7月
BMI:体质量指数。
1.2影像学检查及治疗方式全部患者均通过术前影像学检查完成初步诊断,其中,行超声检查者10例,行计算机断层扫描(computed tomography,CT)检查者9例(3例仅行平扫检查,另6例行平扫+增强检查),行磁共振检查者5例(2例仅行平扫检查,另3例行平扫+弥散+灌注成像检查);患者中,除1例患者因高龄、瘤体巨大及多种并存疾病而放弃手术改行介入栓塞治疗外,余11例患者均行手术治疗。7例患者行后腹腔镜肿瘤根治性切除术(3.5~5.2)cm,3例行开放肾肿瘤根治性切除术(2.8~12.3)cm,1例行机器人辅助肾肿瘤根治性切除术(5.3 cm);另有3例患者合并肾静脉瘤栓形成,其中2例患者切除患侧肿瘤的同时行瘤栓取出术。所有手术均顺利完成。
2 结 果
2.1影像学检查结果本组多数患者的肿瘤CT上表现为稍低密度不规则或类圆形软组织影,边界清或不清,增强时肿瘤内部呈不均匀强化,强化程度较周围肾实质低,诊断为肾脏肿瘤性病变;另有1例患者较为特殊,CT平扫上见肾内多发片状高密度影,肾盂肾盏轻度扩张,肾周筋膜增厚,肾前方可见条状高密度影,术前诊断考虑为肾周感染,术后病理确诊为肾集合管癌。磁共振平扫上肿瘤多数呈等T1稍短T2混杂信号影,边界清或不清,形态不规则或呈类圆形,灌注成像可见肿瘤内部轻至中度不均匀强化,诊断为肾脏肿瘤性病变或肾脏恶性肿瘤;另有1例患者肾脏上极病变处呈囊实性混杂信号,DWI呈不均匀高信号,增强呈不均匀强化,肾上极可见一个肾盏分界不清,诊断为囊性肾癌(图1)。
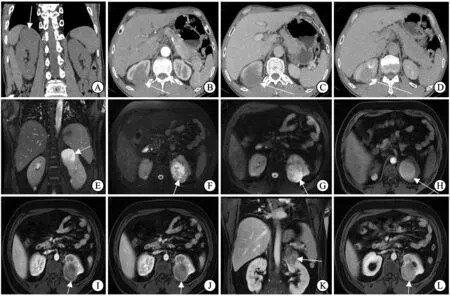
图1患者2及患者12部分CT及磁共振图像
A~D:患者2双肾CT平扫及增强图像,A:平扫图像,B、C、D:患者增强检查皮质髓质期,肾实质期及排泄期图像,平扫时可见肿瘤呈等密度或稍低密度影,与正常肾实质分界不清,患肾体积增大,增强可见肿瘤呈不均匀轻度强化,强化程度低于同期正常肾实质;E~H:患者12的磁共振冠状位BH Cor 2D FIESTA序列图像、T2加权像及灌注成像前的T1加权像,肿瘤于BH Cor 2D FIESTA及DWI、T2加权像上呈不均匀高信号影,同时可见囊实性成分,术前考虑囊性肾癌,术后病理确诊为集合管癌;I~L:患者12灌注成像各期检查,可见肿瘤强化低于同期正常肾实质。
2.2患者病理检查结果手术患者术后常规行病理检查显示,肿瘤细胞呈管状排列,部分区域出现肉瘤样变,核分裂象多见,间质纤维组织增生明显,PAX-2、PAX-8及vimentin呈弥漫阳性表达(图2)。部分患者行免疫组化检查,其结果以“阳性数/检查总数”表示,结果可见:PCK(9/9),vimentin(4/9),PAX-8(5/6),PAX-2(5/6),INI-1(2/2),CAⅨ(2/4),CK19(5/5),EMA (8/8),P504s(5/5),SDHB(3/3),CD117(1/4),CK7(5/10),CD10(3/7),CD15(1/4),34E12(4/7),Melan A(0/2),TFE-3(2/4),TFE-B(2/3),HMB45(0/3),villin(0/3)。

图2患者3常规病理及免疫组化图片
A:HE,×100;B:HE,×200;C:HE,×400;D、E、F:PAX-2、PAX-8及vimentin染色图片。
2.3随访结果随访结果见表1。
3 讨 论
肾脏集合管癌是起源于肾脏髓质集合管远端的恶性上皮肿瘤,极为少见,约占所有类型肾细胞癌的1%~2%,FLEMING等[2]于1986年首次提出其为独立的肾细胞癌病理亚型,其恶性程度高,进展快,大部分患者发现时已有肾外转移,约80%的患者最终转移到淋巴结、肺、肝、脑及骨。2008年8月至2017年8月我院收治的所有肾细胞癌患者中仅出现12例CDC患者。
CDC常见于中老年患者,有报道称患者患病中位年龄为55岁,男多于女[3]。类似于其他类型肾脏恶性肿瘤,CDC患者典型的临床症状常包括肉眼血尿、腹部或背部疼痛、疲劳、发热、体质量减轻及腹部肿块等,但也有部分患者未表现出症状而通过体检发现肿瘤。本组患者中出现症状者9例,未出现症状者3例(表1)。
CDC起源于肾脏髓质的集合管,向肾脏的皮质髓质及肾盂浸润性生长,当肿瘤较小时,常呈圆形或类圆形,局限于肾髓质而肾脏轮廓不会改变,这与肾透明细胞癌外生性生长的特性不同;而当肿瘤体积较大时,与肾脏实质分界不清,肾脏体积增大[1,3];CDC的这一生长特点也使得其在影像学上的表现因肿瘤大小而表现出差异。王玉涛等[4]对5例CDC患者的CT影像资料进行了分析,发现肿瘤实质性部分平扫时呈等密度或略高密度,少数呈稍低密度,CT值略高于肾皮质、髓质,多期增强扫描呈轻度至中度不均匀进行性强化,强化程度均低于肾皮质、髓质,2例肿瘤出现囊实性改变。邵兵等[5]也对5例CDC患者进行CT检查,肿瘤表现为不规则实性肿块,边界不清,平扫呈等密度影,增强后皮质期实性成分轻度强化,强化程度低于肾皮质,肿瘤与肾实质分界不清;实质期呈延迟强化,强化程度仍然低于肾实质,但肿瘤与肾实质分界相对较清。WU等[6]分析了18例CDC患者的影像资料后发现,CDC于CT平扫上表现为高密度影的肿块,且在所有强化阶段中,CDC的强化程度都要低于同时相的正常肾皮质和髓质,50%的肿瘤内部有出血现象。关于CDC的磁共振的影像学表现特点,有学者认为肿瘤行磁共振平扫时,于T1WI呈等或稍高信号,T2WI呈低信号,增强后呈轻度均匀或不均匀延迟强化[5];也有学者报道称,CDC是高度恶性的肾细胞癌,通常表现为乏血供的肿块,有着不规则的轮廓或者呈浸润性生长,肿瘤内部因出血、坏死及囊变等结构而呈不均匀性改变,T2像上常呈低信号影[7]。
结合本次研究的影像学检查结果,我们可以认为,CDC无论于CT或磁共振上多呈形态多变、边界不清的肿块影,于肾髓质处呈浸润性生长,瘤体较小时肾脏轮廓不变,但对于较大的CDC,其肿瘤内部常伴有坏死、出血及囊性成分的出现,因此于CT及磁共振上表现出极大的变异,相应特征与其他类型肿瘤重叠之处也让鉴别诊断变得困难,尤其是对于同起源于肾脏髓质的肾髓质癌,两者生长特点及生长部位近似,因此影像学表现也非常接近。仅凭影像学检查手段完成对CDC的术前诊断难度较大,考虑到CDC的恶性程度高,预后差,当影像学上怀疑为CDC时,通常选择手术确诊,达到诊断及治疗的目的。
组织学上,大体观,较小的肿瘤常位于肾髓质的深部,肿瘤切面常呈白色,部分区域可见坏死及出血,CDC常有着不规则、浸润性、不明显的边界,其侵入肾皮质且常突破肾实质而累及肾周组织,例如肾周脂肪、肾上腺以及Gerota筋膜,淋巴转移也常见[8];镜下观,CDC主要为腺泡状、管状或管状乳头状结构,并且有着明显的促间质反应性增生,肿瘤细胞常呈立方状、柱状或鞋钉样,胞质呈淡嗜酸性,细胞核分级较高,多形性,核仁明显,核分裂象多见,凝固性坏死常见,肉瘤样及横纹肌样分化也可见,肉瘤样及横纹肌样分化的出现提示预后极差,小血管侵犯及肾静脉侵犯约可在20%的CDC中见到,本组患者镜下所见与此基本相符[9]。2013国际泌尿病理协会[10]及2016世界卫生组织[8]在关于肾脏肿瘤分类中都强调CDC的诊断要点应包括以下几点:①至少一定比例的肿瘤侵犯肾髓质;②主要由小管构成;③促间质反应性增生;④细胞呈现高级别特征;⑤浸润性生长;⑥无其他肾肿瘤亚型成分及上皮肿瘤成分。主要的鉴别诊断包括浸润性尿路上皮癌、肾髓质癌、2型乳头状肾细胞癌及未分类肾细胞癌,当与肾髓质癌鉴别困难时,除形态学特征外,患者的年龄、种族以及镰状细胞病病史等都应考虑进去[11]。免疫组化能很好地帮助病理医师进行鉴别诊断。
有报道称CDC稳定表达高分子量角蛋白CK19和34βE12,CK7以及vimentin,而且大部分胞核表达PAX-2、PAX-8及INI-1[11];尤其值得注意的是,PAX-8常稳定表达于CDC、正常集合管以及区别明显的肾单位;且高达20%的尿路上皮癌可表现为阳性,易引起误诊。少数可出现INI-1的完全缺失,而INI-1的缺失易致将CDC误诊为肾髓质癌。GATA3、p63及PAX-8三者的联合使用能很好地帮助区分CDC与浸润性尿路上皮癌,PAX-8(+)/p63(-)/GATA3(-)常预示着CDC;PAX-8(-)/p63(+)/GATA3(+)常预示着尿路上皮癌。INI-1的缺失以及核表达POU5F1 (OCT3/4)强烈支持肾髓质癌的诊断,而CDC细胞的核也不经常表达INI-1,诊断效度受限。本组研究中几种CDC常见的免疫组化标记表达情况分别为:CK19(5/5),34βE12(4/7),vimentin(4/9),PAX-8(5/6),PAX-2(5/6),INI-1(2/2)。
肿瘤细胞的分子遗传学特征变异极大[12],染色体杂合缺失1p(1q32.1-32.2)、6p、8p、9p、21p,以及Y染色体的缺失,单染色体1、6、14、15、22缺失也有相关报道;16及20号染色体的获得,其他研究者也有报道16p、20p及20q的缺失;此外,13及X染色体的获得也被发现。这一系列遗传信息改变的发现预示着潜在的靶向治疗途径[13],包括:①mTOR途径阻(NF2、VHL、PIK3CA及PIK3R2);②脱乙酰化酶阻断(FBXW7);③EZH2阻断(BAP1、SMARCB1);④血管内皮生长因子阻断(VHL);⑤DNA甲基转移酶阻断(DNMT3A);⑥EGFR抑制剂抵抗(HRAS);⑦CDK 4/6阻断(CDKN2A)。
综合目前研究结果来看,CDC属高度恶性肿瘤,初次发现即处于Ⅲ或Ⅳ期[1],约40%有远处转移,预后差,约50%~60%的CDC患者于初次诊断之后的2年内死亡,2年肿瘤特异性生存率约为47.3%。MAY等[14]通过病理学及临床的各种参数指标建立了肿瘤风险模型来预测肿瘤特异性死亡率,下列指标是预测高肿瘤特异性死亡率的独立危险因素:①ASA评分3~4(1分)②肿瘤>7 cm(1分)③转移出现(M1)(2分)④Fuhrman核分级3-4(2分)⑤出现淋巴血管侵犯(1分);总分0~7分,危险分层,低风险(0~2分);中度风险(3分);高风险(4~7分),此3种危险分层的5年肿瘤特异性生存率分别为96%、62%、8%。
手术仍是目前治疗CDC的主要方法[15],但大部分患者初次发现即已有淋巴转移或远处转移,减瘤术能否使患者生存获益,尚无一致结论,有报道称手术后患者可长期存活,另外手术切除肿瘤患者需积极随访。对于晚期CDC患者[16],其他传统治疗手段化疗、放疗及免疫治疗可考虑使用,但对大部分患者作用有限,考虑到化疗的细胞毒性,吉西他滨与铂盐的联合使用被认为是治疗CDC转移的一线方案,对于不能耐受化疗的CDC患者,靶向疗法可视为较好的方法之一,已有部分靶向治疗药物用于治疗CDC,效果需待多中心的研究报道。

