胡麻品种内亚7号下胚轴组织培养再生体系的建立
,, ,
(1.中国农业科学院农业环境与可持续发展研究所,北京 100081;2.内蒙古农业大学农学院,呼和浩特 010018; 3.中国农业科学院生物技术研究所,北京 100081)
胡麻,即油用亚麻。5 000多年前就有栽培,作为油用、药用和纤维用[1-2],是我国干旱地区的重要经济作物[3]。胡麻的营养保健价值很高[4],随着生活水平的提高,胡麻已经受到人们的重视[5]。但胡麻是高度自花授粉作物,常规育种耗时长,优良遗传资源有限[6],利用植物组培技术建立高效再生体系是基因工程技术顺利实施的必要条件[7]。Link等[8]利用亚麻下胚轴在离体培养条件下分化出再生芽;Jordan等[9]以油用亚麻下胚轴为外植体,诱导获得了愈伤组织;Nichterlein等[10]首次以亚麻花药为外植体,诱导获得了单倍体植株;苑志辉等[11]以亚麻下胚轴为外植体,诱导获得了再生植株;Rutkowska-Krause等[12]以亚麻花药为外植体,诱导获得了再生植株;王玉富等研究表明,亚麻下胚轴可作为再生体系的外植体[13]。本试验以胡麻品种内亚7号下胚轴为外植体,研究不同植物激素的配比对胡麻植株再生的影响,旨在建立胡麻植株再生体系,为基因工程技术及新品种培育奠定基础。
1 材料与方法
1.1 材 料
供试材料为内蒙古农业大学试验田收获的胡麻品种内亚7号种子。
1.2 方 法
1.2.1 种子消毒及初代培养获取无菌苗
以胡麻品种内亚7号种子作为试验材料,用自来水洗3 min,再用无菌水洗3次,然后在超净工作台上用75%乙醇分别消毒1,3 min,无菌水洗3次,再用1 g/L的HgCl2分别处理0,3,6,9 min,无菌水洗6次,备用。将经不同消毒处理的种子90粒接种到MS培养基上,每个培养基接6个,15次重复。15 d后统计污染率和发芽率,研究不同消毒方法对胡麻品种内亚7号种子消毒的影响。
污染率(%)=(污染的培养基数/总培养基数)×100%;
发芽率(%)=(无菌苗数/接种种子个数)×100%。
1.2.2 IAA和6-BA对愈伤组织诱导的影响
选健壮的无菌苗,取其下胚轴切成0.5 cm左右为外植体,以MS(30 g/L蔗糖+7 g/L琼脂,pH=5.8)为基础培养基,添加不同质量浓度6-BA(1.0,2.0,3.0 mg/L)与IAA(0.25,0.50,1.00 mg/L),将二者进行正交试验组合设计,共设置1) MS+1.0 mg/L 6-BA+0.25 mg/L IAA,2) MS+1.0 mg/L 6-BA+0.50 mg/L IAA,3) MS+1.0 mg/L 6-BA+1.00 mg/L IAA,4) MS+2.0 mg/L 6-BA+0.25 mg/L IAA,5) MS+2.0 mg/L 6-BA+0.50 mg/L IAA,6) MS+2.0 mg/L 6-BA+1.00 mg/L IAA,7) MS+3.0 mg/L 6-BA+0.25 mg/L IAA,8) MS+3.0 mg/L 6-BA+0.50 mg/L IAA,9) MS+3.0 mg/L 6-BA+1.00 mg/L IAA 9种培养基处理组合,每种培养基每瓶接6个,重复10次。15 d后统计愈伤组织诱导情况。
出愈率(%)=(愈伤组织数/无菌苗株数)×100%。
1.2.3 IAA和6-BA对愈伤组织生长速率的影响
选生长良好的愈伤组织切成小块(质量可以忽略不计)接种到1.2.2项下的9种培养基上,每瓶接6块,重复10次。分别在10,15,20 d时,取12块愈伤组织在分析天平上称重,研究愈伤组织生长速率情况。
生长速率(%)=(后1次重量-前1次重量)/2次称量所差天数×100%。
1.2.4 IAA和6-BA对不定芽分化及增殖的影响
选生长良好的愈伤组织为材料,MS为基础培养基,添加不同质量浓度6-BA(1.0,1.5,2 mg/L)与IAA(0.2,0.5,1.0 mg/L),将二者进行正交试验组合设计,共设置:1) MS+1.0 mg/L 6-BA+0.2 mg/L IAA,2) MS+1.0 mg/L 6-BA+0.5 mg/L IAA,3) MS+1.0 mg/L 6-BA+1.0 mg/L IAA,4) MS+1.5 mg/L 6-BA+0.2 mg/L IAA,5) MS+1.5 mg/L 6-BA+0.5 mg/L IAA,6) MS+1.5 mg/L 6-BA+1.0 mg/L IAA,7) MS+2.0 mg/L 6-BA+0.2 mg/L IAA,8) MS+2.0 mg/L 6-BA+0.5 mg/L IAA,9) MS+2.0 mg/L 6-BA+1.0 mg/L IAA 9种培养基组合,每种每瓶接6块,重复10次。30 d后观察不定芽分化及增殖情况;再将生长良好的不定芽,接种到以上分化出不定芽的4组培养基中,30 d后统计不定芽增殖情况。
分化率(%)=(丛生芽数/愈伤组织数)×100%;
增殖系数=(不定芽数-起始不定芽数)/起始不定芽数。
1.2.5 IAA和6-BA对不定芽生根的影响
将生长较好,长势一致的不定芽接种到以下5种生根培养基中:1) 1/2 MS+0.01 mg/L 6-BA+0.25 mg/L IAA;2) 1/2 MS+0.01 mg/L 6-BA+0.50 mg/L IAA;3) 1/2 MS+0.01 mg/L 6-BA+0.75 mg/L IAA;4) 1/2 MS+0.01 mg/L 6-BA+1.00 mg/L IAA;5) 1/2 MS+0.005 mg/L 6-BA+0.50 mg/L IAA。30 d后统计生根率及根生长情况。
生根率(100%)=(生根的组培苗数/接种组培苗数)×100%。
1.3 培养条件
1.3.1 无菌苗及愈伤组织的诱导条件
温度(23±2)℃,光照强度为0。
1.3.2 不定芽分化及生根条件
温度(23±2)℃,光照强度为2 000 lx,光周期为光照16 h/黑暗8 h。
1.4 数据分析方法
采用SPSS软件对实验数据进行相关性分析。
2 结果与分析
2.1 不同消毒方法对胡麻品种内亚7号种子消毒效果的比较
表1表明,用浓度为1 g/L的HgCl2溶液对胡麻品种内亚7号的种子消毒具有重要的作用,随着HgCl2消毒时间的延长,污染率显著降低,但发芽率也显著下降。用75%乙醇分别处理1 min和3 min时,再用1 g/L的HgCl2消毒3 min的处理发芽率均最高,分别为92.2%和97.8%,但用75%乙醇消毒3 min处理的发芽率显著高于1 min处理,且1 min处理有明显的污染现象。结果表明,对胡麻品种内亚7号进行种子消毒,以75%乙醇处理3 min,再用1 g/L的HgCl2处理3 min效果最好。
表1 不同处理时间对内亚7号胡麻种子消毒效果

处理处理种子数75%乙醇消毒时间(min)1g/LHgCl2的消毒时间(min)发芽率(%)污染率(%)1901054.4f100a2901392.2b33.3b3901686.7c16.7c4901974.4e05903397.8a06903682.2d07903973.3e0
注:不同小写字母表示在p<0.05水平上差异显著。下同。
2.2 IAA及6-BA配比对胡麻品种内亚7号愈伤组织诱导的影响
表2表明,9种不同激素配比的培养基均能诱导出愈伤组织,但愈伤诱导率和最早出愈时间有差异。在培养基7中外植体的出愈率最高,为98.48%,但与培养基1、3、4的愈伤组织诱导率差异不显著,出愈最早均为4 d。结果表明,不同浓度6-BA对愈伤组织的诱导率和出愈时间影响不显著,而不同浓度IAA的影响显著。本试验以MS+1.0 mg/L 6-BA+0.25 mg/L IAA培养基对愈伤组织的诱导率及出愈时间为最佳。
2.3 IAA及6-BA配比对胡麻品种内亚7号愈伤组织生长速率的影响
图1表明,在不同激素质量浓度配比下胡麻品种内亚7号愈伤组织生长速率有差异。培养基7在10 d和20 d愈伤组织的生长速率均为最大,分别为9.23%和42.3%,且均与其他培养基差异显著。在15 d时,培养基2的生长速率最大,为21.02%,但与培养基7差异不显著。由此表明,MS+3.0 mg/L 6-BA+0.25 mg/L IAA培养基(培养基7)是胡麻品种内亚7号愈伤组织生长的最佳培养基。
表2 不同激素质量浓度配比对内亚7号胡麻愈伤组织诱导的影响

培养基植物生长调节剂(mg/L)6-BAIAA愈伤诱导率(%)最早出愈时间(d)110.2598.24a4210.5096.36b4311.0098.11a4420.2598.15a4520.5012.16f9621.0091.80c5730.2598.48a4830.5088.89d5931.0035.90e6

图1 不同激素质量浓度配比对胡麻品种内亚7号愈伤组织生长速率的影响
2.4 IAA及6-BA配比对胡麻品种内亚7号不定芽分化及增殖的影响
表3表明,在9种不同配方的培养基中,只有4、5、7号和8号培养基中有不定芽分化,且分化率和增殖系数有差异。其它培养基无不定芽分化,其中包括IAA为1.0 mg/L的3个培养基。在8号培养基中,不定芽分化率和增殖系数均最大,分别为95.00%和7.67,且与其它培养基有显著性差异。由此可见,MS+2.0 mg/L 6-BA+0.5 mg/L IAA培养基是胡麻品种内亚7号不定芽分化及增殖的最佳培养基。
2.5 IAA及6-BA配比对胡麻品种内亚7号不定芽生根的影响
图2、图3表明,培养基3中,不定芽诱导生根率和平均根长均最大,分别为52.26%和4.98 cm,均显著高于其它培养基。可见,1/2 MS+0.01 mg/L 6-BA+0.75 mg/L IAA培养基是胡麻品种内亚7号最佳生根培养基。
表3 不同激素质量浓度配比对胡麻品种内亚7号不定芽诱导及增殖的影响
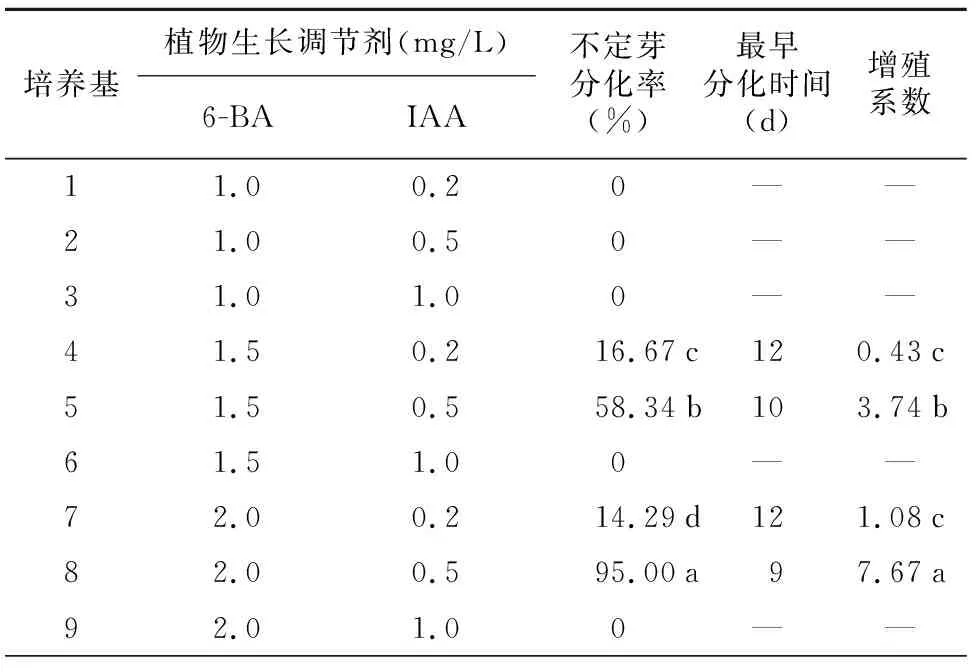
培养基植物生长调节剂(mg/L)6-BAIAA不定芽分化率(%)最早分化时间(d)增殖系数11.00.20——21.00.50——31.01.00——41.50.216.67c120.43c51.50.558.34b103.74b61.51.00——72.00.214.29d121.08c82.00.595.00a97.67a92.01.00——

图2 不同激素质量浓度配比对胡麻品种内亚7号不定芽生根率的影响
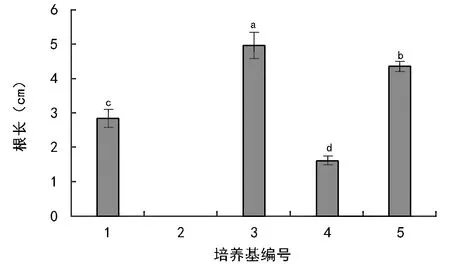
图3 不同激素质量浓度配比对胡麻品种内亚7号不定芽根长的影响
3 讨 论
无菌苗的获取是进行组织培养的第一步,利用乙醇溶液浸泡后再经HgCl2溶液消毒是胡麻种子消毒的一种常用方法。本研究结果表明,75%乙醇消毒是必须的;为了保证种子出苗率,应在彻底消毒的基础上尽量缩短HgCl2溶液消毒时间。
在组织培养中,常用的植物激素有IAA、NAA、6-BA、KT、IBA、2,4-D等[14],不同浓度的激素配比对胡麻愈伤组织诱导及生长速率、不定芽的分化及增殖、不定芽的生根均有影响。培养基中IAA和6-BA的配合使用及其浓度配比对愈伤组织的诱导及生长、不定芽分化和根的诱导起着重要作用。因此,配制培养基时应协调植物激素间的浓度及配比,才能使植物在组织培养中得到相应的预期效果。
本试验条件下,愈伤组织的生长速率在6-BA的浓度保持一定时,随着IAA浓度的增加呈下降趋势,而在IAA浓度保持一定时,愈伤组织的生长速率随6-BA浓度增加呈现不同的变化规律。当IAA浓度为0.25 mg/L时,愈伤组织的生长速率随6-BA浓度的增加呈先降后升的变化趋势(图1),而当IAA浓度为0.5 mg/L和1 mg/L时,愈伤组织的生长速率则随着6-BA浓度的增加呈下降趋势,且当IAA浓度为1.0 mg/L时,不定芽的分化率均为0(表3),由此说明,高浓度的IAA对不定芽的分化具有强烈的抑制作用。
不同基因型胡麻愈伤组织的诱导及不定芽的生根所需的激素配比有所差异,愈伤组织诱导率也不尽相同。苑志辉等以7309优良品种进行研究,结果表明,下胚轴愈伤组织诱导率可达92.3%,生根率在改良后的培养基中达90%[11];赵玮等对陇亚10号胡麻品种进行研究,结果显示,愈伤组织诱导率达100%,但生根率仅有3.5%[15];孙上峰等以04-94-S-266油用亚麻品种进行研究,结果显示愈伤组织的诱导率最高为72%,再生植株的诱导率最高为 48.6%[16]。本试验对胡麻品种内亚7号下胚轴进行组织培养,其愈伤组织诱导率最高为98.48%,生根率最高为52.26%。但本试验未能得到移栽成活苗,主要是因为愈伤组织的存在阻断了根基与再生植株之间的联系,使再生植株不能直接从根部吸收营养成分[15]。因此,诱导芽的生根培养仍然需要进一步研究。
本试验通过对胡麻品种内亚7号下胚轴进行组织培养,探讨了不同消毒方法对种子消毒及不同浓度的激素配比对愈伤组织、不定芽以及根诱导的影响,从中筛选出最佳组织培养条件,建立了胡麻品种内亚7号下胚轴组织培养体系,为基因工程技术及新品种培育奠定了良好的基础。
4 结 论
胡麻品种内亚7号种子消毒的最佳方法是用75%乙醇处理3 min,再用1 g/L的HgCl2溶液处理3 min,其效果最好。胡麻品种内亚7号,诱导愈伤组织的最佳培养基是MS+3.0 mg/L 6-BA+0.25 mg/L IAA,其下胚轴出愈率为98.48%,最早出愈时间为4 d;愈伤组织生长的最佳培养基为MS+3.0 mg/L 6-BA+0.25 mg/L IAA;不定芽分化和增殖的最佳培养基为MS+2.0 mg/L 6-BA+0.5 mg/L IAA,其不定芽分化率为95%,最早分化时间为9 d,不定芽增殖系数为7.67;不定芽生根的最佳培养基为MS+0.01 mg/L 6-BA+0.75 mg/L IAA,其不定芽平均生根率为52.26%,平均根长为4.98 cm。

