普通小麦贵紫麦1号染色体的FISH核型分析
,,, ,
( 1.贵州大学农学院,贵阳 550025; 2.国家小麦改良中心贵州分中心,贵州 贵阳 550025)
小麦在粮食作物中有着举足轻重的地位,无论是栽培面积还是经济效益都不亚于水稻和玉米。中国是最早种植小麦的国家之一。普通小麦(Triticumaestivum,2 n=42)是异源六倍体,属于禾本科(Triticeas)小麦族(Triticeas)小麦属(Triticum)。研究认为,普通六倍体小麦的进化至少历经了两次远缘杂交与一次异源多倍体化,A基因组供体乌拉尔图小麦(T.Urartu,2 n=14)与B基因组供体拟斯卑尔托山羊草(Ae.Speltodies,2 n=14)杂交形成二粒小麦(T.turgidum,2 n=28),历经多年进化,又与D基因组供体粗山羊草(Ae.Tauschii,2 n=14)杂交,形成六倍体小麦并最终演变成普通小麦(AABBDD)[1-3]。多年来,在小麦的进化过程中,随着不断的杂交,自然及人工选择,发生大量有利性状的控制基因丢失,或受环境条件的影响使得原有的基因失效(如质量、产量、抗病性、抗逆性等),造成了普通小麦在这些方面的缺陷[4]。迫于如此情形下,选育产量高、品质好、株型合适及抗性良好的新品种在小麦育种工作中已经显得刻不容缓。近些年,采用远缘杂交、细胞工程育种、分子标记、基因克隆以及染色体工程等方法将不同种属中含有的有利基因导入至普通小麦基因组中,已成功育成诸多具备高产潜力、抗病、抗逆性优良等的小麦新品种[5]。
细胞学鉴定发展至如今,无论是分带鉴定技术还是核型分析方法,都能够快速、有效且准确的对不同物种染色体的数目、组成与结构进行判断分析。采用荧光原位杂交技术(Fluorescence In Situ Hybridization,FISH),待测染色体中的DNA与具荧光标记的探针(特异寡聚核苷酸片段)结合,从而检测DNA序列在染色体上的位置。近年来,DNA重复序列被广泛用于未知染色体鉴别、物种起源与进化及指纹图谱构建等,还能对遗传物质来源进行追溯鉴定。Pedersen等[6]利用来自节节麦的pAs 1探针及来自大麦且含有(GAA)8重复序列的pHvG 38探针有效鉴别了中国春3个基因组染色体。Cuadrado A等[7]利用5个高度重复序列pTa 71、pTa 794、pSc 34、pSc 74和pSc 119.2 探针对黑麦进行多次FISH分析,成功鉴别了A、B及R基因组染色体。Mukai等[8]利用pSc 119.2 及pAs 1 两个重复序列探针,不仅有效鉴别并建立中国春的B、D基因组清晰的FISH核型,还成功识别其A基因组的1 A、4 A、5 A染色体。Tang等[9]利用重复序列pAs 1、pTa-535以及pSc 119.2为荧光标记探针,建立了普通小麦中国春3种基因组染色体FISH核型。本研究拟采用pAs 1与pSc 119.2-1 2种不同颜色的重复序列探针开展贵紫麦1号荧光原位杂交分析,构建其FISH核型,明确各染色体对的信号分布特点,为该品种在小麦育种工程中的运用及后续研究提供参考。
1 材料与方法
1.1 材 料
供试材料为贵紫麦1号,由3个不同种属材料节节麦/偏凸山羊草/硬粒小麦历经多年多代杂交而来,是贵州大学农学院国家小麦改良中心贵州分中心自主创制的一个特色紫粒小麦品种(审定编号:黔审麦2015003号)。贵紫麦1号抗性优良(抗病、抗逆、耐贫瘠等)、产量高、品质好,其紫色籽粒含有丰富的营养物质,种皮还富含能预防人类癌症及心脑血管病的花青苷黄酮类化合物。
1.2 染色体制片
选取10~20粒饱满种子,常温下用双蒸水浸泡4~6 h,用镊子取种子均匀摆放在铺有干净湿润滤纸的塑料培养皿上25 ℃进行发芽,每天用双蒸水进行3~5次冲洗,根长2~3 cm时,取根尖进行2 h笑气(N2O)处理,90%冰乙酸冰上固定5 min,蒸馏水冲洗3遍,切取根尖分生区进行37 ℃纤维素酶果胶酶混合液酶解50 min,进行滴片。在显微镜下进行检测,挑选含分裂相好及完整染色体数的细胞片子放置于4 ℃冰箱以备使用。
1.3 荧光原位杂交分析
FISH技术参见Han等[10]方法。选择FISH效果好的细胞用Cellsens Standard摄像系统照相。为获得准确可靠的结果,镜检挑选10个分裂相较好且经荧光原位杂交后染色清晰的细胞用于构建FISH核型图及杂交信号分布特点分析。
2 结果与分析
该试验利用pAs 1与pSc 119.2-1 2种具不同颜色的重复序列探针对普通小麦贵紫麦1号的根尖细胞染色体开展一次荧光原位杂交(图1)并建立其FISH核型(图2)。试验结果发现,贵紫麦1号包括21对染色体,探针pAs 1在D基因组上发现明显的红色杂交信号,在A基因组染色体上大部分存在明显信号,在B基因组染色体上也存在微弱信号;而探针pSc 119.2-1于B基因组上发现明显绿色杂交信号,于A基因组与D基因组上部分有明显信号。结合染色体长度,及以上2种探针基本上可以对A、B基因组及D基因组完成准确辨别。
2.1 贵紫麦1号A基因组的FISH分析
贵紫麦1号的1 A染色体短臂的端部具有1对微弱的pAs 1信号。2 A染色体短臂端部具有明亮的pAs 1信号,其近着丝点处具有微弱的pAs 1信号;在长臂的端部具有1对微弱的pSc 119.2-1信号。3 A染色体短臂靠近着丝点处具有1对明亮的pAs 1信号。4 A长臂的端部具有1对微弱的pAs 1信号及1对微弱的pSc 119.2-1信号。5 A染色体长臂中间具有1对微弱的pAs 1 信号,在染色体短臂端部及靠近着丝点处各具有1对微弱的pSc 119.2-1信号。6 A染色体中有一条染色体长臂的端部发现非常微弱的pAs 1信号,而另一条却未发现明显的pAs 1信号,推测信号在杂交过程中丢失。7 A染色体在接近着丝点及长臂处具有若干微弱的pAs 1信号。
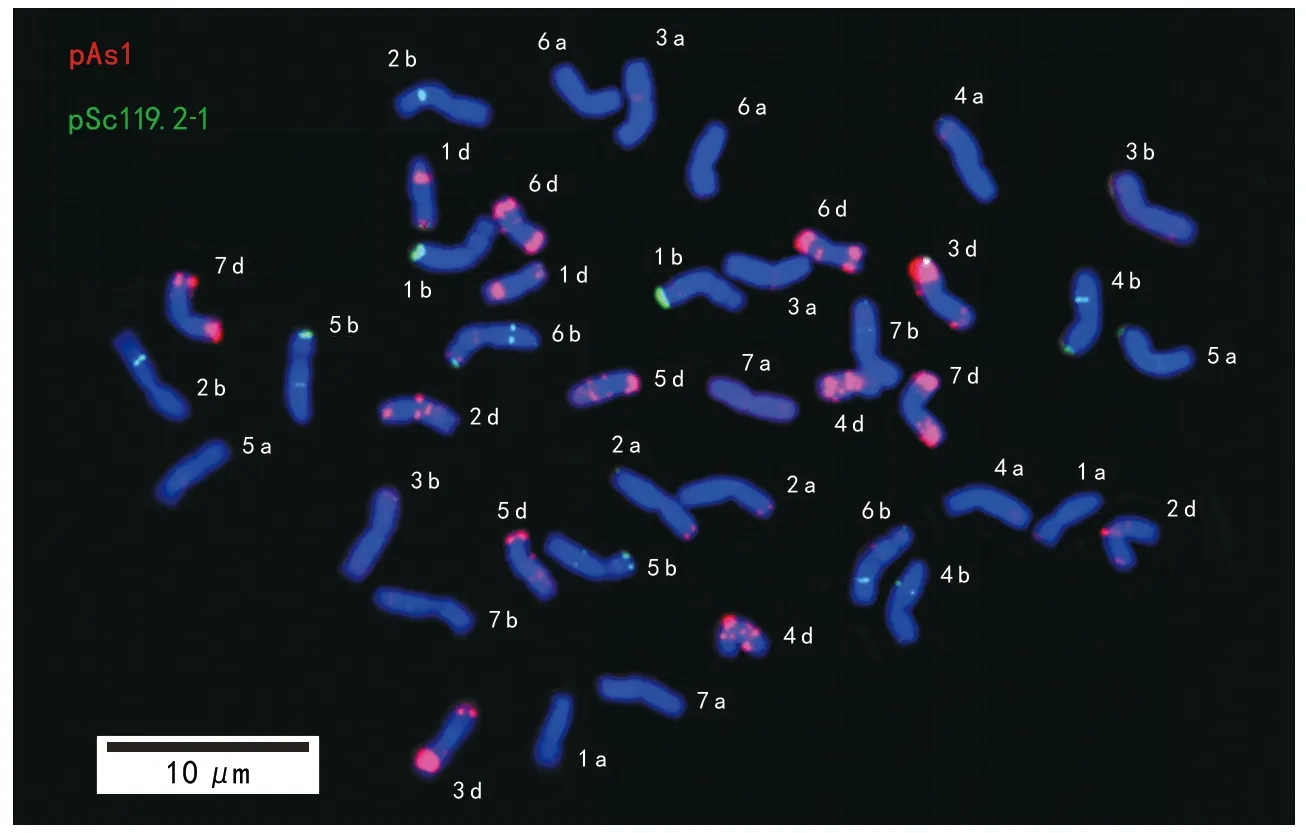
注:红色为pAs 1杂交信号,绿色为pSc 119.2-1杂交信号,细胞经DAPI染色呈蓝色。下同。图1 普通小麦贵紫麦1号染色体的荧光原位杂交图
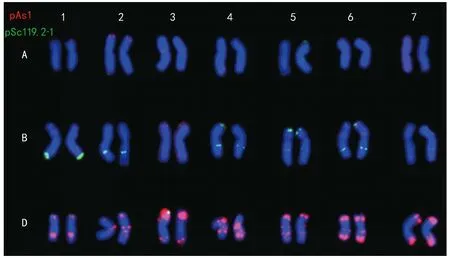
图2 普通小麦(贵紫麦1号) 的A、B基因组和D基因组的FISH核型
2.2 贵紫麦1号B基因组的FISH分析
与A基因组相比,出现在B基因组中的pSc 119.2-1信号明显较多且明亮。实验结果表明,贵紫麦1号的1 B和6 B染色体含有随体。贵紫麦1号的1 B染色体长臂末端具有1对较强的pSc 119.2-1信号,此外,其长臂中部还具有1对微弱的pSc 119.2-1信号以及1对微弱的pAs 1信号。2 B染色体长臂中部具有1对较强的pSc 119.2-1信号。3 B染色体短臂末端及长臂中间上各发现1对微弱的pAs 1信号,在其短臂端部还发现1对微弱的pSc 119.2-1信号。4 B染色体上发现较多且明亮的pSc 119.2-1信号,相比其它染色体来看较容易被区分出来,在其短臂末端、长臂中间与末端都显示出了很明亮的探针pSc 119.2-1杂交信号。5 B染色体的短臂末端、中间与长臂中间处都显示出较明亮的pSc 119.2-1杂交信号,在其短臂末端还具有1对微弱的pAs 1信号,但被同位置的pSc 119.2-1信号覆盖。6 B染色体上2种探针信号都较为丰富,其短臂末端及接近着丝点处均具有微弱的pAs 1信号,长臂末端、中部和短臂末端都发现了较强的pSc 119.2-1信号。7 B染色体的两末端均发现微弱的pAs 1信号,在长臂的末端、中部与短臂接近末端处也发现微弱的pSc 119.2-1信号。
2.3 贵紫麦1号D基因组的FISH分析
相比A基因组和B基因组,探针pAs 1在D基因组上不仅信号丰富且明亮,还可有效地对D基因组进行准确区分。贵紫麦1号在1 D染色体短臂末端以及长臂中部分别发现较强的pAs 1信号,其短臂末端还发现1个较明亮的pSc 119.2-1信号。2 D染色体的短臂末端与长臂均发现丰富且较强的pAs 1信号,其短臂末端还发现1对微弱的pSc 119.2-1信号。3 D染色体的短臂末端具有强且大的pAs 1信号,同位置还具有1个较为明亮的pSc 119.2-1信号,在其长臂端部还具有1对明亮的pAs 1信号。4 D染色体的长臂中部与接近近着丝点处均具有面积大且略为强的pAs 1信号。5 D染色体的pAs 1信号较为丰富,其长臂分布着多个明亮的pAs 1信号,在短臂末端与接近着丝点处都具有较强的pAs 1信号。6 D染色体的两端分别具有较强较大的pAs 1信号,在长臂近着丝点处也具有明亮的pAs 1信号。7 D染色体两端也分布着较强较大的pAs 1信号。
2.4 贵紫麦1号与硬粒小麦(AABB)的FISH核型比较分析
将贵紫麦1号与陈星灼等[11]报道的硬粒小麦的A、B组染色体的杂交信号分布特点进行比较分析。结果表明,贵紫麦1号的2 A染色体长臂端部较硬粒小麦要多出1对微弱的pSc 119.2-1信号。贵紫麦1号的5 A染色体短臂末端及长臂接近着丝点处均较硬粒小麦要多出1对微弱的pSc 119.2-1信号。硬粒小麦的2 B染色体长臂末端具有1对明亮的pSc 119.2-1信号,而贵紫麦1号在相同位置却没有显示出pSc 119.2-1信号。贵紫麦1号3 B染色体的短臂末端仅有1对微弱的pSc 119.2-1信号,硬粒小麦在相同位置却显示出2对明亮的pSc 119.2-1信号。贵紫麦1号的5 B染色体长臂近着丝点发现1对微弱的pSc 119.2-1信号,而在硬粒小麦中未曾发现任何信号。
2.5 贵紫麦1号与节节麦(DD)的FISH核型比较分析
贵紫麦1号跟HuaKun Zhang等[12]所研究的节节麦D组染色体的FISH结果进行对比。结果表明,两者的pAs 1信号基本相似,仅在1 D染色体上节节麦的长臂端部比贵紫麦1号多出1对明显的pAs 1信号。两者的pSc 119.2-1信号分布则表现出了部分差异,贵紫麦1号的1 D染色体的短臂末端较节节麦多出1个明亮的pSc 119.2-1信号,节节麦的4 D短臂末端与5 D短臂末端均比贵紫麦1号多出1对pSc 119.2-1 信号。
2.6 贵紫麦1号与中国春(AABBDD)的FISH核型比较分析
贵紫麦1号与Tang等[9]报道的pAs 1、pSc 119.2-1探针在中国春A、B基因组及D基因组染色体上的杂交信号基本相似,却又存在部分杂交信号差异。发现贵紫麦1号的2 A染色体的长臂末端以及5 A长臂靠近着丝点位置均比中国春多具有1对pSc 119.2-1信号。贵紫麦1号的6 B染色体短臂末端较中国春多出1对pSc 119.2-1信号。贵紫麦1号的7 B染色体长臂末端发现1对pSc119.2-1信号,而中国春上并没有。贵紫麦1号的1 D染色体短臂末端较中国春要多出1个pSc 119.2-1信号。
3 讨 论
建立植物染色体核型在植物远缘杂交育种中具有十分重要的意义,不仅可以对其染色体数目及形态结构变异进行研究,还能更深一步的探寻物种起源与进化的关系[13]。Linc等[14]利用pSc 119.2与Afa family 2个mcFISH探针不仅成功辨别长穗偃麦草E基因组所有染色体,还建立了详细FISH核型模式图,此外还将11个中国春-偃麦草二体附加系完成明确鉴定。BADAEVA 等[15]利用pAs 1及pSc 119.2两个重复序列作探针,成功创立4套单芒山羊草的FISH核型。刘成等[16]先利用多聚核苷酸探针Oligo- pTa 535-1和Oligo- pSc 119.2-1成功辨别中国春-智利大麦双二倍体的42条染色体,再结合(GAA)8探针有效鉴别出智利大麦染色体同源群。董磊等[17]运用2个寡核苷酸探针Oligo-pTa 535及Oligo-pSc 119.2,对5份不同来源拟斯卑尔脱山羊草开展荧光原位杂交研究,成功鉴别所有染色体且构建出各相应材料清晰FISH核型图;并通过比较发现,Oligo-pSc 119.2杂交信号在这些材料上的分布特征不仅与在小麦B基因组上的分布有显著差异,在不同来源的斯卑尔脱山羊草材料间也表现出信号分布差异,说明高度重复序列Oligo-pSc 119.2探针在不同材料间表现出遗传多样性。宫文萍等[18]采用Oligo-pTa 535-1及Oligo-pSc 119.2-1两个多聚核苷酸探针成功建立7份济麦系列小麦的标准FISH核型图,发现其信号分布特点与中国春大部分相似,但在染色体4 A、6 B、7 B和7 D上却出现信号分布差异;此外还发现7份材料间的FISH信号变异位点相似,猜测可能是由于济麦系列小麦的遗传基础较为狭小所导致。王丹蕊等[19]开发了包含pAs 1-1、pAs 1-3、AFA-4、(GAA)10和pSc 119.2-1共5个探针的寡核苷酸探针套,并利用该套探针对18份不同的中国春小麦非整倍体材料及5份亲缘物种材料进行一次荧光原位杂交(FISH),不仅成功鉴别出相应的中国春端体、中国春缺体及中国春四体材料,还能有效识别出不同物种材料,建立了相应材料的清晰FISH核型图,说明该套探针在不同材料间具有多态性,为后续研究应用提供参考。
本研究利用pAs 1与pSc 119.2-1两个不同颜色的重复序列探针对贵紫麦1号进行1次荧光原位杂交分析,准确辨别了其全部21对染色体,并建立贵紫麦1号的清晰FISH核型图。贵紫麦1号染色体中的pAs 1信号相对要多些,并且在部分染色体上杂交信号面积大且较强;pSc 119.2-1信号则相对要少且弱。通过对比发现,贵紫麦1号的FISH核型与陈星灼等[11]报道的硬粒小麦A、B基因组染色体的FISH信号分布特点、HuaKun Zhang等[12]报道的节节麦的D组染色体的FISH信号分布特点及Tang等[9]报道的pAs 1、pSc 119.2-1探针在中国春A、B基因组及D基因组各对染色体上分布的杂交信号基本相似,却又存在部分杂交信号差异;可能是因为DNA重复序列在各个小麦材料间存在遗传差异及多态性而显示出的部分杂交信号差异。贵紫麦1号是从节节麦/偏凸山羊草/硬粒小麦远缘杂交后代中自主创制的紫粒小麦新品种,不排除在该材料形成过程中有其他外源基因的进入,亦可能是该材料在形成过程中经历过几次染色体的组成与结构变异现象,由此引起了染色体重复序列的改变,表现出了FISH杂交信号分布的多态性[20]。通过建立贵紫麦1号的FISH核型,为该材料下一步在细胞遗传学和分子遗传学研究上将相关优良性状定位在染色体上具有重要的意义。

