绿山楂种子内源抑制物成分的初步鉴定
, ,,
(1.南京林业大学南方现代林业协同创新中心, 江苏 南京 210037;2.山西省林业种苗管理总站, 太原 030012)
绿山楂(CrataegusviridisL.)是蔷薇科山楂属落叶小乔木,原产于美国德克萨斯州的东部[1]。大多数山楂树枝上有许多枝刺,但绿山楂树枝上很少或几乎没有刺。夏季,绿山楂树叶呈黄绿色到深绿色,秋天变成紫红色、青铜色或金色。绿山楂通常于早春开花,有明显的白色花朵,花5 瓣。果实桔色至红色,可保留到第2年春季,具有较高的观赏价值和经济价值[2]。绿山楂生长速度中等,喜好潮湿、肥沃且排水良好的土壤,适应能力较强,易栽培,耐修剪,可在我国的东北南部、华北、江苏一带栽植,是良好的庭院栽培树种。
绿山楂一般采取种子繁殖,但是其种子具有明显的休眠特性,一般需要经过两冬一夏的层积才能解除休眠,这给绿山楂的播种育苗生产带来了很多不便。国内外关于种子休眠机理的研究较多。Albertus Magus早在13世纪初便提出种子推迟发芽与抑制物质有关[3]。自1975年Khan[4]提出“三因子学说”以来,各种各样的植物内源抑制物不断被发现。不同植物中含有的内源抑制物不尽相同,张艳杰等[5]对南方红豆杉[Taxuschinensisvar.mairei(Lemee et I’ev1.)] 种子中存在的抑制物进行了研究,证实了南方红豆杉种子的胚乳、中种皮和内种皮中均含有抑制种子萌发和幼苗生长的物质。王小平、王九龄研究了白皮松(PinusbungeanaZuce.)种子中的内源抑制物,发现种子各部位抑制作用由强到弱的顺序为:外种皮、内种皮、胚乳;他们还发现白皮松种子中ABA类物质不是引起种子休眠的唯一抑制剂,休眠是由多种抑制物共同作用的,因此萌发抑制剂具有多样性的特点[6]。赵敏等的研究表明,刺五加果实及其外果皮、中果皮、种子中均含有一定活性的内源抑制物质,且外果皮、中果皮、种子中所含的内源抑制物质对白菜籽萌发的抑制活性高于对白菜幼根生长的抑制活性[7]。关于山楂属植物种子休眠机理的研究有很多,杨晓玲等对山楂属不同树种种子中抑制物的活性进行了比较研究,结果表明:种子各部位如种壳、种皮和种仁中均含有抑制物质,且不同种类的山楂种子解除休眠的难易程度不同[8];他们还发现,山楂种子层积过程中抑制物质的活性也逐渐降低[9]。朱梅玲等认为,酚类物质是山楂种子发芽的抑制物,层积过程中种子内所含酚类物质含量也逐渐降低[10]。苗卫东等在研究不同种类野生山楂种子休眠解除方法时发现,浓硫酸可以使山楂种壳均匀变薄,重量减轻,种孔堵塞物消除,种皮透气、透水性增加,从而促进山楂种子的萌发[11]。还有研究认为,GA有促进山楂种子萌发的作用,而ABA对种子萌发有抑制作用[12-13]。张培玉等研究了在不同采收期、室温干藏和层积过程中山楂种子GA3、IAA、ABA含量变化规律及其与休眠的关系,认为GA3、IAA对打破休眠、促进萌发有一定作用,而ABA则是抑制种子萌发的重要因素[14]。李秉真等研究了山楂种子的休眠与后熟期间内源激素的变化,研究显示,层积时间越长,山植种子中ABA含量越低,IAA/ABA值持续增加,因此ABA对山楂种子萌发有一定的抑制作用,低含量的ABA不会影响种子的萌发[15]。
尽管不同学者对山楂属植物休眠原因开展了一系列的研究,但对造成绿山楂休眠抑制物的种类还不清楚。本研究拟通过系统溶剂分离法对绿山楂种子的内源抑制物质进行萃取,并对各有机相萃取液进行生物测定,同时结合GC-MS技术鉴定各有机相分离的内源抑制物的成分,以期为绿山楂种子内源抑制物及其休眠机理研究提供科学依据。
1 材料与方法
1.1 试验材料
绿山楂种子从美国购买后置于4 ℃冰箱中保存备用。供试白菜籽(矮脚黄)购于南京金盛达种子公司,纯度≥95.0%,发芽率≥85%。
1.2 试验方法
1.2.1 千粒重测定
采用百粒法测定,随机数取绿山楂种子各100 粒×8 重复,用千分之一电子天平分别称重并做好记录,根据ISTA 规则(2013)[16]计算其标准差和千粒重。
1.2.2 绿山楂种子抑制物的初步分离
称取绿山楂种子100 g,磨碎成粉后,置于1 000 mL的锥形瓶中,分几次加入1 500 mL 80%的甲醇溶液,参考张艳杰[17]的方法,得到甲醇浸提液,加入蒸馏水定容至300 mL。用系统溶剂法[18]对上述甲醇浸提液进行初步分离(见图1)。将粗提液先后分离为5个组分:石油醚相、乙醚相、乙酸乙酯相、甲醇相及水相。然后将各有机相溶液分别置于旋转蒸发仪RE-3000上进行浓缩蒸发,最后将各有机相定容为50 mL,置于4 ℃冰箱中保存备用。
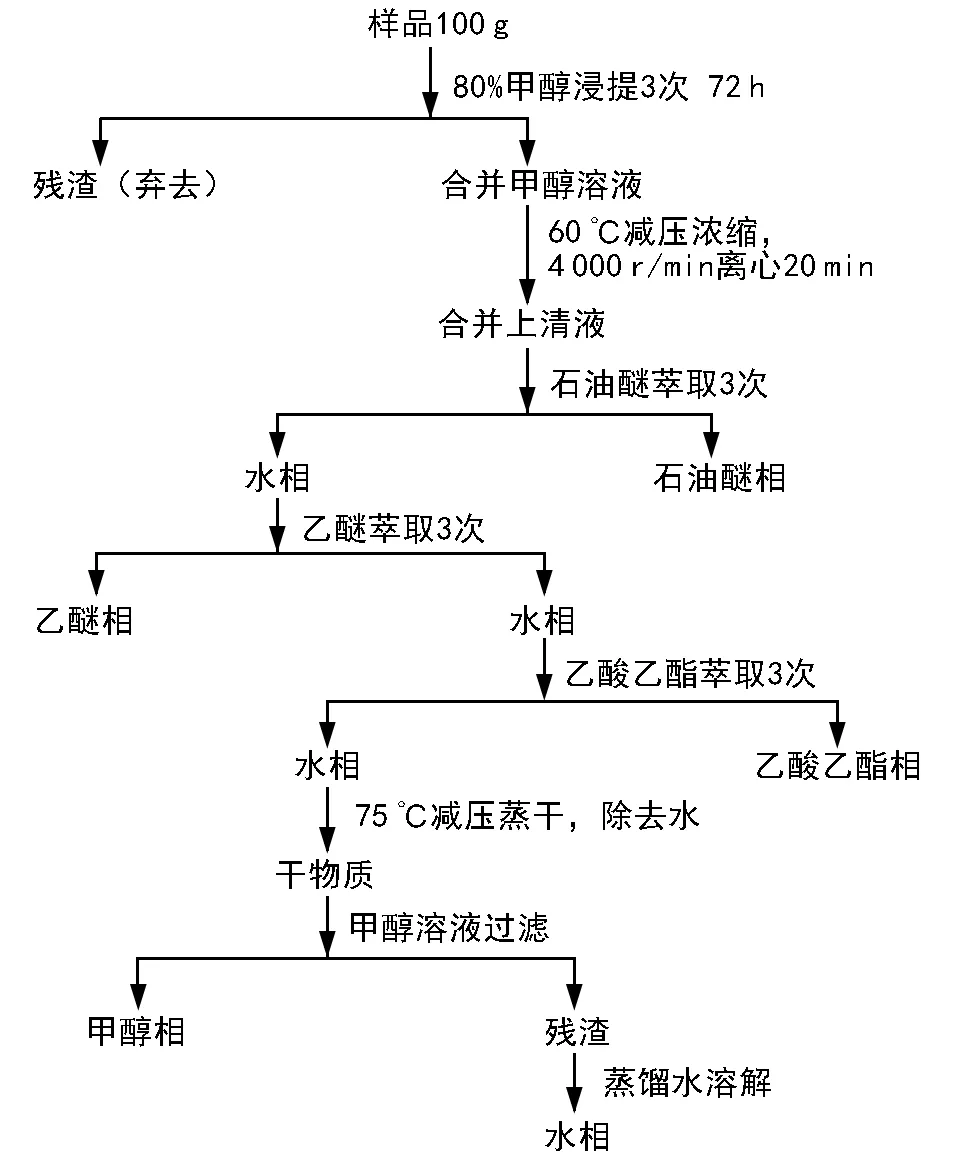
图1 绿山楂种子中抑制物质提取流程图
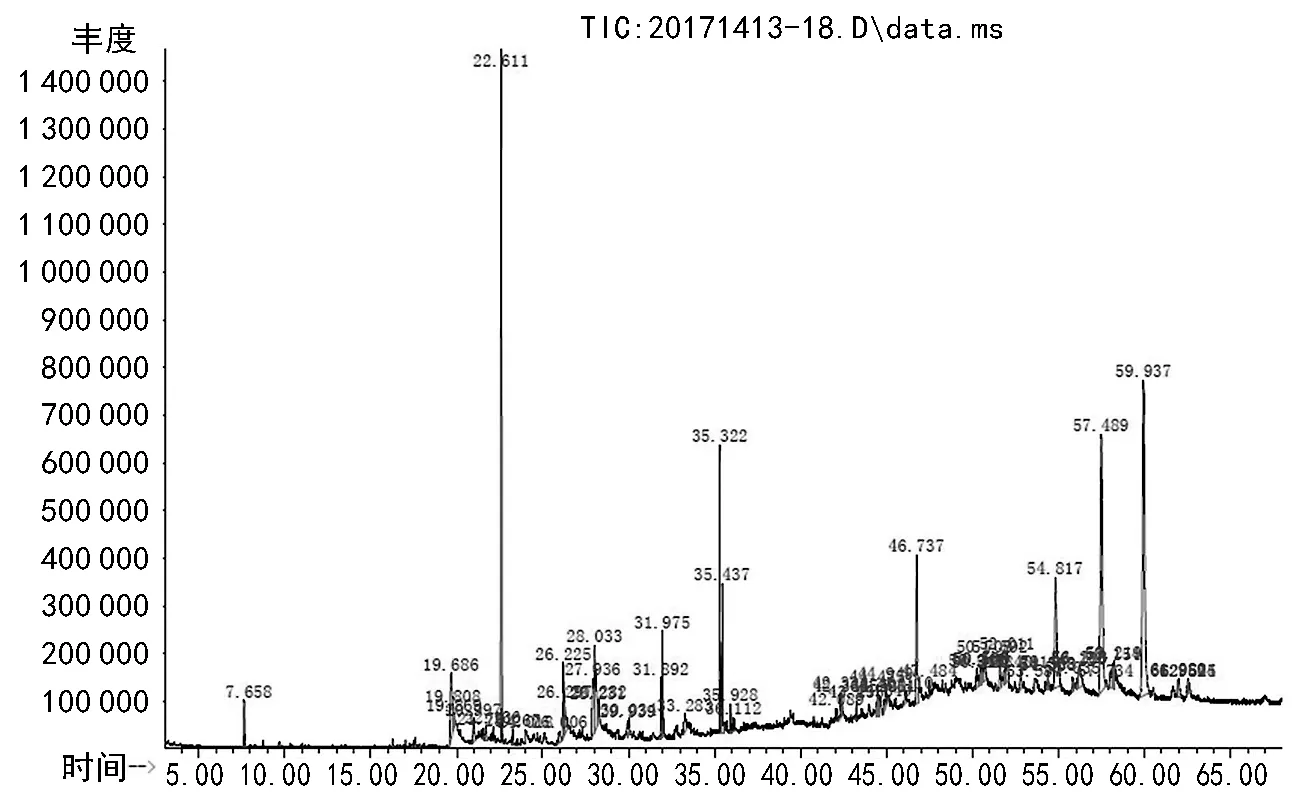
图2 乙醚相提取物的离子流程图
1.2.3 不同相的生物活性测定
将上述各相提取的溶液进行生物活性测定。随机数取白菜籽50粒,分别在各相的2 mL溶剂中浸泡3 h。随后在直径9 cm的培养皿中铺上滤纸,分别加入各内源抑制物浸提液5 mL。待其自然晾干后,放入对应相处理后晾干的白菜籽,以清水处理作为对照。将试验材料置于25 ℃光照培养箱中发芽,每个处理重复3次。计算发芽率[19]和发芽指数[20]。
1.2.4 绿山楂种子各有机相化学成分的鉴定
取各有机相相同体积的浸提液在旋转蒸发仪RE-3000内减压浓缩蒸干,然后用相应的有机溶剂溶解、定容至2mL,即得到各有机相提取物的浓缩样品。各浓缩样品在色谱-质谱(GC-MS)联用仪进行成分鉴定,仪器型号为:美国安提纶6890 N/5973 N(中国林业科学院林产化学研究所分析测定中心)。气相色谱条件依据韩宝瑞等[21]的方法,最后由计算机控制的库存信号检查各个成分的质谱图并与标准谱图核对。
1.2.5 数据分析
试验数据采用Microsoft Office Excel 软件以及SPSS 22.0软件进行统计分析。
2 结果与分析
2.1 种子千粒重的测定结果与分析
千粒重是反映种子大小与饱满程度的重要指标[22]。本次采用百粒法测定绿山楂种子的千粒重为21.56 g,标准差为0.002 8,变异系数为1.30%,因此绿山楂种子个体之间重量变化不大。
2.2 绿山楂种子中各分离相的生物活性测定
白菜种子发芽快速、整齐,故常被用来验证各分离相提取物质的生物活性。本次各分离相对白菜籽发芽的影响见表1。
初期的预试验表明,石油醚、乙醚、乙酸乙酯和甲醇4种有机溶剂自身对白菜籽发芽均没有显著影响,因此本研究中浸提液处理后白菜籽发芽率、发芽指数的变化均是由浸提液中的内源抑制物引起的。从表1可以看出:与对照组相比,绿山楂种子的乙醚相、乙酸乙酯相、甲醇相均对白菜籽发芽有显著抑制作用,并且乙醚相的抑制作用最强,发芽率从对照的93.3%下降到0.7%,降低了92.6%;其次为甲醇相,发芽率下降到4.0%,较对照降低了89.3%;再次为乙酸乙酯相,发芽率下降到58.0%,较对照降低了35.3%。白菜籽在石油醚相和水相的发芽率虽有小幅下降,但与对照相比下降不显著。
表1 绿山楂种子中各分离相对白菜籽发芽的影响

处理发芽率(%)发芽指数发芽指数较对照组下降的百分数(%)对照93.3±1.3a18.6±0.3a0石油醚相91.3±1.8a18.6±0.5a0乙醚相0.7±0.7c0.1±0.1c99.5乙酸乙酯相58.0±7.6b10.5±1.5b43.5甲醇相4.0±1.2c0.6±1.2c96.8水相92.7±1.3a17.1±1.0a8.1
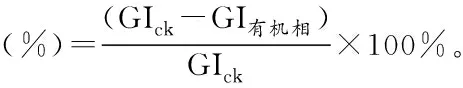
绿山楂种子各分离相溶液处理白菜种子后,其发芽指数与对照组相比也有一定的降低。其中,石油醚相、水相的发芽指数较对照无显著差异;乙醚相、甲醇相的发芽指数较对照组分别下降了99.5%、96.8%。白菜籽的发芽率、发芽指数结果均表明:绿山楂种子的甲醇、乙醚、乙酸乙酯分离相中可能存在一些发芽抑制物质。
2.3 绿山楂种子主要内源抑制物组分成分的鉴定
图2为绿山楂种子乙醚相提取物经GC-MS分析的离子流程图,共分离出63个峰。
通过质谱系统检索并与标准谱图进行核对,离子流程图中相似度大于85%的化合物的结果见表2。本次乙醚相中鉴定出的主要的有机化合物含量占总峰面积的74.1%,相对含量较多的为:未知物质1(18.1%),beta-谷甾醇(13.0%)、2,6-二叔丁基对甲苯酚(12.0%)、1,2-苯并异噻唑-3-酮(5.9%)、亚油酸(5.2%)等。
表2 绿山楂种子主要内源抑制物组分成分分析
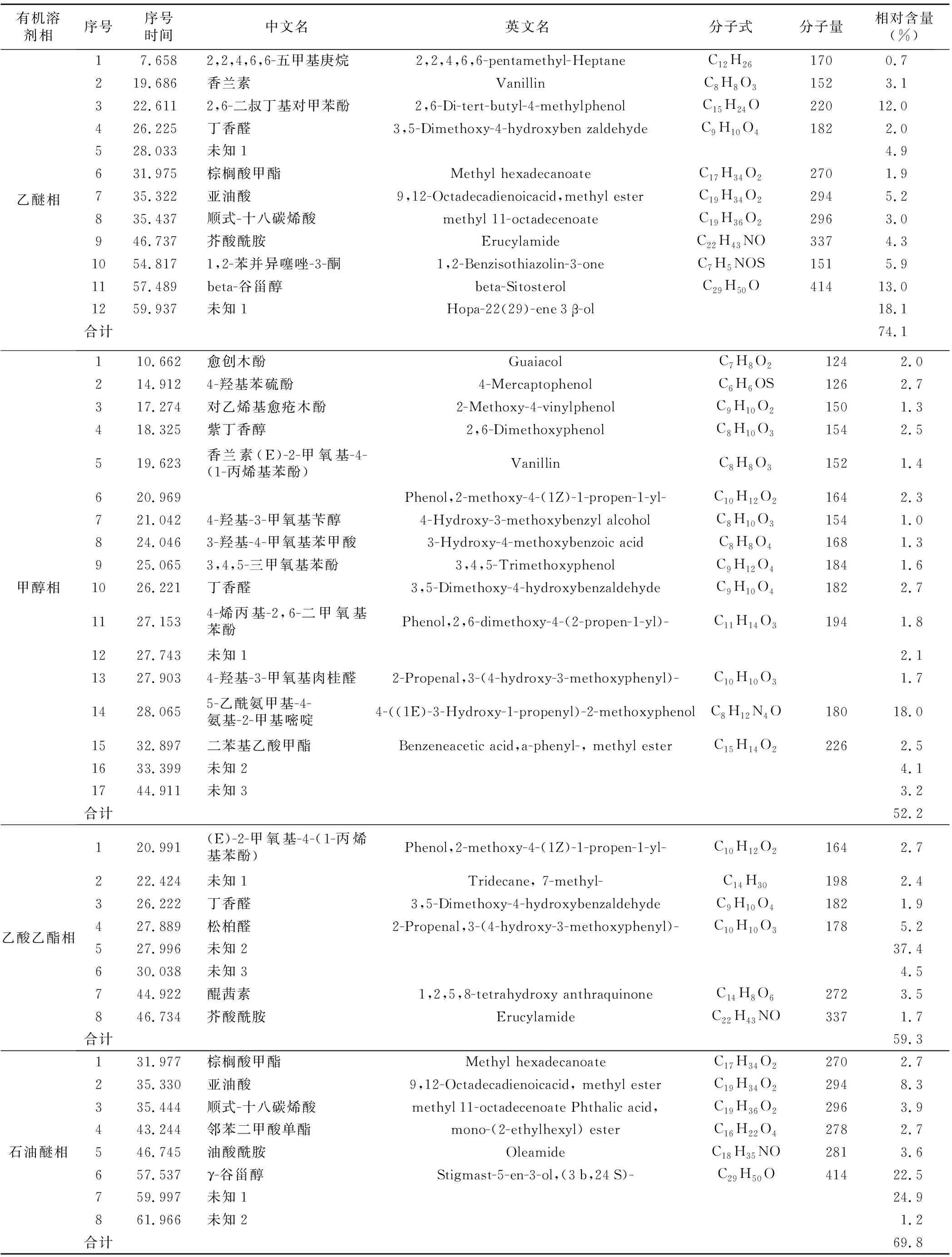
有机溶剂相序号 序号 时间 中文名 英文名 分子式 分子量 相对含量 (%) 乙醚相17.6582,2,4,6,6-五甲基庚烷2,2,4,6,6-pentamethyl-HeptaneC12H261700.7219.686香兰素VanillinC8H8O31523.1322.6112,6-二叔丁基对甲苯酚2,6-Di-tert-butyl-4-methylphenolC15H24O22012.0426.225丁香醛3,5-Dimethoxy-4-hydroxyben zaldehydeC9H10O41822.0528.033未知14.9631.975棕榈酸甲酯Methyl hexadecanoateC17H34O22701.9735.322亚油酸9,12-Octadecadienoicacid,methyl esterC19H34O22945.2835.437顺式-十八碳烯酸methyl 11-octadecenoateC19H36O22963.0946.737芥酸酰胺ErucylamideC22H43NO3374.31054.8171,2-苯并异噻唑-3-酮1,2-Benzisothiazolin-3-oneC7H5NOS1515.91157.489beta-谷甾醇beta-SitosterolC29H50O41413.01259.937未知1Hopa-22(29)-ene3β-ol18.1合计74.1甲醇相110.662愈创木酚GuaiacolC7H8O21242.0214.9124-羟基苯硫酚4-MercaptophenolC6H6OS1262.7317.274对乙烯基愈疮木酚2-Methoxy-4-vinylphenolC9H10O21501.3418.325紫丁香醇2,6-DimethoxyphenolC8H10O31542.5519.623香兰素(E)-2-甲氧基-4-(1-丙烯基苯酚)VanillinC8H8O31521.4620.969Phenol,2-methoxy-4-(1Z)-1-propen-1-yl-C10H12O21642.3721.0424-羟基-3-甲氧基苄醇4-Hydroxy-3-methoxybenzyl alcoholC8H10O31541.0824.0463-羟基-4-甲氧基苯甲酸3-Hydroxy-4-methoxybenzoic acidC8H8O41681.3925.0653,4,5-三甲氧基苯酚3,4,5-TrimethoxyphenolC9H12O41841.61026.221丁香醛3,5-Dimethoxy-4-hydroxybenzaldehydeC9H10O41822.71127.1534-烯丙基-2,6-二甲氧基苯酚Phenol,2,6-dimethoxy-4-(2-propen-1-yl)-C11H14O31941.81227.743未知12.11327.9034-羟基-3-甲氧基肉桂醛2-Propenal,3-(4-hydroxy-3-methoxyphenyl)-C10H10O31.71428.0655-乙酰氨甲基-4-氨基-2-甲基嘧啶4-((1E)-3-Hydroxy-1-propenyl)-2-methoxyphenolC8H12N4O18018.01532.897二苯基乙酸甲酯Benzeneacetic acid,a-phenyl-, methyl esterC15H14O22262.51633.399未知24.11744.911未知33.2合计52.2乙酸乙酯相120.991(E)-2-甲氧基-4-(1-丙烯基苯酚)Phenol,2-methoxy-4-(1Z)-1-propen-1-yl-C10H12O21642.7222.424未知1Tridecane, 7-methyl-C14H301982.4326.222丁香醛3,5-Dimethoxy-4-hydroxybenzaldehydeC9H10O41821.9427.889松柏醛2-Propenal,3-(4-hydroxy-3-methoxyphenyl)-C10H10O31785.2527.996未知237.4630.038未知34.5744.922醌茜素1,2,5,8-tetrahydroxy anthraquinoneC14H8O62723.5846.734芥酸酰胺ErucylamideC22H43NO3371.7合计59.3石油醚相131.977棕榈酸甲酯Methyl hexadecanoateC17H34O22702.7235.330亚油酸9,12-Octadecadienoicacid, methyl esterC19H34O22948.3335.444顺式-十八碳烯酸methyl11-octadecenoate Phthalic acid,C19H36O22963.9443.244邻苯二甲酸单酯mono-(2-ethylhexyl) esterC16H22O42782.7546.745油酸酰胺OleamideC18H35NO2813.6657.537γ-谷甾醇Stigmast-5-en-3-ol,(3b,24S)-C29H50O41422.5759.997未知124.9861.966未知21.2合计69.8
甲醇相中的离子流程图共得到129峰,按上述原则鉴定出的主要有机化合物含量占总峰面积的52.2%(表2),相对含量较大的几种物质为:5-乙酰氨甲基-4-氨基-2-甲基嘧啶(18.0%)、未知物质2(4.1%)、未知物质3(3.2%)、丁香醛(2.7%)等(表2)。乙酸乙酯相中的离子流程图共得到75峰,按上述原则鉴定出的主要有机化合物含量占总峰面积的59.3%,相对含量较大的几种物质为:未知物质2(37.4%)、松柏醛(5.2%)、未知物质3(4.5%)、醌茜素(3.5%)等。石油醚相中离子流程图共得到91峰,通过质谱系统检索并与标准谱图进行核对,相似度大于85%的主要有机化合物含量占总峰面积的69.8%。其中相对含量占优势的为未知物质1(24.9%)、γ-谷甾醇(22.5%)、亚油酸(8.3%)、顺式-十八碳烯酸(4.0%)、油酸酰胺(3.6%)等。
3 结论与讨论
3.1 抑制物的生物活性测定
张艳杰等采用系统溶剂法分离了南方红豆杉种皮和胚乳中的抑制物质,并进行了抑制活性测定,结果发现,甲醇相的抑制性几乎达到100%,从而猜测甲醇相中含有较多的抑制物[17];韩宝瑞等在证明西洋参果实中存在发芽抑制物的同时,发现乙醚相和甲醇相的抑制效果大于其他各组分[23];孙晓刚等在研究凤丹(Paeoniaosstii)种子胚乳中内源抑制物质活性及其成分组成时发现,凤丹胚乳各有机溶剂萃取液对白菜种子发芽率和幼苗高生长、根长生长均有不同程度的抑制作用,但抑制物质活性存在一定差异,乙醚相的抑制效果最强,其次是甲醇相[24]。在本研究中,绿山楂种子各有机相的生物测定结果(表1)表明,各分离组分对白菜种子的发芽均有一定的抑制作用,抑制作用最强的是乙醚相,其次是甲醇相。这与前人研究结果基本一致。
3.2 内源抑制物对种子萌发的影响
已有研究发现,造成种子休眠的内源抑制物种类较多,主要包括ABA 、醛类、有机酸、氢氰酸、芥子油、香豆素类、氨以及脂肪酸等。郭廷翘等研究发现,水曲柳(FraxinusmandshuricaRupr)种子中的ABA以及油酸、亚油酸等长链脂肪酸都可以抑制该种子的萌发[25]。棕榈酸甲酯也已被证实对玉米、黄豆、黄瓜、水稻4种作物胚根、胚芽的生长有显著抑制作用[26]。酚类物质常存在于某些植物的器官中,多数酚类物质对种子萌发也会起抑制作用。杨晓玲等研究表明,层积后尚未解除休眠的山楂种子,种仁和种皮中酚类物质虽有下降,但降低不明显,而解除休眠后的种子中酚类物质下降明显,因此该种子休眠的解除可能与酚类物质含量的下降有关[27]。还有一些研究发现:羟基苯甲酸、香草酸、香豆素等会明显抑制春小麦胚根和胚芽生长[28],这也可能是抑制种子萌发的物质。
本研究中绿山楂种子的乙醚相、甲醇相、乙酸乙酯相中也被检测出上述被证实过的某些内源抑制物,如酚类物质、亚油酸、棕榈酸甲酯、蒽醌类、醛类和酰胺类等,且相对含量较多。因此推测,这可能是造成绿山楂种子休眠的原因之一,也有可能是几种物质相互作用从而导致种子休眠。本次石油醚相中检测到的主要化合物为有机酸类、酰胺类和醇类等物质,以往的研究表明,这些物质中有的也是造成种子休眠的原因,但本次石油醚相的生物活性测定结果(表1)表明,该相的抑制活性较弱,这可能是由于这些物质在该相中的含量较低造成的。由于GC-MS技术只能确定某一物质的相对含量,不能确定其真正的含量,因此今后有必要继续对造成绿山楂种子休眠的内源抑制物的含量进行测定。另外,这些内源抑制物的中浓度还需要通过购买标样的方式进行确定,以最终确定哪些内源抑制物是造成绿山楂种子生理休眠的重要原因。本次在各相中或多或少都存在一些未知物质,可能是计算机图库未比对出这些物质,也可能是几种物质的混合物没有完全分离,具体原因还有待进一步研究。根据生物活性测定(表1),水相对白菜籽发芽也具有一定的抑制作用,但由于仪器的限制,水相中具体的抑制物质也未能确定出来。

