利用高分辨率熔解曲线技术进行猪亲子鉴定的研究
陈焱森,谢 苏,沈永巧,张淑君,黄 涛
(1.石河子大学动物科技学院,新疆石河子 832000;2. 华中农业大学动物科技学院,动物遗传育种与繁殖教育部重点实验室,湖北武汉 430070;3. 乌苏市畜牧兽医站,新疆乌苏 833300)
亲子鉴 定(Identification in Disputed Paternity)是指确定是否为父亲与子女的亲生关系[1]。目前国内外已经开展了动物的亲子鉴定工作,如马匹[2]、奶牛[3]、肉牛[4]、东北虎[5]、绵羊[6]、豚鹿[7]等动物亲子关系的确认都已成功解决,但在猪上的高效亲子鉴定方法还需进一步研究,并且在猪的育种中,亲子鉴定是一种防止人工出错的有效手段。
传统的亲子鉴定方法有标准抗血清法、多价抗血清法与蛋白电泳区分法等方法,但准确率均较低[2]。随着微卫星研究的深入,其在亲子鉴定中的应用逐渐增多。微卫星是DNA重复序列[8],故又称简单重复序列(Simple Sequence Repeats,SSR)。 1998年,Jeffreys等[9]对SSR做了进一步探究,并使之成为新一代分子遗传标记。对SSR产物的传统检测方法是在PCR反应结束后,对扩增产物进行聚丙烯酰胺凝胶电泳[10],后发展为可以通过毛细管电泳的方法在自动分析仪上完成,提高了工作效率,但在电泳前仍需对PCR产物处理(如脱盐)。SSR的扩增产物也可以在自动测序仪上进行电泳分析,但要求PCR所用引物分别进行荧光标记,使成本增加。所以,寻求操作简单、高效的SSR标记检测方法具有重要意义。
2003年,美国Utah大学的Wittwer实验室首次提出了基于新型饱和荧光染料LCGreen而发明基因突变检测的高分辨率熔解曲线新技术(High-Resolution Melting Curve Analysis,HRM)[11]。HRM主要是根据DNA序列长度、GC含量以及碱基互补性差异,通过PCR之后的熔解曲线分析检测PCR片段的微小序列差异,其分辨精度可以达到对单个碱基差异的区分[12-13]。陈焱森等[14]采用HRM技术成功对猪的微卫星多态性进行了检测。
本次研究采用HRM技术对猪的微卫星进行多态性检测,进而进行猪亲子鉴定,期望探究出一种新的快速和准确的猪亲子鉴定方法。
1 材料与方法
1.1 实验材料 本实验动物选自新疆天康加美育种有限公司,其中包括系谱明确的杜洛克猪9头、长白猪6头和大白猪33头,各品种公母比分别为1:8、1:5与9:24,共采集猪耳组织样48个,系谱结构如图1。使用血液/细胞/组织基因组DNA抽提试剂盒提取全基因组DNA,再利用核酸浓度测定仪测定浓度与纯度,用超纯水将DNA浓度稀释到20 ng/μL,并放于-20 冰箱中备用。

图1 48个样品系谱
主要仪器:PCR仪(Bio-Rad,USA),垂直电泳槽(北京六一仪器厂),罗氏LightCycler®96荧光定量PCR 仪(Roche,Germany),水平电泳槽(北京六一仪器厂),电泳凝胶成像系统(Bio-Rad,USA)。
HEM试剂:LightCycler 480 High Resoluting Melting Master试剂盒(Roche,Germany),荧光定量八联管带盖(Roche,Germany)。非变性聚酰胺凝胶电泳主要试剂:2×Taq MasterMix(内含染料,北京康为世纪生物科技有限公司)。单克隆测序试剂:聚丙烯酰胺凝胶电泳DNA回收试剂盒(北京索莱宝科技有限公司,北京),T载体(Promega Corporation,USA),感受态细胞(北京全式金生物技术有限公司,北京)。
1.2 微卫星位点的选取 从国际动物遗传学学会(ISAU)推荐用于亲子鉴定和国际粮农组织提供的微卫星座位中选取55个分布在各个染色体的微卫星,并从NCBI中查询引物,没有查询到结果的利用Primer 5 软件自行设计,并送上海生工生物工程技术服务有限公司合成,具体见表1。
1.3 微卫星检测方法
1.3.1 PAGE 检测 PCR 反应体系为 15 μL :2×Taq Master-Mix 7.5 μL,上、下游引物各 0.5 μL(10 μmol/L)和DNA 0.5 μL(25 ng/μL ),用无菌水补全。PCR 程序:94 120 s;95 30 s,退火温度 30 s,72 30 s,循环35次;72 600 s。采用10%聚丙烯酰氨凝胶电泳,银染显色,拍照、观察和记录结果。
1.3.2 HRM 检测 采用 LightCycler®480 HRM Master Mix试剂盒。PCR反应体系为20 μL:2×饱和荧光染料10 μL,DNA0.5 μL(25 ng/μL) ,上、下游引物各 0.5 μL(10 μmol/L)和 Mg2+2 μL,用无菌水补齐。PCR 程序:95 600 s;95 10 s,退火温度(表1) 15 s,72 15 s,循环50次;95 60 s,40 60 s,65 1 s,97 1 s。PCR 结束后用 LightCycler®96SW1.1 软件进行数据分析。
1.3.3 单克隆测序 将PCR产物用10%聚丙烯酰胺凝胶电泳,切下目的条带,再利用DNA回收试剂盒按说明书回收DNA,连接T载体,转化到感受态细胞,涂板过夜培养,挑菌,摇菌,做菌液PCR鉴定,把有目的条带的菌液送上海生工进行测序。
1.4 亲子鉴定 基于非父排除率的方法有3种情况:第1种是双亲都未知;第2种是双亲只知其母;第3种是双亲均知。所有遗传参数数据处理均用Cervus3.0处理。
2 结 果
2.1 微卫星的筛选结果及基因分型 通过非变性聚酰胺凝胶电泳实验,从55个微卫星中筛选出12个适于HRM的微卫星,利用HRM技术对12个微卫星进行多态性检测,结果如表2所示,SW951微卫星基因型数最多,为9个;S0107与S0003微卫星基因型数都为8;SW511(图2,以此为例)和SW1953微卫星基因型数均为7个,SW72、SW271及S0005微卫星基因型数都为6个,SW29微卫星基因型数有5个,SW2155与SW2448微卫星基因型数都为4个,S0218微卫星基因型数为3个。

表1 55个候选微卫星引物信息

续表1

表2 12个微卫星信息(n=48)

图2 PAGE对SW511微卫星位点分型结果
2.2 HRM检测结果 以HRM技术对所筛选到的12个微卫星进行多态性检测,得到结果均与PAGE检测结果相同。HRM检测结果图以SW511为例(图3)。
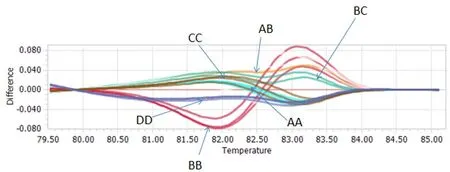
图3 HRM对SW511微卫星位点分型结果
2.3 SW72微卫星单克隆测序结果 对SW72微卫星位点的所有基因型进行单克隆测序,以检验HRM技术检测的基因型是否正确。利用PAGE获得SW72微卫星6个基因型的条带(图4),再分别切出目的条带进行克隆测序,结果显示样品1的3个条带分别有14、10和10个重复,为杂合子;样品5的2个条带都有14个重复,为纯合子;样品7的3个条带都有9个重复,为纯合子;样品8的2个条带都有10个重复,为纯合子;样品9(图5,以此为例)的4个条带分别有14、9、14和9个重复,为杂合子;样品38的3个条带都有15个重复,为纯合子。由HRM结果与测序结果对比,可以得出HRM检测微卫星具有准确性。每个样本切取目的条带和测序峰图结果展示均从上往下。
2.4 基因频率分析结果 12个微卫星位点在48个DNA样中的结果分析,得出每个微卫星座位的等位基因频率(表3)。12个微卫星位点的等位基因总数为50个,其中S0003、S0107、SW951和SW271等位基因为6个,SW72、SW511及SW1953等位基因为4个,SW2155、SW2448、SW29和S0005等位基因为3个,

图4 SW72微卫星PAGE实验的6个基因型结果

图5 SW72微卫星样本9的测序结果

表3 12个微卫星等位基因频率分析
2.5 微卫星标记的群体遗传学分析结果 12个微卫星座位群体遗传杂合度(He)平均值为0.595 478,He>0.5表明这12个微卫星位点在该群体遗传变异程度较高;有效等位基因数(Ne)平均值为2.675 482;平均多态信息含量(PIC)为0.539 842,其中S0218微卫星位点为0.155 485,PIC<0.25,属于低度多态,SW2448为0.386 895,0.25<PIC<0.5,属于中度多态,其余10个基因座多态信息含量PIC>0.5,属于高度多态。总体看来,12个微卫星座位在48个DNA样中呈现高度多态性(表4)。

表4 12个微卫星在该群体中的遗传参数(n=48)
2.6 非父排除率分析 利用12个微卫星对48个样本进行亲子鉴定。从表5可见,在2个亲本信息都未知的情况下,非父排除率(E-1P)的累积非父排除率为0.940 095 767;在1个亲本信息已知的情况下,另一个亲本的非父排除率(E-2P)的累积非父排除率为0.991 503 613;在2个亲本信息都已知的情况下,一组亲本信息的非父排除率(E-PP)的累积非父排除率为0.999 875 188。
2.7 利用建立的亲子鉴定体系检测结果 利用建立的基于HRM技术对12微卫星多态性组合检测的亲子鉴定体系,结合系谱,对其中的8个家系(3个家系均进行2个子代检测)的子代进行验证,得到的累积非父排除率结果均大于0.999 9(表6),证明建立了猪高效的亲子鉴定体系。

表5 12个基因座非父排除率分析

表6 亲子鉴定结果
3 讨 论
3.1 用于亲子鉴定的微卫星标记位点 本实验中,通过聚酰胺凝胶电泳实验对55个微卫星多态性进行检测,结果显示部分前人检测的具有多态性的微卫星,在本实验群体中多态程度较低。程文科[15]在对猪的亲子鉴定中,使用了S0386微卫星位点,检测出10个等位基因,而本实验中只检测出2个等位基因;王淑新等[16]对云南的热带雨林区域中的野猪微卫星DNA多态性研究中,检测到IGF-1微卫星位点具有5个等位基因,但本研究中只检测到2个等位基因。出现这种现象的原因可能是:IGF-1与猪的体长性状[17]和生长发育性状相关,经高强度选育的高产种猪可能在长期定向选育中间接对这些微卫星位点进行了选择,而使IGF-1的多态性逐渐消失。本研究中的实验动物来自加拿大的引进种猪,所以本研究只检测到2个等位基因。这也就要求在不同群体或经过长期选育以后,需要检查筛查微卫星标记变异程度。本次实验检测到的具有多态性的微卫星可用于后续亲子鉴定,也更新了用于猪亲子鉴定的微卫星。
3.2 PAGE与单克隆测序检测微卫星多态性的实验条件需优化 在PAGE实验中,聚丙烯酰胺凝胶的浓度根据目的片段的不同而变动。本实验中目的片段在100~350 bp,故选用聚丙烯酰胺凝胶的浓度为8%~12%;由于本实验的检测量大,经历了冬夏季节,其他条件相同时,在冬季时,需要电泳9~10 h才能得到较好的结果,而夏季只需7~8 h,所以在电泳时应注意环境温度变化对实验结果产生的重大影响,这与张文祥[18]在电泳实验中得到的结论一致,同样在进行聚丙烯酰胺凝胶时,冬季需要30~60 min,而夏季为60~90 min,只有凝胶充分凝结,才能得到好的实验结果,这样不宜出现“微笑”和模糊条带;本实验在判断基因型中,如在目的条带的上方出现1条较浅的带,则认为是目的条带的影子带。
在单克隆测序实验中,应对每个基因型跑3~5个重复,再对每个基因型的每个条带进行重复回收,以提高回收的浓度,便于单克隆测序连接;在连接时,应使用4 过夜条件反应,以增加连接率;在挑菌时,挑出3~5个单个菌落到LB液中,增加实验成功率,并在摇菌后,做菌液PCR,检测是否转化成功。
3.3 HRM技术检测微卫星多态性的实验条件需优化HRM鉴定微卫星多态性时主要受模板DNA浓度、Mg2+浓度、染料和产物长度影响。模板DNA浓度需一致,HRM技术是一种非常灵敏的技术,若DNA浓度不同,会对实验结果产生影响[19],这与本实验中预实验得到的结果相同。本实验的预实验中Mg2+浓度为2~2.5 mmol/L,能取得较好结果,使微卫星不同基因型区分开,并且建议对每对引物都进行Mg2+浓度梯度测试,与尤崇革等[20]在使用不同饱和染料利用HRM技术对SNP基因型分型能力的实验中得出的结果相似。在预实验中,使用了SYBR Green 1 和 ResoLight饱和染料,第1种染料不能区分微卫星基因型,而第2种得到较好结果,这也与饶丹等[21]在HRM中对荧光染料比较实验所得结论相同。本次研究通过聚酰胺凝胶电泳实验对于长度超过350 bp的产物进行了剔除,同样饶婷等[21]在HRM对不同扩增片段的实验中表明产物长度会对实验结果产生影响,并与温立斌等[22]的实验结论相同。
以HRM技术鉴定微卫星多态性,在整个反应和分析过程中,真正实现了闭管操作,这与非变性聚酰胺凝胶电泳技术相比,更好地避免了在转换过程中一些不利因素的干扰;在分析上,HRM技术更迅速和准确,避免了非变性聚酰胺凝胶电泳的染色过程;在一次检测样本量上,HRM技术一次至少可检测96个样本,减少了实验次数;在反应时间上,HRM技术只需要90~100 min即可得出结果,而非变性聚酰胺凝胶电泳至少需要1 d。随着更多更高效、灵敏的HMR分析设备和饱和染料研发成功,HRM技术成本降低,加快了HRM技术的推广。
3.4 微卫星标记的遗传多态性 等位基因数多、高度多态性、相互之间无连锁关系、分布于多条不同染色体上是微卫星标记筛选的基本要求。等位基因的变异在自然界中普遍存在,对基因表达有重要的调控作用,并且其数目越多表明该位点在群体进化过程中的遗传变异越大[23]。本次研究中筛选出的12个微卫星位点的等位基因数平均为4.167个。余国春[24]在猪的亲子鉴定研究中,采用的15个微卫星位点的等位基因数平均为5.2个。
PIC是检测微卫星DNA多态性的一个指标[25]。Botstcin等[26]研究结果表明,当PIC>0.5时,研究对象群体具有高度多态性;当0.25<PIC<0.5时,具有中度多态性;当PIC<0.25时,具有低度多态性。本次实验筛选的12个微卫星中,S0218的PIC<0.25,属于低度多态性,SW2448的PIC处在0.25~0.5,属于中度多态性,为增加累计非父排除率而增加,剩余10个微卫星的PIC均大于0.5,属于高度多态性,12个微卫星的平均PIC为0.539 842 167,这与冯俊伟[27]在长江江豚亲子鉴定中的结果相似,其利用8个微卫星位点在3个群体中的进行了多态高低程度分析,YFPSSR63和YFPSSR67微卫星属于低度多态位点,其余均属于高度多态座位,故本实验筛选的12个微卫星能够对猪进行亲子鉴定。
3.5 微卫星标记组合排除率的对比 Nechtelberger等[28]成功筛选了10个微卫星位点,利用这些位点对采集的大白猪和长白猪以及皮特兰猪的DNA样进行检测,并通过计算得出非父排除率PE为0.920 0;Ellegren等[29]以5个微卫星位点为一组复合扩增,检测结果达到0.980 0以上,若选用10个位点进行复合扩增,非父排除率大大增加,可达0.999 9 ;程文科[15]采集144头猪DNA样,利用微卫星技术对猪群进行研究,结果显示非父排除率PE可达0.9835;余国春[24]选取15对微卫星标记研究2个家猪品种的亲缘关系,结果表明12个微卫星位点鉴别个体亲缘关系的准确率达0.900 0以上。本研究中双亲未知、只知单亲和双亲已知的3种情况计算的累积非父排除率分别为0.940 1、0.991 5和0.999 9,得到的非父排除率可以进行猪的亲子鉴定。
4 结 论
本研究通过非变性聚酰胺凝胶电泳在48个样本中对55个微卫星位点进行筛选,得到了12个适于HRM检测的微卫星,并利用HRM对12个微卫星的多态性进行了检测,进而建立了以HRM技术检测微卫星多态性为基础的快速、准确的猪亲子鉴定体系。

