SIX1基因表达及其多态性与绵羊季节性繁殖和产羔数的关联分析
李春艳,狄 冉,张 彦,任春环,张子军,刘秋月,胡文萍, 王翔宇,张效生,张金龙,储明星*
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.安徽农业大学动物科技学院,安徽合肥 230036;3.天津市畜牧兽医研究所,天津 300381)
大多数绵羊属于季节性发情的一胎单羔品种,仅有少数绵羊属于一胎多羔品种且其分布受地域限制[1],因此,在自然状态下很难提升绵羊的产业经济效益。随着现代科技发展,人们开始利用分子标记辅助选择结合常规育种来提升育种效率,主要是通过寻找与绵羊产羔数有关的主效基因或遗传标记[2],以此筛选高繁殖力绵羊群体。目前,研究者主要应用基因组学方法筛选与绵羊繁殖力有关的候选基因及分子标记,并通过全基因组重测序发掘功能基因以解释绵羊多羔机理[3-4]。本课题组前期对多个绵羊品种的多个个体进行全基因组重测序并进行分组(单羔且季节性发情组和多羔且常年发情组),利用群体分化指数(Fst)法对多羔组和单羔组分化程度进行分析(0<Fst<1,值越大表示遗传分化程度越高)和鉴定选择信号,从而筛选绵羊多羔相关基因,定义 Z(Fst)>5 为显著位点[5]。其中,利用Fst方法对单、多羔组绵羊进行分化程度分析并鉴定选择信号,结果筛选到SIX1(Sineoculis Homeobox Homolog 1)基因g.69738971 T>G位点。
同源盒基因SIX1为SIX转录因子家族成员[6],该基因可与一些辅助因子Eya1、SIX4等共同作用抑制或活化基因表达[7],能促进动物胚胎发育[8]和细胞增殖与分化[9]、抑制凋亡[10]等。本研究主要检测小尾寒羊繁殖组织中SIX1基因表达特征,并对不同绵羊群体重测序筛选出来的SIX1基因g.69738971 T>G位点多态性进行分析,以揭示SIX1基因与绵羊繁殖的关系,并确认该位点突变对产羔数的影响。
1 材料与方法
1.1 qPCR样品采集 小尾寒羊来自天津市畜牧兽医研究所试验基地。课题组前期挑选2~3岁的健康状况良好的小尾寒羊,颈静脉采血后进行Taqman分型获得FecB野生纯合型(++)母羊群体,根据产羔数记录(连续3胎仅产1羔的母羊记为单羔组,连续3胎均产2羔或2羔以上的母羊记为多羔组)对其进行同期发情处理获得卵泡期FecB++型(排除FecB基因突变对母羊产羔数的影响)小尾寒羊6只,单羔组和多羔组各选3只。屠宰绵羊后迅速采集卵巢、输卵管、子宫体、大肠、小肠、骨骼肌、脂肪、肾脏、脏脏、肾上腺等新鲜组织样,分别装入2 mL RNase-Free冻存管后立即置于液氮中暂时保存。样品带回实验室后转存于-80 冰箱。
1.2 RNA提取和cDNA合成 利用动物组织总RNA提取试剂盒(北京天根生化科技有限公司)加Trizol(Invitrogen)提取各组织总RNA,并用Nanodrop 2000检测所提RNA浓度及OD值,用1.0%琼脂糖凝胶电泳检测RNA完整性。质检合格的RNA用于反转录,通过cDNA快速合成试剂盒(TaKaRa)反转录合成cDNA,具体操作参照试剂盒说明,全程操作在冰上完成。
1.3 引物设计 参照GenBank提供的绵羊SIX1基因mRNA序列(登录号:NM_001174113.1),利用Primer 5.0软件进行跨外显子引物设计,以β-actin基因(登录号:NM_001009784)作内参。引物由北京天一辉远生物科技有限公司合成。引物具体信息见表1。
1.4 qPCR 根据课题组前期设置的qPCR体系和程序[11],建立和绘制目的基因及持家基因的标准曲线,检测引物扩增效率(表1)和熔解曲线(图略),并进行qPCR反应以检测目的基因的相对表达量。
1.5 分型样品 分型用的血液DNA样分别来自多羔的小尾寒羊(407只,采样前期分别记录其中380只羊在前3胎中的产羔季节、胎次与产羔数)、湖羊(101只)、策勒黑羊(52只)和单羔的滩羊(22只)、苏尼特羊(21只)、草地型藏羊(161只),每个样用量为 20 μL,DNA 浓度为 40~80 ng/μL。利用 Sequenom MassARRAY®SNP技 术[12]对SIX1基 因 g.69738971 T>G位点进行基因型检测。
1.6 统计分析 根据2-ΔΔCt法计算目的基因相对表达量;借助Microsoft Excel 2013计算SIX1基因g.69738971 T>G位点的基因型频率、等位基因频率、多态信息含量(PIC)、杂合度(He)及有效等位基因数(NE),并进行Hardy-Weinberg检测;通过yijkl=μ+LSi+Pj+Gk+eijkl模型进行最小二乘方差分析,此模型中:yijkl为产羔数记录值、μ为群体平均值、LSi为第i个产羔季节的固定效应值、Pj为第j个胎次的固定效应值、Gk为SIX1基因第k种基因型的固定效应值、eijkl为随机残差效应值,并利用SPSS 19.0软件中一般线性模型分析小尾寒羊基因型与产羔表型数据的关联性,所得数据用平均值±标准误表示。
2 结果与分析
2.1 不同产羔数小尾寒羊繁殖组织中SIX1基因表达如图1所示,卵泡期小尾寒羊的卵巢、子宫体、输卵管组织中SIX1基因均有表达;其中,卵巢和输卵管组织中该基因在单羔组和多羔组之间的表达差异都不显著(P>0.05),单羔组子宫体该基因表达量显著高于多羔组(P<0.05)。
2.2SIX1基因多态性分析 通过分型发现绵羊g.69738971 T>G位点共存在3种基因型,分别是TT、GT和GG(图2)。
从表2可知,g.69738971 T>G位点基因型频率和基因频率在单、多羔品种即季节性发情和常年发情品种间的差异均达极显著水平(P<0.01);在常年发情的品种中GT基因型占优势,而季节性发情品种中GG基因型占优势;在高、低繁殖性能的绵羊品种中G等位基因均占优势。

表1 荧光定量引物信息
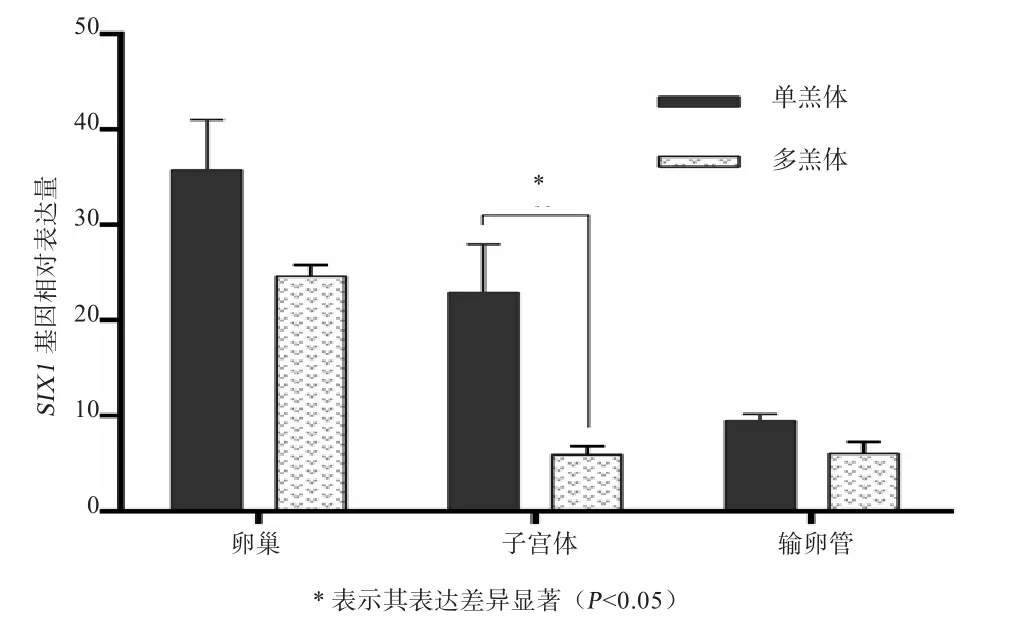
图1 不同产羔数小尾寒羊繁殖组织中SIX1基因表达
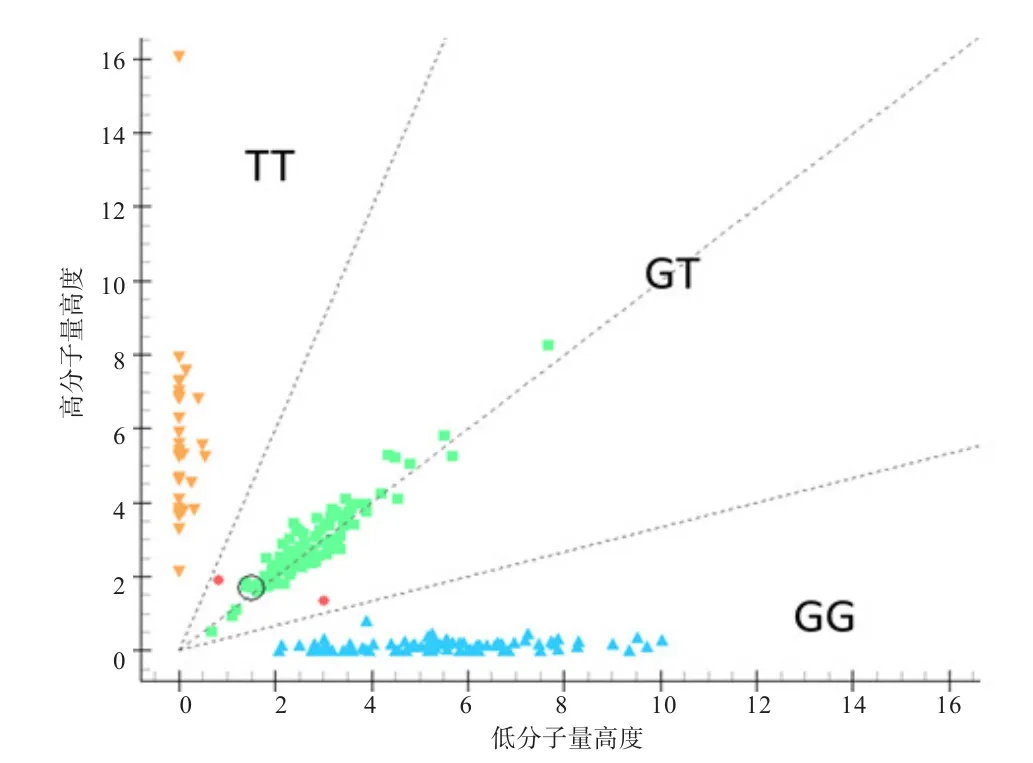
图2 SIX1基因g.69738971 T>G位点分型结果
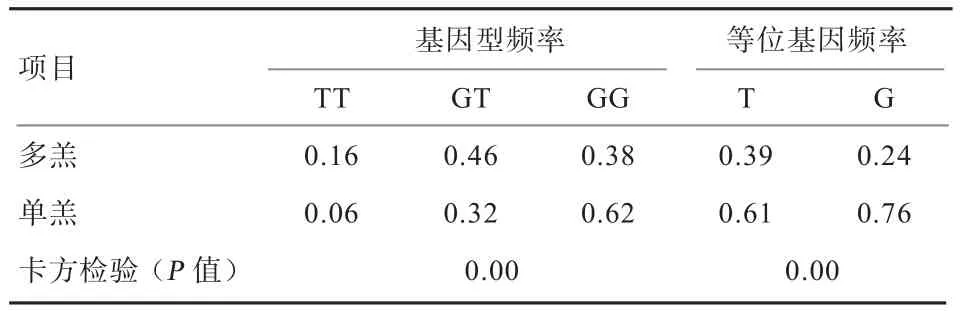
表2 SIX1基因g.69738971 T>G位点在单、多羔绵羊(高、低繁殖性能)品种中的基因型频率和等位基因频率
由表3可知,SIX1基因g.69738971 T>G位点在单羔滩羊、草地型藏羊和多羔小尾寒羊、湖羊及策勒黑羊群体中均呈现中度多态(0.25≤PIC<0.5),而在单羔的苏尼特羊群体中呈低度多态(PIC<0.25);卡方适合性检验结果表明该位点在单、多羔绵羊群体中均处于Hardy-Weinberg平衡状态(P>0.05)。
2.3SIX1基因g.69738971 T>G位点与小尾寒羊产羔数的关系 由表4可知,g.69738971 T>G位点野生型(TT)的各胎次产羔数显著(P<0.05)高于突变型(GT和 GG)。
3 讨 论
绵羊产羔数相关基因筛选对阐释其产羔分子机制有重要意义,目前在绵羊群体中寻找多羔基因的工作亦属于绵羊分子遗传育种方面的一个热点,但在我国本土绵羊中被发现的产羔相关的候选基因并不多[13]。本研究通过对绵羊全基因组重测序筛选到SIX1基因,并发现其Fst值在单、多羔绵羊群体间的差异达显著水平,推测其可能与绵羊产羔数有关。
3.1SIX1基因表达分析 早期研究发现SIX1基因在脊椎动物眼[14]、耳[15]、肾[16]、骨骼肌[17]等组织中均有表达。Soay绵羊垂体结节部SIX1基因表达与发情诱导因子Eya3、TSHβ等有关[7,18],所形成的转录复合体可导致HPGA系统性激素分泌变化,从而调控绵羊发情和繁殖[19],提示SIX1基因表达与绵羊繁殖有关。本试验结果显示,SIX1基因在小尾寒羊繁殖组织(卵巢、输卵管、子宫体)中均表达,且单羔组的子宫体中SIX1基因表达量显著高于多羔组,进一步验证了SIX1基因与绵羊繁殖相关,推测该基因可能与子宫中孕体着床、胎儿发育等有关。
3.2SIX1基因与绵羊繁殖性状的关系 目前为止,未见该基因多态与动物繁殖性能关联的报道。本研究中,在绵羊SIX1基因g.69738971 T>G突变位点上,在小尾寒羊、湖羊、策勒黑羊、滩羊及草地型藏羊共743只中均检测到TT、GT、GG 3种基因型,且其位点在这些绵羊群体中均表现为中度多态(0.25≤PIC<0.5);而该突变位点在苏尼特羊(共21只)中仅检测到GT和GG共2种基因型,并表现为低度多态(PIC<0.25)。这可能与本研究所选择的绵羊尤其是苏尼特羊数量较少有关,也可能是由于品种间的差异造成。另外,g.69738971 T>G位点在各绵羊群体中处于Hardy-Weinberg平衡状态表明该突变位点可以稳定遗传。SIX1基因g.69738971 T>G属于内含子突变,但该突变位点的基因型频率和等位基因频率在季节性发情绵羊品种和常年发情绵羊品种间均存在极显著差异,且该突变使小尾寒羊群体中母羊的产羔数有减弱趋势,即野生型的产羔数显著高于突变型。以上结果表明,SIX1基因g.69738971 T>G位点突变与发情季节性和产羔数存在一定关联,有作为调控绵羊繁殖性状分子标记的潜力。
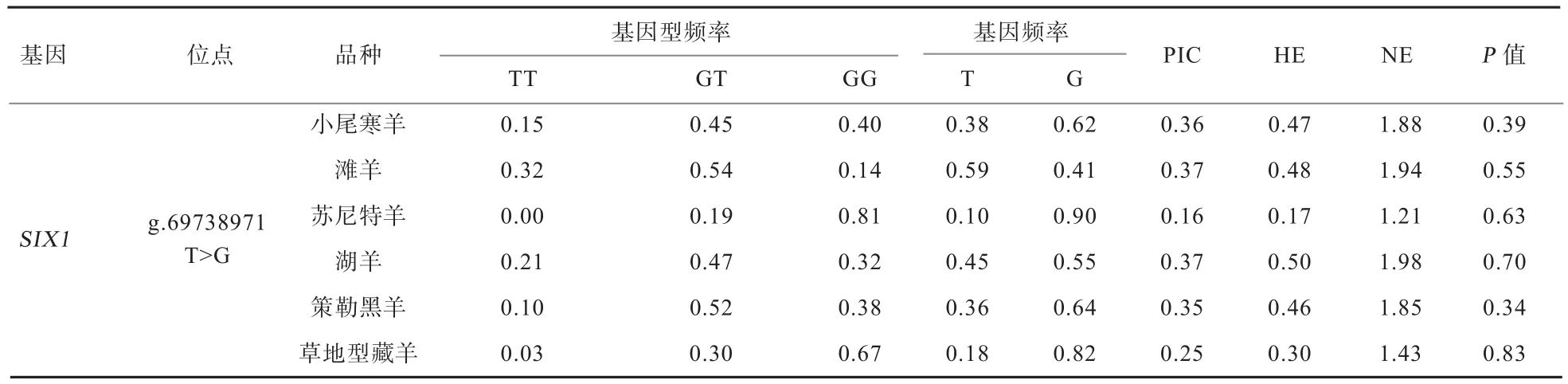
表3 不同品种绵羊中SIX1基因g.69738971 T>G位点的遗传学分析

表4 SIX1基因g.69738971 T>G位点各基因型小尾寒羊产羔数最小二乘均值及标准误
4 结 论
本研究结果提示,SIX1基因在小尾寒羊繁殖组织中表达,且单羔组子宫体中SIX1基因表达量显著高于多羔组。SIX1基因g.69738971 T>G位点突变与绵羊发情季节性极显著相关,且其与产羔数存在一定程度的负相关。因此,SIX1基因g.69738971 T>G位点突变可作为调控绵羊繁殖性状的候选基因位点用于分子标记辅助选育。

