鹅FAR1基因克隆与表达分析
安 晨 ,杜 垒 ,2,顾天天 ,罗 璇 ,路 璐 ,徐 琪 *,陈国宏
(1.扬州大学动物科学与技术学院,江苏扬州 225009;2.扬州市邗江区农业委员会,江苏扬州 225009)
我国养鹅历史悠久,品种资源丰富。鹅与其他家禽一样,有着较强的就巢习性,浙东白鹅作为我国一个优良的地方品种,也具有极强的就巢性。鹅的就巢性与卵泡发育密切相关,家禽的卵泡发育和等级的建立是由多因素共同调控的复杂的生物学过程[1]。
脂肪酰基辅酶A还原酶1(Fatty Acyl-CoA Reductase 1 ,FAR1)为FAR1蛋白参与脂肪酸向脂肪醇的转化所必需,同时也是合成单酯和醚脂所必需的。Cheng等[2]研究显示,FAR1和FAR2cDNA编码可将脂肪酸还原为脂肪醇的同工酶。Honsho 等[3]研究发现,FAR1作为一种缩醛磷脂合成的限速酶,其在中国仓鼠卵巢细胞表达增强了缩醛磷脂合成。研究证明,在长链脂肪酸的重要生物代谢合成过程中,FAR起正向调控作用[4]。以上研究表明,FAR1参与调控脂类合成。
一般认为,禽类卵巢没有合成脂质的能力,卵泡脂质几乎全部源于肝脏。但最近有研究发现,体外培养的鹅等级卵泡颗粒细胞能大量合成脂质[5];杨星[6]也发现,在小鼠围排卵期,卵子及颗粒细胞中存在着细胞内脂滴储备。本课题组前期通过高通量测序发现FAR1参与FSH介导的鹅颗粒细胞增殖[7],但FAR1在鹅的不同生理时期表达规律尚不清楚。本研究克隆了鹅的FAR1基因,并利用 RT-qPCR 检测浙东白鹅不同等级卵泡和不同就巢时期间 mRNA 表达变化,以期探明FAR1在鹅生殖调控中的作用。
1 材料与方法
1.1 实验材料及来源 选取产蛋时期和3个不同就巢时期(前期:刚刚就巢时,母鹅神情安静专注,双翅半张,把蛋置于腹下和翅下,并经常用脚和喙翻蛋;中期:就巢前期持续5~7 d后,每天蹲伏时间大于前期,饮食饮水次数较前期大大减少;后期:就巢鹅每天卧息时间逐渐减少,开始出巢走动,变得活泼)的浙东白鹅母鹅各3只,安乐死后立即取其卵巢和卵泡。刺破卵泡,将卵泡与卵巢用PBS缓冲液清洗3~4次,去除卵黄物质。所有实验母鹅均来自于江苏省泰州市国家级水禽基因库。
1.2 实验器材及试剂
1.2.1 实验器材 实验所需使用的所有剪刀、镊子、无酶枪头、离心管、PCR 管等耗材均经高压灭菌后60烘干备用。
超低温冰箱、电子天平、超净工作台、漩涡混合器、高速冷冻离心机、琼脂糖水平电泳槽、电泳仪、凝胶成像系统、电热恒温水浴锅、PCR仪等。
1.2.2 实验试剂 Trizol Reagent、反转录试剂盒、FastQuant cDNA第1链合成试剂盒、DNA Marker DL2 000来自于天根生化科技有限公司;pMD19-T载体、LA Taq、E.coli DH5αCompetent Cells、MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0来自于TaKaRa生物公司;SYBR®Green Master Mix来自于南京诺唯赞生物科技有限公司。
1.3 总RNA提取与cDNA合成 采用 Trizol Reagent分别提取鹅卵巢、卵泡组织的总RNA。取2 μg卵巢总RNA,根据反转录试剂盒说明以 Oligo dT 为引物合成cDNA 第一链,放入-80 环境保存备用。
1.4FAR1基因cDNA克隆与测序 以反转录合成的cDNA为模板进行 PCR 反应,RT-PCR 扩增鹅FAR1基因。反应总体系为 20 μL:cDNA 模板 1 μL(100 ng/μL),LA Taq 10 μL,上、下游引物各 1 μL(10 pmol/μL),补充ddH2O至20 μL。PCR扩增程序:95 预变性5 min;95 变性30 s、61 退火30 s、72 延伸2 min,35个循环;72 终止反应10 min;4 保存;1%琼脂糖凝胶电泳检测PCR产物。
经MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0 试剂盒纯化后,连接到 pMD19-T 载体,转化E.coli DH5α感受态大肠杆菌,菌落PCR鉴定为阳性克隆,使用快速质粒小提试剂盒提取质粒,之后送北京擎科新业生物技术有限公司测序。
1.5FAR1基因生物信息学分析 利用 DNAMAN 软件进行同源性比对,用 MEGA 6.0 软件计算奈氏遗传距离矩阵,并以距离矩阵邻接法构建系统进化树。
1.6FAR1基因表达分析 使用实时荧光定量 PCR 对FAR1进行检测(引物见表1)。反应总体系为20 μL:AceQ®qPCR SYBR®Green Master Mix 10 μL,50×ROX Reference Dye 2 0.4 μL, 上、 下 游 引 物 各 0.4 μL(10 pmol/μL),cDNA 2 μL(100 ng/μL),RNase-free dH2O 6.8 μL。反应程序:①预变性:95 5 min ;②循环反应:95 10 s ,60 30 s ,循环40次;③熔解曲线:95 15 s,60 60 s,95 15 s。
1.7 统计分析 对鹅组织样品内标基因GAPDH和目标基因FAR1进行实时荧光 PCR检测,采用2-ΔΔCt法计算相对表达量。采用SPSS 22.0统计软件进行分析。
2 结 果
2.1FAR1基因克隆 以鹅卵巢组织cDNA为模板,DL2000为Maker,RT-PCR产物经1.0%琼脂糖凝胶电泳检测,得到5'端第1次扩增 44 bp,第2次扩增190 bp,2次共计扩增213 bp;3'端第1次扩增85 bp,第2次扩增269 bp,2次共计扩增354 bp。鹅FAR1mRNA序列长为1 869 bp,其中包括83 bp的5'UTR和229 bp的 3'UTR和1 557 bp的开放阅读框,共编码518个氨基酸(图1、2)。
2.2 鹅FAR1基因及其编码的蛋白质分析 为了分析FAR1的进化关系,利用 MEGA 6.0 软件构建了10个物种的分子进化树,通过自引导检验获得的系统分支置信度(重复1 000次),分为哺乳动物、禽类、植物和菌四大类。由图3可知,在鹅与野鸭之间自展值较高为97,可信度高,说明鹅与鸭的亲源性最高。采用DNAMAN分析各物种间同源性,结果显示鹅与鸭直接同源性最高为85.52%,符合进化树结果。

表1 PCR 引物信息
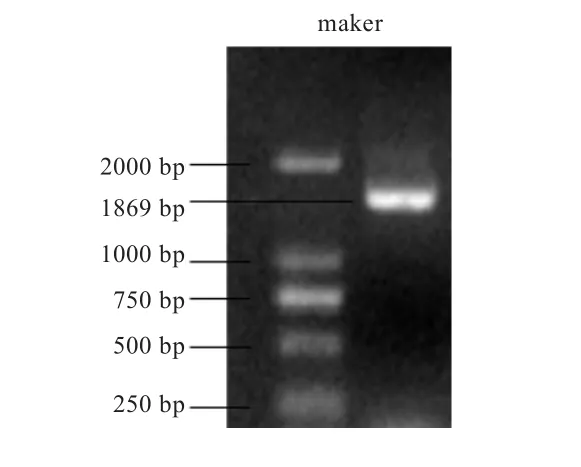
图 1 FAR1基因PCR产物片段

图 2 FAR1 5'RACE(A)和3'RACE(B)扩增
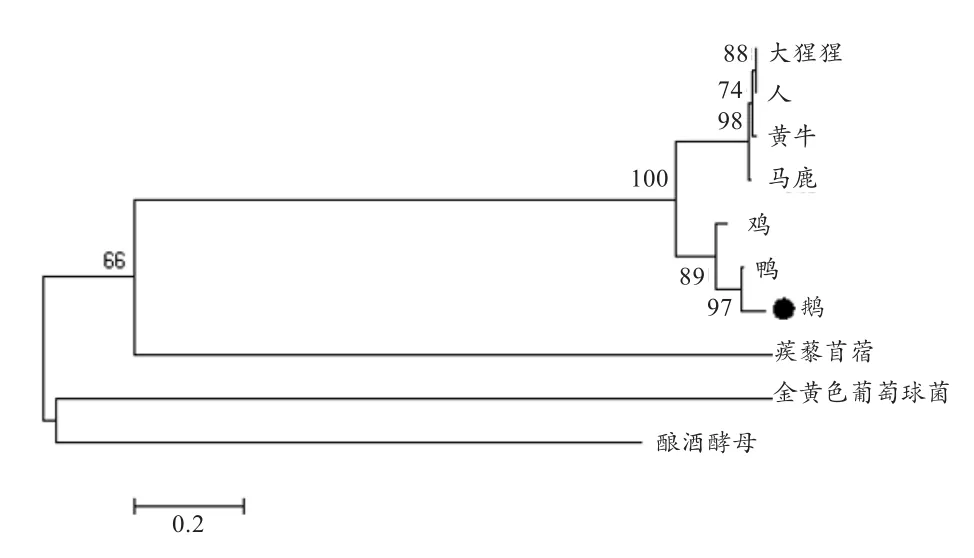
图 3 不同物种推导 FAR1 氨基酸序列构建的进化树
2.3 等级前卵泡与等级卵泡中FAR1的表达变化 如图4所示,卵巢FAR1mRNA 的表达量显著高于等级前卵泡和F5、F4等级卵泡(P<0.05);且等级卵泡表达量高于等级前卵泡(P<0.05);但FAR1mRNA 的表达量在等级前卵泡和等级卵泡中无显著差异(P>0.05)。
2.4 不同就巢时期FAR1的表达变化 如图5所示,FAR1mRNA的表达在产蛋期与就巢期有显著差异(P<0.05),且在就巢后期显著高于就巢前期和中期(P<0.05)。
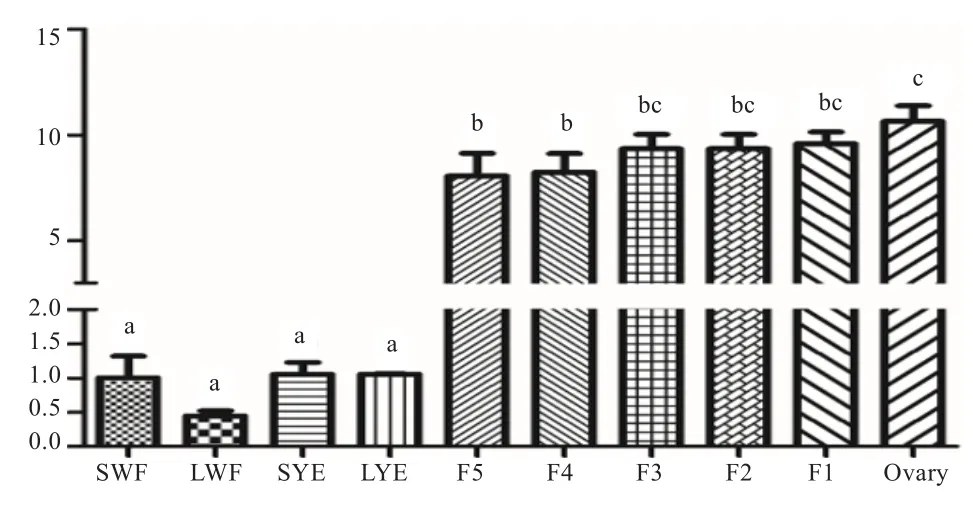
图 4 不同等级卵泡中FAR1 mRNA 相对表达量
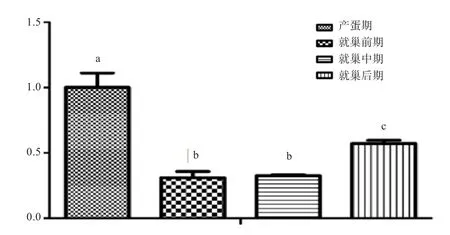
图 5 不同就巢时期FAR1 mRNA 相对表达量
3 讨 论
目前,在家禽中关于FAR1的研究尚无相关报道,因此,本实验在鹅卵巢和不同就巢时期卵泡中研究了FAR1基因。系统进化树分析显示,浙东白鹅、绿头鸭、原鸡三者聚为一类,说明浙东白鹅FAR1基因与鸟类遗传进化距离最近。
Lehtinen等[8]研究发现,可以通过FAR1的过表达提高脂肪醛和蜡酯的生产。Round等[9]在红球藻的研究中发现FAR1促进红球藻蜡积累。Jian-Kai等[10]研究发现,毕赤酵母中FAR1异源表达可以产生脂肪醇。Sturmey等[11]研究表明,内源性脂质可作为卵母细胞和早期胚胎的能量底物。禽类卵黄脂质沉积量会伴随卵泡的发育不断增多,且等级卵泡比等级前卵泡发育速度快,卵母细胞在最后阶段会从血液中快速地摄取营养物质,沉积卵黄[12]。禽类最大卵泡(F1)或蛋黄中脂肪含量丰富,鸡为30%~33%[13],鸭高达36.8%[14]。
目前,普遍认为禽类卵巢脂肪合成能力很低,卵泡中几乎所有脂肪皆源于肝脏[15]。卵泡发育早期脂肪含量少后期多,这与本研究中FAR1表达相似,在等级前卵泡中FAR1表达显著低于等级卵泡。Rizzo等[16]研究发现,正常脂肪醛和醇代谢是表皮分化和功能的关键。因此推测随着卵泡发育,卵泡膜的层数及面积不断扩增,脂肪醛和醇代谢不断增加,FAR1的表达随之增强。
FAR1的稳定性取决于一种细胞中磷脂水平调节的机制[3]。在鹅就巢时期,鹅的采食量下降,卵巢严重皱缩,卵泡停止发育。这一现象使得鹅从体外摄取的脂肪减少,相应的膜类结构减少,推测构成膜类主要成分的磷脂减少又促使FAR1的表达降低,最后在鹅就巢时期FAR1的表达明显低于产蛋期。随着就巢的进行,在就巢后期卵巢皱缩逐渐恢复,相应的磷脂需求增加,FAR1的表达又相应增加。
4 结 论
本研究首次克隆出鹅FAR1cDNA序列,并通过RACE技术扩增获得了FAR1mRNA全长序列,这对更深入地研究FAR1基因的功能提供了参考。此外,本研究还通过对不同等级卵泡和不同就巢时期卵泡FAR1mRNA的表达进行测定,初步确定FAR1在卵巢和卵泡发育中参与其脂类代谢。

