微波消解-ICP-MS测定盐酸黄酮哌酯片中重金属含量
刘 晟,袁 莉
(1. 重庆市食品药品检验检测研究院,重庆 401121;2. 重庆市化学药品质量控制与评价协同创新中心,重庆401121;3. 重庆华邦制药股份有限公司,重庆 401121)
盐酸黄酮哌酯是泌尿道解痉药,目前国内上市有片剂和胶囊剂(规格均为0.1 g和0.2 g),片剂有10家生产企业,胶囊剂(目前厂家均未生产)有2家生产企业。近年,重金属残留造成的药品不良反应的报道逐渐增多,2012年药用胶囊铬超标事件更是造成了重大影响,引起了监管部门的重视。2015年版中国药典虽尚未对西药制剂进行重金属元素控制,药品生产厂家可能分别对原辅料的重金属进行控制,但由于实际生产中不按照申报工艺及SOP标准操作进行生产及生产设备、管道维护不力导致老化等,都可能引入重金属,而制剂成品的出厂检验标准中往往未对重金属进行检测,因此有必要对西药制剂中的重金属进行检测。为此,我们对盐酸黄酮哌酯片剂中的As、Cd、Pb、Hg、Ni元素进行了分析。电感耦合等离子体质谱(ICP-MS)[1]由于检出灵敏、快速、准确,在药品重金属分析中越来越多地受到人们的重视。本文利用微波消解-ICP-MS测定了该药中的As、Cd、Pb、Hg、Ni含量,本方法前处理简单、快速、灵敏度高、重复性好,能实现多个有毒金属元素的同步检测,为该药中有毒金属元素的控制提供了有用的数据。
1 仪器与试药
1.1 仪器
Agilent 7700X电感耦合等离子体质谱仪(美国安捷伦公司);CEM Mars 6-classic微波消解仪(美国CEM公司);BHW-090-20赶酸器(上海博通公司);Milli-Q超纯水处理系统(美国密理博公司)。
1.2 试药
盐酸黄酮哌酯片剂(共107批,购自深圳海王药业等6家公司);多元素(As、Cd、Pb、Ni)混合标准液(100 mg/L,批号151034),Hg标准溶液(1000 mg/L,批号159020-2),购自国家有色金属及电子材料分析测试中心;Ge、In、Bi混合内标溶液(100 mg/L,批号5188-6525),Li、Mg、Y、Ce、TI、Co混合调谐标准溶液(1 μg/L,批号5185-5959),购自美国Agilent公司;硝酸为优级纯(Avantor公司,批号142235);水为超纯水。
2 方法与结果
2.1 ICP-MS仪器条件
等离子气流量15.0 L/min;蠕动泵转速0.10 r/s;雾化室温度2 ℃;辅助气体和载气流量均为0.8 L/min;He气流量5 ml/min;射频功率1550 W;数据采样模式:跳峰采集模式;采样深度8 mm;重复次数:3次;扫描次数100次。
2.2 溶液的配制
2.2.1 内标溶液 取Ge、In、Bi混合内标溶液适量,1%硝酸制成500 μg/L混合内标溶液。
2.2.2 标准曲线溶液 精密量取多元素混合标准液适量,1%硝酸制成0,1,5,10,20,50,100 μg/L混合标准曲线溶液。再精密量取Hg单元素标准溶液适量,1%硝酸制成0,0.2,0.5,1.0,1.5,2.0,4.0 μg/L Hg标准曲线溶液。
2.2.3 供试品溶液 称取样品约0.5 g,精密称定,置于四氟乙烯消解罐内,加硝酸7 ml,旋紧消解罐盖,室温下放置2 h,再微波消解1 h(参数见表1);冷却,转移至25 ml量瓶中,用1%硝酸定容至刻度,摇匀。同法制备试剂空白。

表1 微波消解参数
2.3 方法学考察
2.3.1 线性关系与范围 按2.1项条件将标准曲线溶液和内标溶液同时注入ICP-MS质谱仪,测定并绘制标准曲线(X为溶液质量浓度,Y为元素与内标响应值比值),结果见表2。由表2可见,各元素线性关系良好[2]。

表2 各元素的线性关系、检出限和定量限
2.3.2 检出限和定量限 按2.1项条件连续测定1%硝酸11次,计算各元素的标准偏差,分别以3倍和10倍标准偏差除以对应元素标准曲线的斜率,计算其仪器检出限和定量限,结果见表2。
2.3.3 加样回收率试验 称取样品(深圳海王药业,批号:20151001)约0.5 g,精密称定,分别精密加入低、中、高质量浓度的混合标准溶液(Ni等4种元素分别为125,250,375 ng,Hg分别为12.5,25,37.5 ng),按2.2.3项方法消解,定容至25 ml,每个质量浓度平行测定3份,计算回收率,结果见表3,符合相关规定[2]。各元素回收率的RSD均小于5.0%,符合残留检测要求。
2.3.4 重复性和中间精密度试验 由于样品中部分元素的含量低于检出限,故采用加入混合标准溶液的方式进行重复性和中间精密度试验。称取样品(深圳海王药业,批号:20151001)约0.5 g,精密称定,精密加入0.5 mg/L多元素(Ni、As、Cd、Pb)混合标准溶液0.5 ml和0.05 mg/L Hg标准溶液0.5 ml,按2.2.3项方法进行消解,定容至25 ml,平行测定6份,得到重复性测定结果,各元素含量的RSD均小于5%;连续测定3 d,得到中间精密度测定结果,各元素含量的RSD均小于10%,表明该方法重复性和中间精密度良好,符合相关规定[2]。

表3 平均回收率/%
2.3.5 耐用性试验 分别改变等离子体气流量为15.0±0.2 L/min,蠕动泵转速为0.10±0.02 r/s,雾化室温度为2±0.2 ℃,辅助气体流量为0.8±0.02 L/min,载气流量为0.8±0.02 L/min,He气流量为5±0.2 ml/min,射频功率为1550±20 W,采样深度为8±0.2 mm,测定同一样品溶液,各元素含量的RSD均小于5%,表明该方法耐用性良好。
2.4 含量测定
取盐酸黄酮哌酯片(6家公司107批),按2.2.3项方法制备供试品溶液,注入ICP-MS质谱仪,标准曲线法计算含量,每批样品平行测定2次,结果见表4。
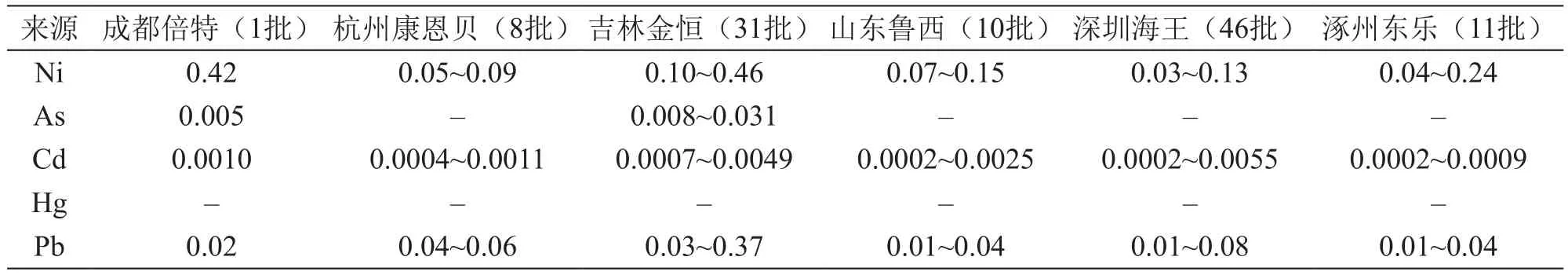
表4 含量测定结果/μg·g-1
3 讨论
3.1 内标法的校正
本研究采用内标法[3],采用质量浓度均为500µg/L的Ge、In、Bi混合溶液作为内标。由于采用ICP-MS进行金属元素分析时,容易受到氧化物和多原子离子的干扰,样品溶液中不同元素的质量浓度的差异也易引起误差,而在线内标法可有效监控和校正信号漂移,有效校正误差。
3.2 消解方法的优化
本研究前期采用的预消解方法为加入硝酸后,不加盖,130 ℃预消解30 min。方法学验证时,Hg的回收率<20%,后分析发现Hg在不加盖预消解时已挥发。因此,将预消解步骤去掉,加入硝酸后,旋紧消解罐盖直接微波消解。方法学验证时,Hg的回收率已符合要求,但在消解过程中偶尔会出现爆管,存在安全隐患。经进一步的优化,预消解方法为加入硝酸后,旋紧消解罐盖,在室温下放置2 h。这样既避免预消解时Hg的损失,又避免由于直接微波消解导致爆管的情况。
3.3 试验结果分析
国外,ICH Q3D元素杂质指南对单一重金属元素按毒性大小进行分类,并按单一元素进行限度控制,欧洲药典委员会和美国药典委员会也计划在即将实施的新版药典中采用ICH Q3D元素指南,取代现行美国药典(USP)、欧洲药典中测定重金属总量的检查方法。该指南自2016年6月起在欧盟范围内对新上市许可申报开始生效,自2017年12月起对已批准的药品生效。覆盖了24种金属(分为1类、2A类、2B类和3类),并给出了其在药品中的允许日暴露量(PDE)。该指南并不仅局限于原料药和辅料中的试剂和催化剂,同时也考虑到了所有生产中可能引入的情况,包括生产设备、水和容器密闭系统。其中第1类As、Cd、Hg和Pb具有较高的毒性,无论是否被有意加入,都需要进行风险评估。国内,中国药典2015年版一部(中药)对部分中药材中的单个重金属进行控制,但中国药典2015年版二部(西药)未对西药中的单个重金属进行控制,中国药典2015年版四部0821重金属检查法测定的是原料药的重金属总量,不涉及制剂,对单一重金属缺乏有效控制。为逐步与国际先进理念接轨,揭示药品重金属残留现状和风险,有必要建立能同时准确测定西药制剂中多种重金属元素的方法,并对药品进行有针对性考察,为企业工艺改进和行政监管提供数据支持。
本次抽验的107批样品测定值均低于中国药典2015年版一部[4]、ICH Q3D元素杂质指导原则[5]和 USP 38[6]中的Ni、As、Cd、Hg、Pb限度值,表明目前市面上的该药品生产质量稳定、可控。同时,该方法的建立也为其他上市西药制剂的风险监控提供了参考方法。

