上调Cdr1as表达对急性心肌梗死大鼠心肌细胞凋亡的影响
张 杰 ,贾丽萍,周 辉,刘 亮,银鹏飞,陈文强 ,苏 兴
1)北大医疗鲁中医院心血管内科 山东淄博 255400 2)北京大学国际医院心内科 北京102200 3)山东大学齐鲁医院心内科 济南 250012
急性心肌梗死(acute myocardial infarction,AMI)是心内科常见的心血管疾病,发病率呈年轻化和上升趋势[1]。冠状动脉急性和持续性缺血缺氧所引起的心肌坏死是死亡的重要原因。心肌细胞凋亡是心肌梗死区和非梗死区发生的重要生理病理现象,研究心肌细胞凋亡的机制,寻找有效的分子靶点已逐渐成为研究热点[2-3]。环状RNA是一类特殊的非编码RNA,含有能够与microRNA结合的位点,能够以海绵分子的形式解除microRNA对靶基因的调控,从而参与癌症、神经系统疾病和心血管疾病的发生发展[4-6]。小脑变性相关蛋白1的反义转录物(cerebellar degeneration-related protein 1 antisense,Cdr1as)是研究较多的环状RNA,有研究[7]发现AMI患者血液中Cdr1as 水平明显升高,Cdr1as可通过介导miR-7a调节靶基因的表达,促发心肌梗死。目前,关于Cdr1as促进心肌梗死的研究资料还较少,其具体的作用机制尚未明确。因此,本研究通过建立AMI大鼠模型,观察Cdr1as在心肌组织中的表达情况,探讨上调其表达诱导心肌细胞凋亡的分子机制。
1 材料与方法
1.1材料42只健康雄性SD大鼠,8周龄,体重220~280 g,购于吉林大学基础医学院动物实验中心。pcDNA和Trizol试剂购于美国Invitrogen公司, pcDNA-Cdr1as质粒购于丹麦奥胡斯大学。GAPDH抗体、Bcl-2抗体、Bax抗体和羊抗鼠IgG-HRP购于美国Cell signaling公司,BCA蛋白浓度检测试剂盒、Caspase-3活性检测试剂盒和RIPA蛋白裂解液均购于上海碧云天公司,TUNEL凋亡检测试剂盒购于武汉博士德公司,反转录试剂盒购于大连TaKaRa公司。心脏彩超仪购于美国ATL公司,酶标仪购于美国PerkinEImer公司,实时荧光定量PCR仪购于美国ABI公司,显微镜购于日本Olympus公司,紫外分光光度计购于美国Nanodrop公司,凝胶成像系统购于美国Bio-Rad公司。PCR引物购于上海吉玛公司。
1.2AMI大鼠模型的建立和实验分组选取适应性较好的SD大鼠32只,以体积分数10%水合氯醛腹腔注射进行麻醉,固定大鼠,将胸前区和颈部毛发剔除,并以碘伏消毒。在暴露的颈部器官处做长为1 cm的切口,连接呼吸机。呼吸机参数设为7~8 mL潮气量,120 次/min呼吸频率,1∶2呼吸时间比。在胸骨左缘第4肋间处剪开皮肤,暴露心脏。显微镜下结扎冠状动脉左前降支(位于左心耳和肺动脉圆锥间)。心电图记录仪观察:当ST段抬高、心率变慢和左心室发白时,表明AMI模型制备成功。将最终构建成功的30只大鼠模型随机分为模型组、空质粒组和Cdr1as组,每组10只,分别于术前12 h心肌内注射等量生理盐水、pcDNA溶液、pcDNA-Cdr1as溶液。另10只大鼠作为假手术组,只行冠状动脉左前降支穿线而不做结扎,术前12 h心肌内注射等量生理盐水。术后1周处死大鼠,取心肌组织储存于温度为-80 ℃冰箱中备用。
1.3心脏功能相关指标的检测和心肌梗死面积的测定①心脏功能检测:在处死大鼠前,对大鼠做心脏彩超,检测左室收缩末期内径(LVDs)、左室舒张末期内径(LVDd)、左室长轴缩短分数(FS)和左室射血分数(LVEF)等指标。②心肌梗死面积测定:取适量心肌组织,2 mm厚切片,以TTC磷酸缓冲液染色20 min。染成红色的为正常心肌组织,染成白色的为梗死心肌组织。采用Image Pro Plus 6.0软件分析。心肌梗死面积=白色区域面积/(白色+红色)区域面积×100%。
1.4心肌组织中Cdr1as的qRT-PCR检测每只大鼠均取1 g心肌组织,加入Trizol试剂提取总RNA,并采用紫外分光光度计测定纯度,再按照反转录试剂盒说明书操作,合成cDNA。Cdr1as上下游引物分别为5’-GTGTCTCCAGTGTATCGGCG-3’和5’-TACTGGCACCACTGGAAACC-3’,内参GAPDH上下游引物分别为5’-GACATGCCGCCTG GAGAAAC-3’和5’-AGCCCAGGATGCCCTTTAGT-3’。 PCR反应体系20 μL:SYBR Green 10 μL、 cDNA 1 μL、上下游引物各1 μL,DEPC水7 μL。反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火20 s, 72 ℃延伸60 s,35个循环;72 ℃总延伸35 min。
1.5心肌细胞凋亡的TUNEL法检测取大鼠心肌组织,5 μm厚切片,抗原修复、脱蜡处理后,用PBST溶液洗涤5 min×3次,再按照TUNEL试剂盒说明书操作。在200倍显微镜下选取梗死区域5个视野,统计凋亡细胞数和总细胞数,以两者比值的百分数表示心肌细胞凋亡指数。
1.6心肌组织中Caspase-3活性的检测严格参照Caspase-3活性检测试剂盒说明书操作,检测大鼠心肌组织中Caspase-3活性。其中,酶标仪检测波长为405 nm。
1.7心肌组织中Bax和Bcl-2蛋白的Westernblot法检测取适量心肌组织,剪碎后以匀浆器制成匀浆,加入裂解液提取总蛋白,并采用BCA蛋白浓度定量试剂盒检测总蛋白浓度。蛋白经沸水浴变性后,上样至12 g/L SDS-PAGE凝胶中分离,再经转膜、封闭处理后,加入1∶1 000稀释的一抗溶液(4 ℃过夜)和1∶2 000稀释的二抗溶液(37 ℃孵育2 h)。经曝光液显影后,以凝胶成像系统扫描,Quantity One 软件分析目的蛋白条带的灰度值,以目的蛋白与内参GAPDH条带灰度值的比值表示目的蛋白表达水平。
1.8统计学处理采用SPSS21.0进行统计学分析,4组间各指标的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 4组大鼠心肌组织中Cdr1as表达水平的比较假手术组、模型组、空载体组和Cdr1as组心肌组织中Cdr1as表达水平分别为(1.02±0.12)、(2.83±0.52)、(2.92±0.45)和(5.98±0.61),4组比较差异有统计学意义(F=29.090,P<0.001)。与假手术组相比,模型组、空载体组和Cdr1as组Cdr1as表达水平升高(P<0.05),而Cdr1as组的表达水平高于模型组、空载体组(P<0.05)。
2.2 4组大鼠心脏功能及心肌梗死面积的比较结果见表1。与假手术组相比,模型组、空载体组和Cdr1as组LVDs、LVDd(P<0.05),而LVEF和FS明显降低(P<0.05);而Cdr1as组心脏功能指标变化幅度较模型组、空载体组更为明显(P<0.05)。Cdr1as组梗死面积大于模型组、空载体组(P<0.05)。

表1 4组大鼠心脏功能和心肌梗死面积的比较
*:与假手术组相比,P<0.05;#:与模型组和空载体组相比,P<0.05
2.3 4组大鼠心肌细胞凋亡指数和心肌组织中Caspase-3活性的比较见图1和表2。与假手术组相比,模型组、空载体组和Cdr1as组心肌细胞凋亡指数和Capase-3活性均升高,Bcl-2蛋白表达降低(P<0.05),而Bax蛋白表达升高(P<0.05);Cdr1as组较空载体组和Cdr1as组的变化更为显著(P<0.05)。

图1 Western blot检测各组心肌组织中Bcl-2和Bax蛋白的表达
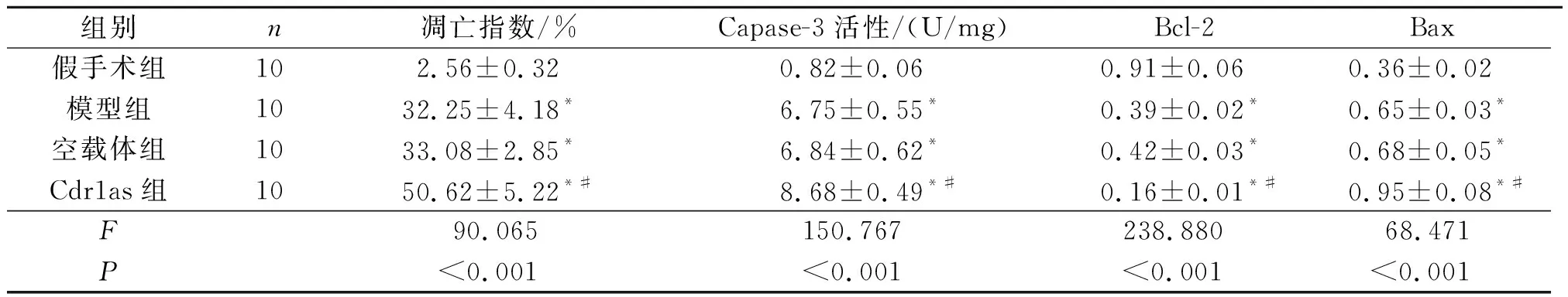
组别n凋亡指数/%Capase-3活性/(U/mg)Bcl-2Bax假手术组102.56±0.320.82±0.060.91±0.060.36±0.02模型组1032.25±4.18*6.75±0.55*0.39±0.02*0.65±0.03*空载体组1033.08±2.85*6.84±0.62*0.42±0.03*0.68±0.05*Cdr1as组1050.62±5.22*#8.68±0.49*#0.16±0.01*#0.95±0.08*#F90.065150.767238.88068.471P<0.001<0.001<0.001<0.001
*:与假手术组相比,P<0.05;#:与模型组和空载体组相比,P<0.05
3 讨论
Cdr1as位于人染色体Xq27.1,具有非线性结构、高表达性和稳定性强等特点,因其具有74个miR-7结合位点,能够竞争性抑制miR-7活性,故又被称为miR-7的环状RNA海绵(ciRS-7)。Li等[8]在帕金森病细胞模型中发现,miR-7能够通过降低Caspase-3活性和调控Bax、SIRT2靶点,抑制神经元的凋亡;Xiong等[9]指出,miR-7可靶向作用于Bcl-2,抑制非小细胞肺癌A549细胞的增殖,促进其凋亡。Cdr1as与多种肿瘤的发生发展关系密切。结直肠癌组织中Cdr1as的表达明显高于正常黏膜组织,与患者预后不良相关[10];C作用于dr1as还是肝细胞癌肝微血管侵袭的危险因素[11]。此外,Cdr1as能够降低胰岛细胞中miR-7的表达,影响胰岛β细胞的活性,参与糖尿病的发生[12]。心肌细胞凋亡是心力衰竭、心肌重塑和心肌重构等发生的重要内在机制。近年来研究[7]显示,Cdr1as在AMI患者中的表达水平明显升高。鉴于Cdr1as与miR-7的调控关系,我们推测Cdr1as可能通过间接调控心肌细胞凋亡参与AMI的进展。因此了解和研究Cdr1as表达与心肌细胞凋亡的关系,对AMI的治疗具有重要意义。
细胞凋亡是一个受多种基因共同调控的过程,Caspase-3是凋亡的效应分子和执行者,可通过激活核酸内切酶使DNA降解断裂,导致细胞凋亡;Bcl-2和Bax是学术界公认的抑凋亡蛋白和促凋亡蛋白,两者结合可形成异二聚体,将凋亡信号传递到Caspase-3,引起细胞凋亡。大量研究[13-14]显示,心肌细胞凋亡往往伴随着Caspase-3活性和Bax表达的升高,以及Bcl-2表达的下降。本研究采用冠状动脉左前降支结扎的方法构建AMI大鼠模型,通过检测大鼠心脏功能指标LVDs、LVDd、LVEF和FS等和心肌梗死面积,证实模型构建成功。qRT-PCR检测发现,通过心肌内局部注射pcDNA-Cdr1as质粒,成功上调了Cdr1as组大鼠心肌组织中Cdr1as的表达。Cdr1as组梗死面积较模型组和空质粒组显著增加,心肌细胞凋亡指数显著升高,Caspase-3活性和Bax表达升高,Bcl-2表达下降,提示上调Cdr1as表达可诱导心肌细胞凋亡,与Weng等[10]的研究结果一致。
综上所述,鉴于Cdr1as与miR-7的调控关系,Cdr1as可能通过间接调控Caspase-3、Bcl-2和Bax的表达,诱导心肌细胞凋亡,促进心肌梗死的发生发展。