转染DNMT1 siRNA对瘢痕疙瘩成纤维细胞生长的影响
杜 萍,侯圣光,张良文,谷兴华
1)潍坊市益都中心医院医学美容科 山东潍坊 262500 2)潍坊市益都中心医院药剂科 山东潍坊 262500 3)齐鲁医院神经外科 济南 250000 4)齐鲁医院心外科 济南 250000
瘢痕疙瘩又称疤痕疙瘩,是一种常见的皮肤纤维组织异常增生疾病,主要临床表现有瘙痒、局部增生和刺痛等,且有一定的遗传倾向。目前关于瘢痕疙瘩的治疗主要有手术切除、放疗和药物治疗等,但治疗效果不十分理想。瘢痕疙瘩的形成是一个复杂的过程,效应细胞——成纤维细胞一直是瘢痕疙瘩研究的热点。DNA甲基化与生物的整个生理过程密切相关,不仅参与了肿瘤的发展,还参与了多种纤维化和增生性疾病的发生[1-2]。DNA甲基转移酶(DNA methyltransferase,DNMT)家族在催化和维持DNA甲基化过程中发挥着重要作用,DNMT1是DNMTs家族中的重要成员之一,在多种疾病中异常表达,参与细胞生理过程[3]。本研究观察了干预瘢痕疙瘩成纤维细胞中DNMT1的表达对细胞生长的影响,并探讨其可能的分子机制,以期为瘢痕疙瘩的治疗提供线索和依据。
1 材料与方法
1.1标本来源收集潍坊市益都中心医院医学美容科手术切除的15例瘢痕疙瘩标本(男6例,女9例;年龄12~41岁);取材部位:面部3例,胸背部5例,腹部3例,四肢4例;病程3~20个月;手术所致5例,感染所致2例,外伤所致6例,穿耳孔所致2例;患者均无结缔组织病和合并皮肤疾病等,局部皮肤无溃疡和感染。另取10例需要植皮患者的正常皮肤样本作为正常对照。所有标本收集前患者均知情并同意,且经组织学检查(HE染色切片)证实。
1.2试剂与仪器DMEM培养基(美国Hyclone公司),转染试剂LipofectaminTM2000(美国Invitrogen公司),DNMT1 siRNA、阴性对照siRNA(美国Thermo公司)。DNMT1抗体、GAPDH抗体、辣根过氧化酶标记的二抗(美国Santa Cruz公司),BCA蛋白检测试剂盒、Annexin V-FITC/PI凋亡检测试剂盒(上海碧云天生物技术有限公司)。MTT试剂(美国Sigma公司),qRT-PCR试剂盒(美国Qiagen公司),Trizol试剂。PCR仪和凝胶成像系统(美国Bio-Rad公司),凝胶电泳仪(北京六一仪器厂)。
1.3细胞培养采用组织块贴壁法[4]获得瘢痕疙瘩成纤维细胞和正常皮肤细胞,用含有体积分数10%胎牛血清的DMEM培养基中于体积分数5%CO2、37 ℃条件下培养。收集生长状态良好的第5代对数生长期细胞进行实验。参考徐永飞等[5]的方法,在倒置显微镜下观察,以免疫细胞化学法检测细胞中CD73、CD90和CD105均为阳性且表达率较高时,即为所需细胞。当细胞纯度达98%以上,进行后续实验。
1.4正常皮肤细胞和疤痕疙瘩成纤维细胞中DNMT1mRNA和蛋白的表达
1.4.1 qRT-PCR 向正常皮肤细胞和瘢痕疙瘩成纤维细胞中加入Trizol试剂以提取总RNA,以反转录试剂盒将总RNA反转录合成cDNA,再以cDNA为模板进行PCR扩增。DNMT1上游引物序列5’-AGAACGGTGCTCATGCTTACA-3’,下游引物序列5’-CTCTACGGGCTTCACTTCTTG-3’;内参GAPDH上游引物序列5’-GAGCCAAAAGGGTCATCATCTC-3’,下游引物序列5’-AAAGGTGGAGGAGTGGGT GTC-3’。扩增条件:95 ℃ 10 s;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 60 s,共32个循环;72 ℃ 60 s。采用2-ΔΔCt法计算DNMT1 mRNA的相对表达量。
1.4.2 Western blot 向正常皮肤细胞和瘢痕疙瘩成纤维细胞中加入裂解液提取总蛋白,以BCA法对其定量。向总蛋白中加入等量的上样缓冲液后,于沸水浴中反应5 min。经SDS-PAGE电泳、电转仪转膜和封闭液(含50 g/L脱脂奶粉液)封闭后,加入DNMT1抗体(按1∶800稀释)和GAPDH抗体(按1∶1 000稀释)4 ℃孵育过夜。次日洗膜后,加入二抗常温孵育2 h。滴加化学发光剂显色,凝胶成像系统扫描分析。
1.5干扰DNMT1表达对疤痕疙瘩成纤维细胞增殖、凋亡及基因表达的影响
1.5.1 分组 取96孔细胞板,以每孔5×104个瘢痕疙瘩成纤维细胞进行接种,将细胞随机分为对照组、阴性对照siRNA转染组(siRNA NC组)和DNMT1 siRNA转染组(siRNA DNMT1组),每组设置3个复孔。次日,根据LipofectaminTM2000说明书将终浓度为40 nmol/L的阴性对照siRNA或DNMT1 siRNA转染至细胞中,转染后6 h更换为完全培养基继续培养48 h,收集细胞,参照1.4方法检测3组DNMT1 mRNA和蛋白的表达情况。
1.5.2 细胞增殖检测 取96孔细胞板,以每孔细胞悬液100 μL(细胞浓度2×105个/mL)进行种植,在体积分数5%CO2、37 ℃的细胞培养箱中培养,以1.5.1中的实验分组和转染方法处理细胞。分别在转染1、2和3 d后,加20 μL MTT溶液(5 g/L)。反应4 h后,加DMSO 150 μL,振荡,待结晶充分溶解后,以酶标仪检测490 nm波长处的吸光度值。
1.5.3 细胞凋亡检测 取96孔板,接种细胞悬液100 μL(浓度2×105个/mL),实验分组及处理同1.5.1。在转染48 h后,离心弃上清,并以磷酸盐缓冲液洗涤细胞。根据凋亡检测试剂盒使用说明书的操作步骤先加入结合缓冲液500 μL,再加入Annexin V-FITC和PI各5 μL进行双染色。于避光条件下充分反应后,上流式细胞仪检测。
1.5.4 细胞中PCNA、Bcl-2、Bax和TGF-β1 mRNA检测 收集3组细胞,加Trizol试剂提取总RNA后,反转录合成cDNA,再以cDNA为模板进行PCR扩增。PCNA上游引物序列5’-TCCCTTACG CAAGTCTCAGC-3’,下游引物序列5’-GTCCTT GAGTGCCTCCAACA-3’;Bcl-2上游引物序列5’-TGGGATGCCTTTGTGGAACTAT-3’,下游引物序列5’-GCTGATTTGACCATTTGCCTGA-3’;Bax上游引物序列5’-CCCCCGAGAGGTCATCGTCCG-3’,下游引物序列5’-GGGCCTTGAGCACCAGTTTG-C-3’;TGF-β1上游引物序列5’-CTAATGGTGGAAACCCA CAACG-3’,下游引物序列5’-TATCGCCAGGAATT GTTGCTG-3’。具体实验步骤参照1.4。
1.6统计学处理采用SPSS 20.0进行分析,应用两独立样本t检验比较瘢痕疙瘩成纤维细胞和正常皮肤细胞中DNMT1 mRNA和蛋白表达的差异,应用单因素方差分析比较3组瘢痕疙瘩成纤维细胞DNMT1 mRNA和蛋白、增殖、凋亡及PCNA、Bcl-2、Bax、TGF-β1 mRNA表达的差异,检验水准α=0.05。
2 结果
2.1DNMT1在瘢痕疙瘩成纤维细胞中的表达及DNMT1siRNA干扰的效果qRT-PCR检测结果(图1A)显示,瘢痕疙瘩成纤维细胞中DNMT1 mRNA相对表达水平高于正常皮肤细胞[(5.26±0.58)vs(1.01±0.12),t=12.429,P<0.001],DNMT1蛋白表达水平亦高于正常皮肤细胞[(0.86±0.07)vs(0.25±0.02),t=14.513,P<0.001]。转染48 h后,siRNA DNMT1组瘢痕疙瘩成纤维细胞中DNMT1 mRNA和蛋白的表达低于对照组和siRNA NC组,见图1B和表1。

A:DNMT1在瘢痕疙瘩成纤维细胞中的表达;B:DNMT1 siRNA的干扰效果

图1 qRT-PCT电泳和Western blot检测结果
*:与对照组和siRNA NC组相比,P<0.05
2.2 3组瘢痕疙瘩成纤维细胞增殖能力的比较见表2。
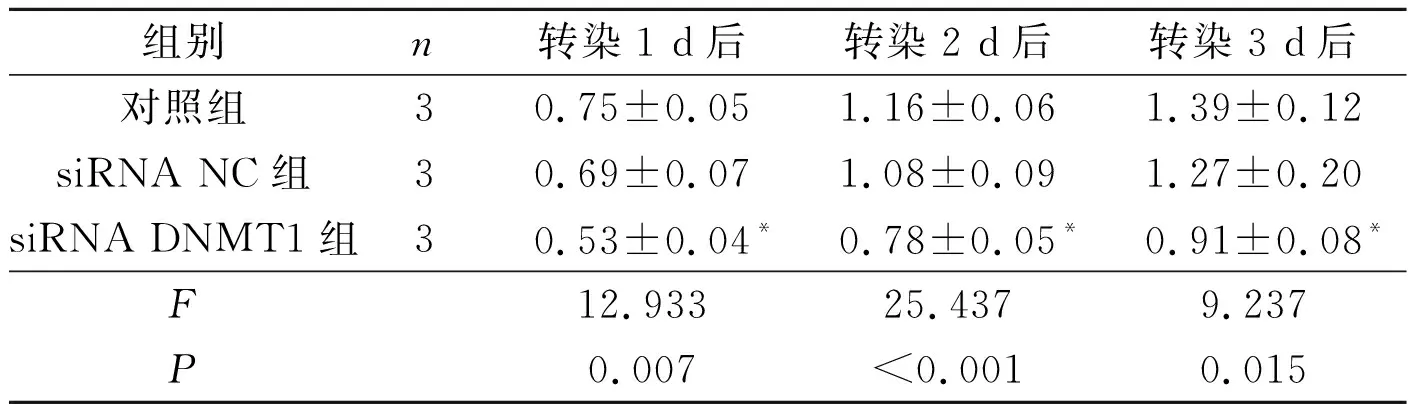
表2 3组瘢痕疙瘩成纤维细胞的吸光度值
*:与对照组和siRNA NC组相比,P<0.05
2.3 3组瘢痕疙瘩成纤维细胞凋亡率的比较siRNA DNMT1组细胞凋亡率(23.22±2.75)%较对照组(9.25±0.82)%和 siRNA NC组(10.18±1.06)%升高(F=58.674,P<0.001)。
2.4 3组瘢痕疙瘩成纤维细胞中PCNA、Bcl-2、Bax和TGF-β1mRNA表达的比较见表3。siRNA DNMT1组细胞中PCNA、Bcl-2和TGF-β1 mRNA的表达水平低于其他2组,而Bax mRNA表达水平高于其他2组(P<0.05)。
表3 3组瘢痕疙瘩成纤维细胞中PCNA、
Bcl-2、Bax、TGF-β1mRNA的相对表达量(n=3)

组别PCNA mRNABcl-2 mRNABax mRNATGF-β1 mRNA对照组1.00±0.090.96±0.051.02±0.061.01±0.08siRNA NC组0.93±0.060.89±0.080.98±0.050.95±0.07siRNA DNMT1组0.71±0.06*0.55±0.03*1.42±0.05*0.67±0.05*F13.47144.17461.95421.478P<0.001<0.001<0.001<0.001
*:与对照组和siRNA NC组相比,P<0.05
3 讨论
DNA甲基化贯穿了机体胚胎发育、衰老和肿瘤发生等生理、病理过程,其介导的表观遗传修饰在调控基因表达方面具有重要作用,与多种疾病的发生关系密切。DNA甲基化受DNMTs的调控,DNMT1是DNMTs家族研究较多的一个成员。赵淑磊等[6]指出,DNMT1在食管鳞状细胞癌组织中的表达水平高于癌旁正常组织,沉默其表达后,可抑制KYSE30细胞的增殖,并促进细胞凋亡。DNMT1除了参与肿瘤细胞的增殖、凋亡过程外,还在纤维化疾病的发生发展中扮演着重要角色。Bian等[7]发现,DNMT1可通过调控TGF-β1改善Smad7的表达,进而参与大鼠肝星状细胞活化与肝纤维化过程。缪成贵等[8]研究指出,在类风湿性关节炎大鼠滑膜成纤维样滑膜细胞(FLS)中DNMT1表达显著升高,抑制其表达后,FLS细胞增殖能力减弱,抗凋亡基因Bcl-2表达下降,引发FLS细胞凋亡增强。瘢痕疙瘩是一种体表纤维化性疾病,在创伤后伤口愈合的修复过程中,成纤维细胞的过度增生是导致瘢痕疙瘩形成的重要原因之一。Yang等[9]指出,DNMT1与瘢痕疙瘩浸润生长密切相关。因此,推测DNMT1在成纤维细胞生长过程中可能发挥着重要作用,研究DNMT1在成纤维细胞增殖、凋亡中的作用对认识和治疗瘢痕疙瘩具有重要意义。
本研究从瘢痕疙瘩标本中分离、培养得到瘢痕疙瘩成纤维细胞,以qRT-PCR检测确认DNMT1在细胞中高表达。然后用DNMT1 siRNA干扰瘢痕疙瘩成纤维细胞中DNMT1表达,结果显示,下调DNMT1表达后,瘢痕疙瘩成纤维细胞的增殖能力减弱,而凋亡能力增强,这一结果也进一步印证了甲基化酶抑制剂5-氮杂-2-脱氧胞苷抑制人瘢痕疙瘩成纤维细胞生长的结论[10];提示,在瘢痕疙瘩的发生发展中,DNMT1可能扮演着促进成纤维细胞增殖和抑制细胞凋亡的作用。PCNA是细胞增殖中广泛存在的核抗原,在DNA的复制和修复、染色体的组装以及细胞周期中具有重要的调控作用,与瘢痕疙瘩的浸润性生长关系密切[11-12]。Bcl-2是抑凋亡基因,Bax是促凋亡基因,两者在瘢痕疙瘩成纤维细胞凋亡过程中发挥着重要的调控作用[11]。TGF-β1是TGF-β家族中最活跃的一员,不仅在成纤维细胞分裂增殖中发挥着促进作用,还可促进成纤维细胞中胶原的合成,使细胞外基质大量沉积,促进瘢痕疙瘩的发生[13-14]。本研究通过qRT-PCR检测转染DNMT1 siRNA后瘢痕疙瘩成纤维细胞中PCNA、Bcl-2、Bax和TGF-β1 mRNA的表达。结果显示,siRNA DNMT1组细胞中PCNA、Bcl-2和TGF-β1 mRNA表达水平均明显下降,而Bax mRNA表达水平明显升高。提示,DNMT1可能通过上调PCNA、Bcl-2、TGF-β1和下调Bax基因表达促进了瘢痕疙瘩成纤维细胞生长。
综上所述,DNMT1在瘢痕疙瘩成纤维细胞中高表达,干扰其表达能够明显抑制细胞的增殖,促进细胞凋亡,其作用机制可能与上调Bax和下调PCNA、Bcl-2、TGF-β1表达有关。该实验结果为以DNMT1为靶点的瘢痕疙瘩靶向治疗提供了理论依据。