shRNA介导的波形蛋白基因沉默对肝癌细胞迁移、侵袭能力的影响
柳 严,张德林,王国良,赵鹏伟,黄建钊
贵州省人民医院肝胆外科 贵阳 550002
原发性肝癌是一种常见的起源于肝脏上皮或间叶组织的消化道恶性肿瘤,具有发病隐匿、进展快和早期诊断困难等特点,其发病率和病死率一直居高不下,且有升高的趋势,严重威胁着人类的生命安全[1-2]。其中,浸润转移是导致肝癌患者死亡加速和手术治疗成功率低的重要原因。因此,寻找能够阻断肝癌细胞浸润和转移的有效分子靶点,一直是肝癌领域研究的热点问题。波形蛋白(Vimentin)是一种中间丝蛋白,广泛表达于正常的间质细胞,与上皮间质转化关系密切。研究[3-6]发现,Vimentin在宫颈癌、口腔癌和乳腺癌等多种肿瘤中异常高表达,与肿瘤的转移密切相关;干扰或沉默Vimentin表达,可抑制肿瘤的转移。近年来,有研究[7]指出Vimentin在肝癌组织中高表达,与肿瘤的病理分级和远处转移等有关,但其具体的作用机制不详。本研究构建了靶向Vimentin基因的慢病毒LV-Vimentin-GFP-shRNA,感染肝癌Huh7细胞,建立Vimentin基因稳定沉默的Huh7细胞,观察沉默Vimentin表达对Huh7细胞迁移和侵袭能力的影响,并探讨其可能的分子机制,以期为肝癌的治疗提供新的靶点。
1 材料与方法
1.1材料、试剂和仪器肝癌Huh7细胞购于中国科学院上海细胞库。pLVTHM载体购于上海吉凯公司。Trizol试剂购于美国Invitrogen公司,胎牛血清购于美国Sigma公司,RPMI 1640培养基和胰蛋白酶购于美国Gibco公司。BCA蛋白浓度测定试剂盒购于北京索莱宝科技公司,反转录试剂盒购于日本TaKaRa公司,β-actin抗体、MMP-9抗体和受体酪氨酸激酶(AXL)抗体购于美国Santa Cruz公司,辣根过氧化物酶标记的二抗购于美国Zymed公司。PVDF膜购于美国Millpore公司,Matrigel胶购于美国BD公司,凝胶成像系统购于美国Bio-Rad公司,紫外分光光度仪和CO2培养箱购于法国Jouan公司,电泳仪购于北京六一仪器厂。
1.2细胞培养、分组和慢病毒感染将Huh7细胞和293T细胞解冻复苏后,以含有体积分数10%胎牛血清的RPMI 1640培养基于95%饱和湿度、体积分数5%CO2和37 ℃的无菌培养箱中常规培养。每3 d以2.5 g/L胰蛋白酶消化传代,收集生长良好的第5代细胞进行实验。Vimentin特异性干扰序列5’-GGATGTTGACAATGCGTCT-3’由上海生工生物工程技术服务有限公司合成,将目的片段插入pLVTHM载体的MluⅠ和ClaⅠ位点,H1启动子和EF1-α启动子分别调控siRNA和GFP表达,构建阴性对照质粒LV-NC-GFP-shRNA和干扰质粒LV-Vimentin-GFP-shRNA,并经阳性克隆筛选和鉴定。取对数生长期的293T细胞,调整细胞密度,将2×105个细胞接种于培养瓶中。严格参照慢病毒包装使用说明书包装293T细胞,以MOI=5时的感染效率最高,慢病毒滴度达到3×106TU/mL。感染前,将对数生长期的Huh7细胞以每孔3×104个细胞接种至6孔板上,于培养箱内常规培养。待Huh7细胞达到50%左右融合时,将细胞分为对照组(未感染细胞)、阴性对照组(以LV-NC-GFP-shRNA感染细胞)和实验组(以LV-Vimentin-GFP-shRNA质粒感染细胞),给予相应处理。感染时,加入8 mg/L凝胶胺(按照MOI=5)强化感染效果,感染72 h后,显微镜下观察荧光。感染效率=绿色荧光细胞/视野内细胞数×100%。以4 mg/L耐嘌呤霉素进行药物筛选,15 d后观察细胞克隆,挑选单克隆集落,扩大细胞培养,获得稳定细胞。
1.3 3组细胞中VimentinmRNA检测收集对照组、阴性对照组和实验组细胞,参照Trizol试剂说明提取总RNA,并以分光光度计对其浓度和纯度进行定量。采用反转录试剂盒合成cDNA,再以cDNA为模板,上PCR仪进行扩增。Vimentin上游引物5’-AGAGAACTTTGCCGTTGAAGC-3’,下游引物5’-ACGAAGGTGACGAGCCATT-3’;内参β-actin上游引物5’-TGGCACCCAGCACAATGAA-3’,下游引物5’-CTAAGTCATAGTCCGCCTAGAAGCA-3’。反应条件:预变性95 ℃2 min;变性95 ℃15 s,退火延伸60 ℃30 s,40个循环。采用2-ΔΔCt法计算Vimentin mRNA的相对表达量。实验重复3次。
1.4 3组细胞迁移和侵袭能力检测细胞迁移实验:将收集到的对照组、阴性对照组和实验组细胞饥饿处理1 d,以胰蛋白酶消化,制备细胞悬液,按2×105个/mL接种200 μL于Transwell小室的上室中。同时,于下室中加入含有胎牛血清的培养基500 μL,放入细胞培养箱中常规培养,48 h后取膜,擦去上室中没有迁移的细胞,先后加入甲醛(40 g/L)和结晶紫(5 g/L)进行固定(10 min)和染色(30 min)。洗涤晾干后,以光学显微镜观察穿膜细胞数。每次观察时选取5个视野,每组观察3次。细胞侵袭实验:首先用人工基底膜胶对Transwell小室的多聚碳酸酯膜进行包被,其余步骤与细胞迁移实验相同。实验重复3次。
1.5 3组细胞中Vimentin、MMP-9和AXL蛋白检测采用Western blot方法。收集对照组、阴性对照组和实验组细胞,离心后,加入细胞裂解液提取总蛋白,并采用BCA法对所提总蛋白进行定量。取蛋白样品60 μg上样至100 g/L SDS-PAGE凝胶中,以80 V电压电泳分离2 h后,再以250 mA电流转PVDF膜90 min。接着,浸入到含脱脂奶粉(50 g/L)的封闭液中反应2 h。经TBST漂洗后,加入1∶800稀释的Vimentin抗体或1∶1 000稀释的MMP-9抗体、AXL抗体、β-actin抗体,于4 ℃条件下孵育过夜。再经TBST漂洗后,加入1∶5 000稀释的二抗,常温下孵育1.5 h。加化学发光剂暗室中显影曝光,以凝胶成像系统和Image J软件对目的蛋白进行分析,目的蛋白的相对表达水平=目的蛋白条带的灰度值/内参β-actin条带的灰度值。实验重复3次。
1.6统计学处理采用SPSS 20.0进行统计学分析。3组间Vimentin mRNA和Vimentin、MMP-9、AXL蛋白表达水平,迁移细胞数和侵袭细胞数的比较均采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1慢病毒对Huh7细胞的感染效率LV-Vimentin-GFP-shRNA对Huh细胞的感染效率为(82.65±2.25)%,LV-NC-GFP-shRNA为(79.45±1.36)%。
2.2 3组Huh7细胞中Vimentin的表达结果显示,实验组细胞中Vimentin mRNA、蛋白的表达水平
较2个对照组下降,而阴性对照组与对照组相比差异无统计学意义。见图1和表1。

图1 各组Huh7细胞中Vimentin蛋白的表达
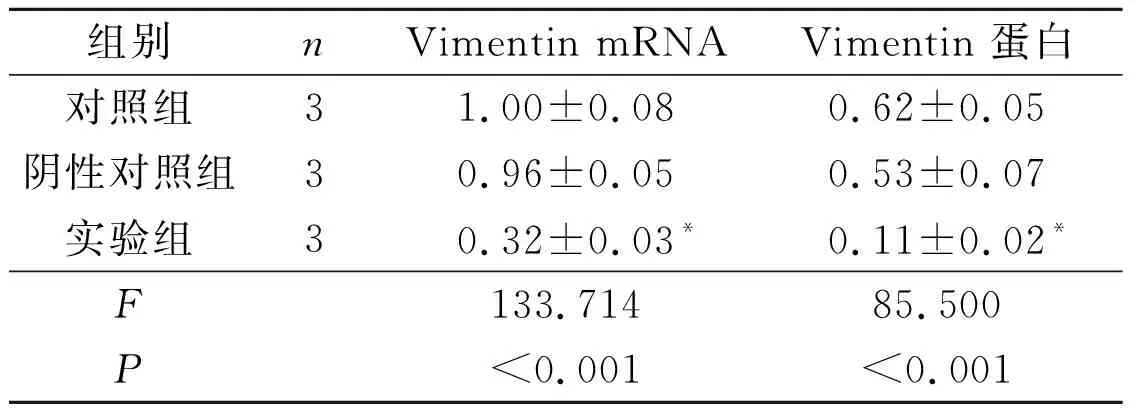
组别nVimentin mRNAVimentin 蛋白对照组31.00±0.080.62±0.05阴性对照组30.96±0.050.53±0.07实验组30.32±0.03*0.11±0.02*F133.71485.500P<0.001<0.001
*:与其他2组相比,P<0.05
2.3 3组Huh7细胞的迁移和侵袭能力比较对照组与阴性对照组迁移和侵袭细胞数比较,差异均无统计学意义;而实验组迁移和侵袭细胞数较2个对照组明显减少。见表2。
表2各组Huh7细胞迁移和侵袭细胞数比较
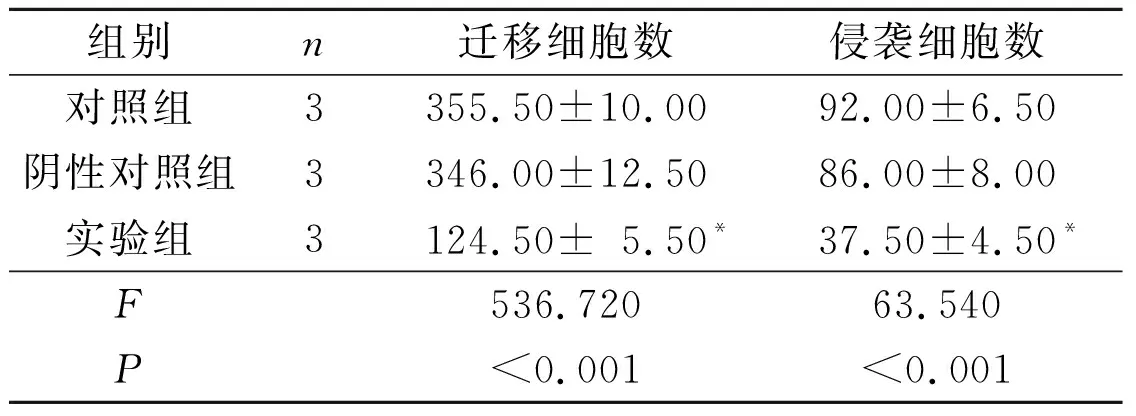
组别n迁移细胞数侵袭细胞数对照组3355.50±10.0092.00±6.50阴性对照组3346.00±12.5086.00±8.00实验组3124.50±5.50*37.50±4.50*F536.72063.540P<0.001<0.001
*:与其他2组相比,P<0.05
2.4 3组Huh7细胞中MMP-9和AXL蛋白的表达阴性对照组中两种蛋白的表达水平与对照组相比差异无统计学意义,但实验组中两种蛋白的表达水平较2个对照组均明显降低。见图2和表3。
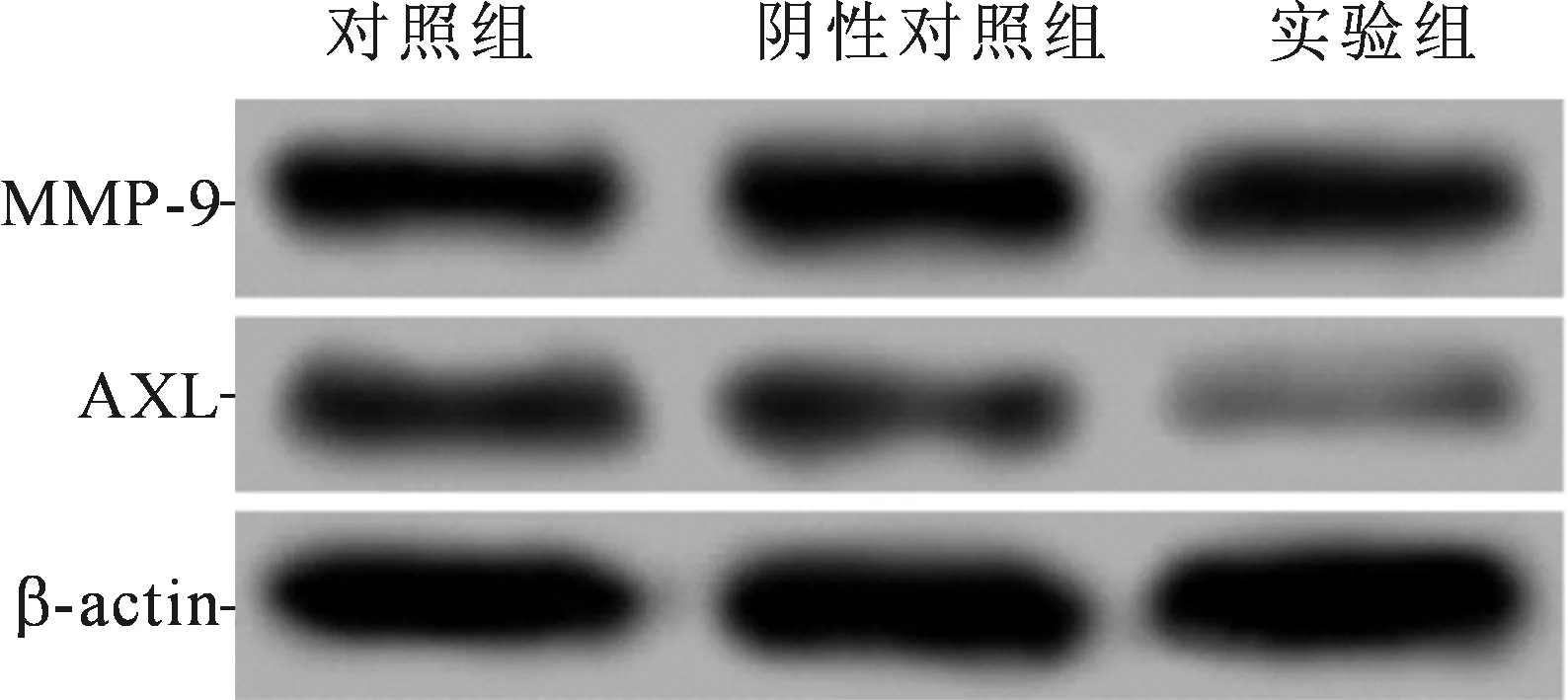
图2 各组Huh7细胞中MMP-9和AXL蛋白的表达
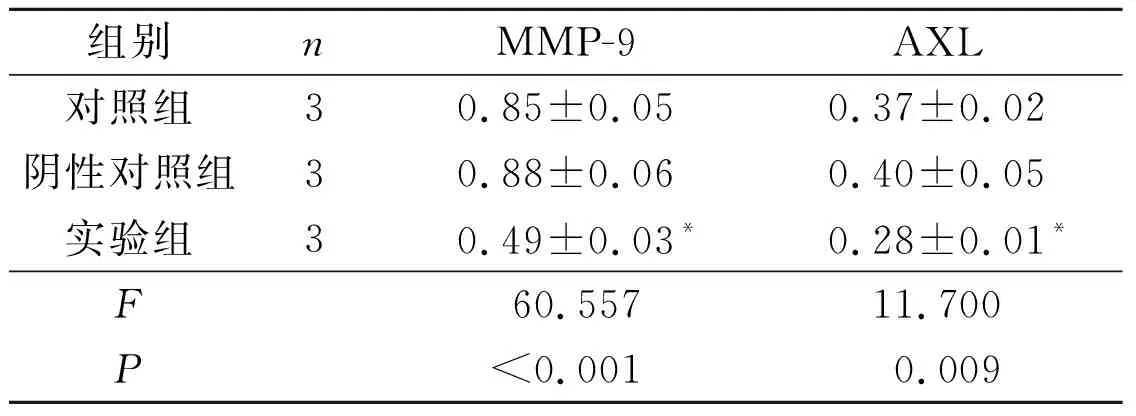
组别nMMP-9AXL对照组30.85±0.050.37±0.02阴性对照组30.88±0.060.40±0.05实验组30.49±0.03*0.28±0.01*F60.557 11.700P<0.001 0.009
*:与其他2组相比,P<0.05
3 讨论
中间丝是与细胞运动密切相关的细胞骨架的重要成分,而Vimentin作为中间丝蛋白也逐渐引起学术界的关注。随着研究的深入,Vimentin被认为与多种肿瘤的发生发展关系密切,特别是在肿瘤细胞的上皮间质转化过程中扮演着重要角色[8]。Ye等[9]和Tadokoro等[10]研究指出,Vimentin在非小细胞肺癌高表达,与肿瘤分期、淋巴结转移和预后不良等关系密切,且Vimentin沉默能够降低癌细胞的侵袭能力。Wang等[11]也发现,Vimentin在鼻咽癌中高表达,体外沉默鼻咽癌CNE2细胞中Vimentin表达可抑制癌细胞的迁移和侵袭。近年来,国内研究[7]发现,Vimentin在肝癌组织中也呈现高表达,并与肿瘤的病理分级和远处转移等有关,提示其可能在肝癌的侵袭和转移过程中发挥重要作用。为了明确Vimentin在肝癌细胞迁移和侵袭中的作用,作者构建了靶向Vimentin基因的慢病毒LV-Vimentin-GFP-shRNA,以其感染肝癌Huh7细胞,感染效率达到(82.65±2.25)%,表明成功建立了Vimentin基因稳定沉默的Huh7细胞,该细胞迁移和侵袭能力均明显下降,表明沉默Vimentin基因可抑制肝癌Huh7细胞的迁移和侵袭。这一实验结果与卓少元等[12]发现健脾益气方含药血清可通过下调肝癌细胞中Vimentin表达抑制肝癌细胞侵袭的结论相吻合。
MMP-9是MMP家族的重要一员,也是一种Ⅳ型胶原酶,可通过调控层粘连蛋白、纤维粘连蛋白和细胞因子等多种底物,发挥降解和重塑细胞外基质动态平衡的作用,与包括肝癌在内的多种肿瘤的侵袭和转移过程关系密切[13]。AXL是一种存在于细胞表面的跨膜蛋白,属于受体型酪氨酸激酶亚家族,可通过与配体结合而被激活,从而对下游基因或信号通路发挥调控作用,参与肝癌细胞转移[14]。卢冠军等[15]研究指出,Vimentin上调可通过增强MMP-9的表达促进膀胱癌SW780细胞的侵袭。Vuoriluoto等[16]发现,Vimentin表达有助于乳腺癌的上皮-间质转化,在乳腺上皮细胞中沉默Vimentin表达可通过下调AXL影响细胞的侵袭能力。本研究采用Western blot法进一步检测发现,Vimentin基因沉默可明显减弱Huh7细胞中MMP-9和AXL蛋白的表达。提示,在肝癌Huh7细胞中,沉默Vimentin基因可通过下调MMP-9和AXL的表达抑制细胞的迁移和侵袭。
综上所述,Vimentin基因与肝癌的发展密切相关,沉默其表达可能通过下调MMP-9和AXL表达抑制肝癌Huh7细胞的迁移和侵袭。本研究进一步丰富了肝癌发生转移的分子机制,也为肝癌的治疗提供了新的靶点和线索[17-18]。