猪主动脉瓣膜中NADPH氧化酶2和4的表达
潘亚婷,刘慧兵,王立波,王 蕾,冷小敏,吕 诚,王学惠,赵国安,张 敏
新乡医学院第一附属医院心内科;新乡医学院心血管病诊疗中心 河南卫辉 453100
钙化性主动脉瓣膜病(calcific aortic valve disease,CAVD)是仅次于高血压和冠心病的第三大心血管疾病,严重威胁人类健康[1]。主动脉瓣膜主要由瓣膜间质细胞(valvular interstitial cell, VIC)组成,表面覆盖单层的内皮细胞(endothelial cell, EC)[2]。CAVD是一个主动的、多细胞参与并受复杂调控的成骨样分化过程。近来有证据[3]表明活性氧(reactive oxygen species, ROS)所介导的氧化还原信号在CAVD中起重要作用。NADPH氧化酶(NADPH oxidases,Nox)是一特殊的产生ROS的酶类家族,它们通过催化电子从NADPH转移到分子氧而产生超氧阴离子和 H2O2。目前已鉴定出7种亚型(Nox1~5、Duox1~2)。研究[4-5]表明,Nox在几乎所有的组织细胞中表达,其中心脏和血管主要表达Nox2和Nox4,但二者在多种心血管疾病如心肌肥大和动脉粥样硬化等中的作用呈现组织细胞特异性。有关Nox在CAVD中的作用目前尚不清楚,甚至缺乏关于Nox在正常主动脉瓣膜组织表达的基本了解。由于猪的心脏及瓣膜结构类似于人类,本研究观察了Nox2和Nox4在正常猪主动脉瓣膜不同部位(尖、中和根部)的表达水平,并进一步明确了它们在VIC和EC中的表达情况,现将结果报道如下。
1 材料与方法
1.1猪主动脉瓣膜组织的获取与处理健康成年家猪6只(1~2岁,雄性,体重100~150 kg,由新乡市肉联屠宰场提供),处死后立即取出完整的主动脉瓣膜,用无菌冷PBS冲洗后仔细剪下3片主动脉瓣叶并保存于冷PBS中。每片瓣叶分别切取3段(根部、中部和尖部),标记后立即放入液氮中保存以备后用。猪主动脉瓣膜尖部和根部Nox2、Nox4 mRNA表达的检测选取家猪6只;猪主动脉瓣膜尖部、中部和根部Nox2、Nox4蛋白表达的检测,VIC和EC中Nox2、Nox4 mRNA及蛋白表达的检测选取家猪3只。
1.2EC和VIC的分离、培养及表型鉴定采用胶原酶消化法原代分离、培养EC和VIC[6]。瓣膜剪下后用无菌PBS洗3次,加入6 mL胶原酶消化液(2 g/L)37 ℃孵育8 min,然后用无菌棉签刮下EC(动作轻柔,以免刮下VIC),把胰蛋白酶消化液转移至一15 mL无菌离心管中,然后在消化过的瓣膜中加入冷PBS,轻轻摇动,把PBS也转移至15 mL离心管中,500g离心3 min,弃去上清,用冷PBS洗1次,相同条件离心后加入2 mL EC培养基(Sciencell公司)重悬后移入培养瓶,再加入6 mL新鲜培养基,置于培养箱中培养。已除去内皮层的瓣膜剪碎后在胶原酶中孵育过夜,次日吹打离心,弃去上清,加入DMEM重悬混匀,种植于培养瓶内。瓣膜细胞用含体积分数10%FBS、青霉素/链霉素的高糖DMEM在37 ℃、体积分数5%的CO2细胞培养箱内培养,待细胞生长至约80%融合时开始传代。取鉴定阳性的2~5代细胞用于实验。
原代培养的EC和VIC用40 g/L多聚甲醛室温固定15 min,PBS洗3遍,体积分数0.1% Triton-X 100处理10 min,体积分数5%山羊血清室温封闭1 h后,1∶100一抗(鼠抗人Vimentin或CD31抗体,分别购于北京博奥森生物技术有限公司和BD Biosciences公司)4 ℃孵育过夜。用PBS漂洗后,1∶150二抗(荧光染料Alexa Flour 488标记的羊抗兔和Alexa Flour 568标记的羊抗鼠IgG抗体,购于北京中杉金桥生物技术有限公司)室温避光孵育1 h,PBS漂洗,1∶1 000 DRAQ5复染细胞核15 min,用荧光显微镜观察并拍照。
1.3猪主动脉瓣膜及VIC和EC中Nox2、Nox4mRNA的qRT-PCR检测猪主动脉瓣膜剪碎研磨后,加入Trizol提取总RNA。VIC和EC细胞用PBS洗3遍后直接加入Trizol。分光光度计检测 RNA 浓度及纯度。42 ℃2 min;37 ℃15 min,85 ℃5 s,进行反转录。引物序列:Nox2上游5’-GTG CACCATGATGAGGAGAA-3’,下游5’-AGTTAGGCCGTCCGTACAAG-3’; Nox4上游5’-GGAACGCACTACCAGGATGT-3’, 下游5’-CAGGTCTGCGGAAAGT TAGC-3’; β-actin上游5’-CCCAAAGCCAACCGT GAG-3’,下游5’-GCCAGAGGCGTACAGGGAC-3’。反应条件:95 ℃变性30 s;95 ℃5 s,60 ℃34 s,40个循环。以β-actin作为内参,采用2-ΔΔCt法计算 Nox2和Nox4 mRNA的相对表达量。
1.4猪主动脉瓣膜及VIC和EC中Nox2、Nox4蛋白的Westernblot检测分别取猪主动脉瓣膜尖、中、根部,剪碎研磨后加入裂解液提取总蛋白。VIC和EC细胞则直接加入裂解液提取总蛋白。用BCA法进行蛋白定量,SDS-PAGE电泳后转至PVDF膜。加入一抗Nox2抗体或Nox4抗体(1∶1 000稀释)孵育过夜;第2天洗膜后再用HRP标记二抗(1∶2 000稀释)杂交,室温孵育2 h,洗膜后ECL曝光显影,利用Image J进行灰度分析,以GAPDH(Protein Tech公司)作为内参。
1.5统计学处理采用SPSS 21.0进行数据分析。猪主动脉VIC和EC中Nox2、Nox4 mRNA及蛋白相对表达量的比较采用两独立样本的t检验;猪主动脉瓣膜尖、中、根部Nox2、Nox4蛋白相对表达量的比较,尖部、根部Nox2、Nox4 mRNA相对表达量的比较均采用重复测量数据的方差分析。检验水准α=0.05。
2 结果
2.1Nox2和Nox4在猪主动脉瓣膜的表达结果见图1和表1、2。qRT-PCR检测结果显示,Nox2和Nox4 mRNA在瓣膜根部的表达水平高于在尖部的表达。Western blot结果证实,Nox2蛋白在主动脉瓣膜根部表达最高,高于尖部和中部;Nox4蛋白在主动脉瓣膜根部的表达也高于尖部和中部;但Nox2和Nox4蛋白在瓣膜尖部和中部的表达水平比较,差异无统计学意义。
2.2猪主动脉EC和VIC的鉴定结果见图2。EC紧密排列似鹅卵石或铺路石样分布,未见明显重叠样生长;EC特异性标识物CD31免疫荧光染色阳性。VIC形态为梭形或纺锤形,排列呈放射状或漩涡状,并可互相重叠生长;VIC特异性标识物Vimentin免疫荧光染色阳性。
2.3Nox2和Nox4在猪主动脉EC和VIC中的表达结果见图3、4和表3、4。EC中Nox4 mRNA和蛋白表达水平均高于VIC,VIC中Nox2蛋白表达水平高于EC,Nox2 mRNA表达水平在两种细胞中没有差别。另外,主动脉瓣膜免疫荧光染色显示,Nox4在瓣膜表面单层EC中高表达,相反,Nox2在VIC中高表达。
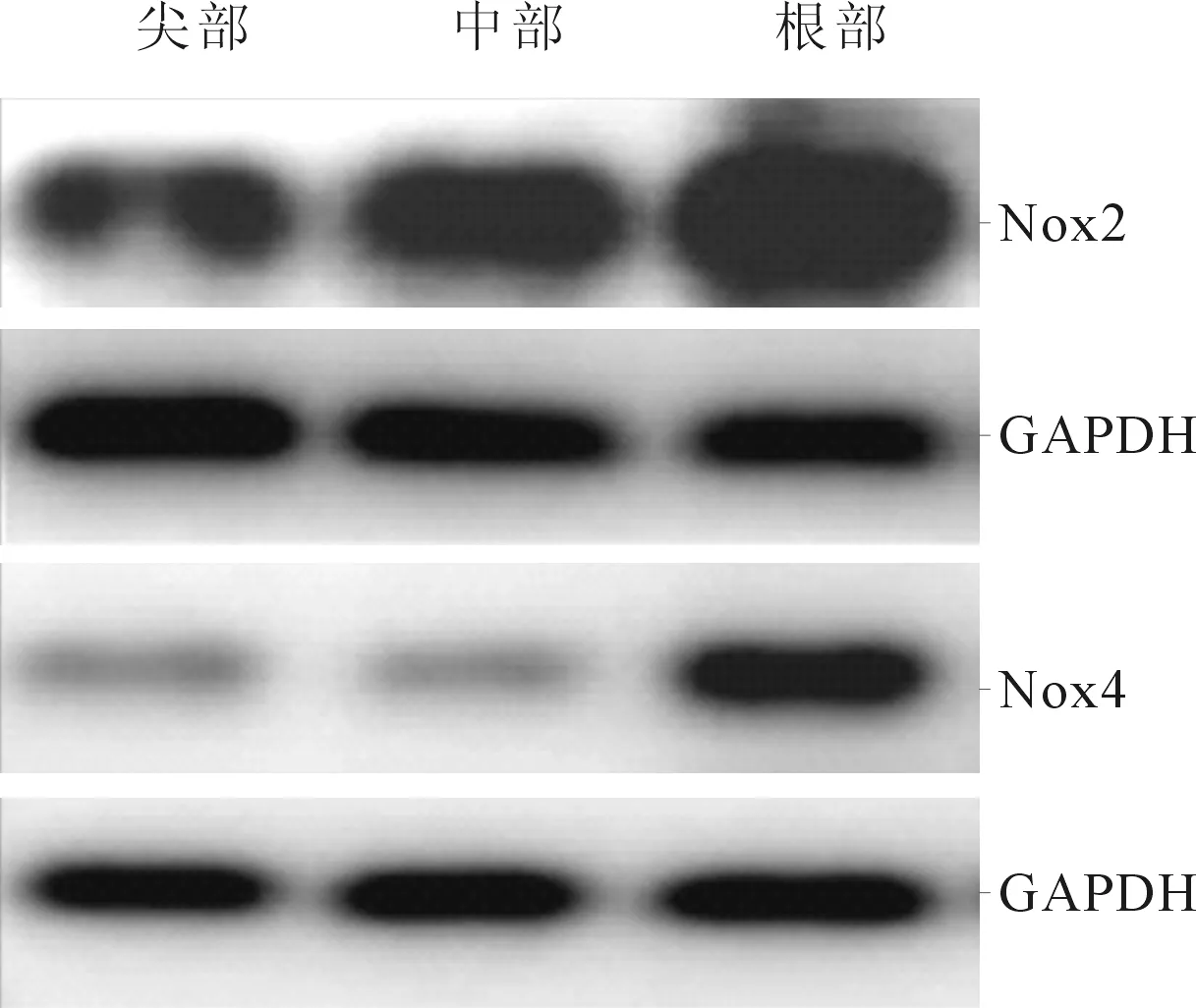
图1 猪主动脉瓣膜尖、中、根部Nox2和Nox4蛋白的表达
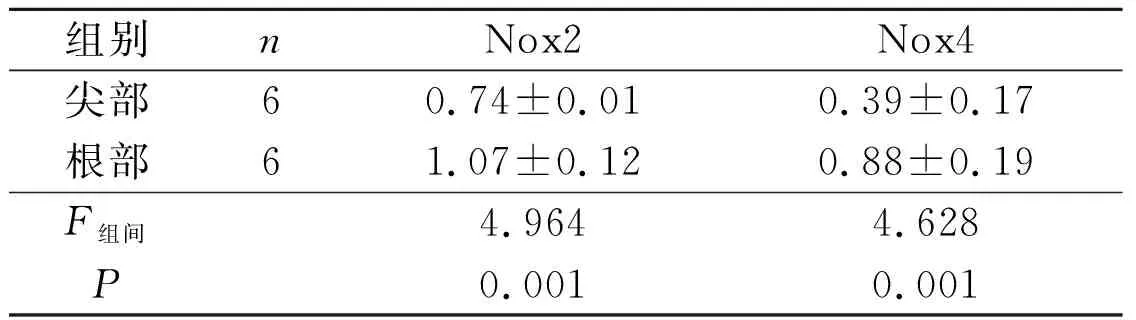
组别nNox2Nox4尖部60.74±0.010.39±0.17根部61.07±0.120.88±0.19F组间4.9644.628P0.0010.001

表2 猪主动脉瓣膜尖、中和根部Nox2、Nox4蛋白相对表达量的比较
*:与尖部相比,P<0.05;#:与中部相比,P<0.05
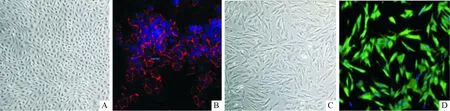
A:EC;B:EC CD31免疫荧光染色;C:VIC;D:VIC Vimentin免疫荧光染色

A:主动脉瓣膜表层EC CD31染色阳性;B:Nox4在主动脉瓣膜表层EC的表达(箭头所示);C:Nox2在主动脉VIC的表达(箭头所示)
图3EC和VIC中Nox2、Nox4的表达(×200)
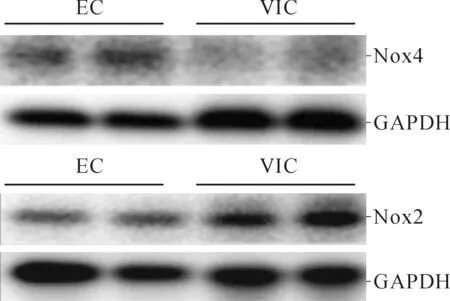
图4 EC和VIC中Nox2、Nox4蛋白的表达
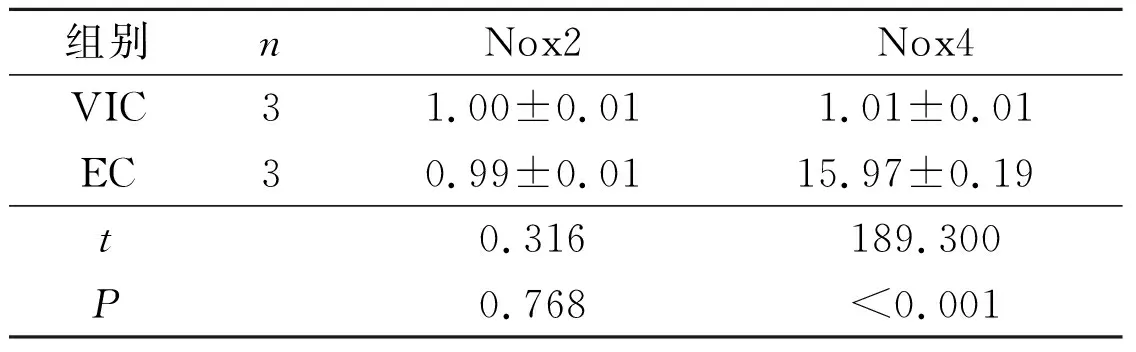
组别nNox2Nox4VIC31.00±0.011.01±0.01EC 30.99±0.0115.97±0.19t0.316189.300P0.768<0.001
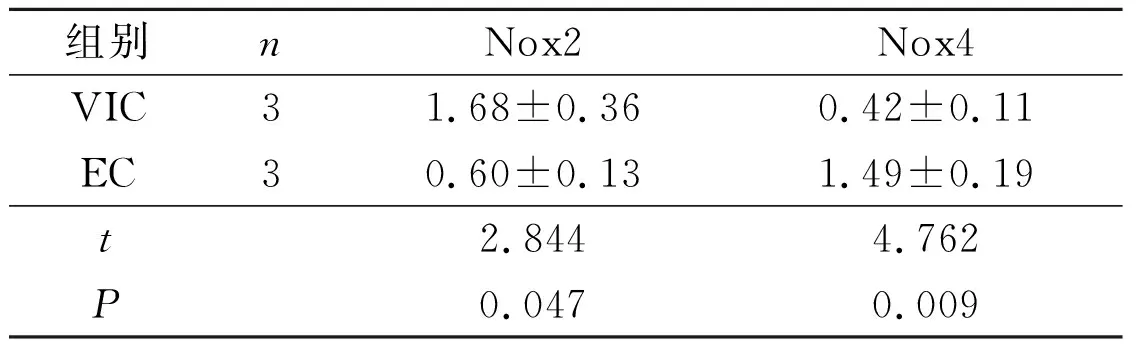
表4 VIC和EC中Nox2、Nox4蛋白相对表达量的比较
3 讨论
随着人口的老龄化,退行性瓣膜疾病特别是CAVD成为日益严重的问题,然而临床缺乏有效的药物防治,因此开展CAVD发病机制研究十分必要。由于猪的心脏及瓣膜结构类似于人类,且标本来源丰富以及瓣膜体积较大,因此原代分离和培养的猪主动脉瓣膜细胞是研究CAVD最常用的材料之一[2]。
ROS和氧化应激损伤在多种疾病中扮演关键角色。ROS的病理生理学意义不仅取决于其浓度,而且与其来源、类型、细胞分布及特定氧化还原信号传导密切相关[7]。与其他ROS来源如线粒体和黄嘌呤氧化酶相比,Nox是细胞内惟一把精确并可控调节低水平ROS作为其主要功能的酶类,因此尤其适合氧化还原信号传导并参与许多细胞功能包括生长、分化、迁移、增殖和死亡[8]。Nox2和Nox4是人和动物心脏中的主要亚型, Nox2主要受转录后调节,参与调控正常和疾病状态下心脏收缩功能[9],在由血管紧张素、高血压或心肌梗死等导致的心肌肥大和心力衰竭中起有害作用[4, 10-11]。相反,Nox4的活性主要由其蛋白表达水平决定,可以通过增加心肌毛细血管的储备、激活核因子Nrf2、缓解内质网应激以及诱导心肌局部巨噬细胞极化等机制在多种疾病(包括高血压性心肌肥大和心肌梗死后心力衰竭等)导致的病理性心肌重构过程中起保护作用[5, 12-16]。但Nox在主动脉瓣膜中的生理和病理意义尚不清楚。
本研究证实,正常猪主动脉瓣膜EC和VIC虽然都表达Nox2和Nox4,但Nox4在EC中的水平明显高于VIC,相反Nox2蛋白在VIC中的水平显著高于EC,提示这两种亚型在EC和VIC中起重要但不同的作用。Nox2 mRNA表达水平在两种细胞中没有明显差别,这可能与基因表达的转录后调控和修饰不同有关。有资料[17]表明,Nox/ROS在不同细胞间交互应答对病变发展有重要作用。临床病理显示,主动脉瓣膜疾病的发生多起始于主动脉瓣膜根部,这可能与主动脉瓣膜不同部位的活动强度和血流剪切力不同有关。有意义的是,作者发现Nox2和Nox4在主动脉瓣膜根部的表达均明显高于尖部和中部,这种高表达与根部易损之间的相关性提示Nox及其介导的氧化还原信号在瓣膜疾病发生发展中可能具有重要意义,但其具体作用及机制还需要今后进一步深入研究。