重组产气荚膜梭菌plc基因植物乳酸杆菌的免疫效果评价
张 艳,周庆民,冯万宇,徐 馨,黄 健,王 新,李兰兰,王莹莹,郑晓星,宁秀云,李广兴
(1. 黑龙江省兽医科学研究所,黑龙江 齐齐哈尔 161006;2. 东北农业大学动物医学学院,黑龙江 哈尔滨 150030 ;3.黑龙江省讷河市动物防疫站,黑龙江 讷河 161300))
产气荚膜梭菌(C.perfringens)又是一种革兰阳性厌氧芽孢杆菌,是人和动物肠道的常在菌,健康状态下不发病,当胃肠道条件失衡时细菌大量繁殖致病。人们普遍认为其α毒素是引起家禽坏死性肠炎的主要致病因子[1-3]。α毒素是由370个氨基酸构成的单链多肽,分子量约43 kDa,包含2个结构功能区,具有磷脂酶C活性的氨基端和具有鞘磷脂酶活性羧基端[4-5]。α毒素依靠这两种酶活性,水解组成细胞膜的主要成分膜磷脂,从而破坏细胞膜结构的完整性,导致细胞裂解[6]。
随着养禽业中禁止使用抗生素,坏死性肠炎给国内外养禽业带来了重大的经济损失,所以本病的预防变得尤为重要。但行之有效的疫苗还没有开发出来,所以我们利用植物乳杆菌(L.plantarum)作为呈递α毒素plc片段的载体,制备口服重组活菌疫苗为坏死性肠炎疫苗的开发提供理论基础。
1 材料与方法
1.1 菌株、实验动物与主要试剂 产气荚膜梭菌ATCC13124株,购自上海天呈科技有限公司;植物乳杆菌NC8和产气荚膜梭菌α毒素plc基因重组植物乳酸杆菌pSIP409-plc/L.plantarumNC8由本实验室构建;pGEX-plc蛋白、兔抗产气荚膜梭菌plc基因多抗和鼠抗产气荚膜梭菌plc基因单抗由本实验室制备。健康商品化白来航雏鸡,购自哈尔滨成高子孵化场。HRP标记山羊抗兔IgG、FITC标记山羊抗兔IgG,购自北京中杉金桥生物技术有限公司;HRP标记山羊抗鸡IgA,购自英国Abcam公司;其他试验所用常规试剂为分析纯。
1.2 动物试验分组及菌液制备 免疫组:1日龄雏鸡随机分3组,24只/组,分别为空载体组(pSIP409/L.plantarumNC8)、plc组(pSIP409-plc/L.plantarumNC8)和PBS组,在7~28 d时分别连续以5×109CFU/mL菌液浓度灌胃免疫400 μL;攻菌组:1日龄雏鸡随机分成4组,18只/组,免疫方法同上,分别为空载体攻菌组、plc攻菌组、PBS攻菌组和PBS未攻菌组,免疫后在43~47 d时连续以5×108CFU/mL的A型产气荚膜梭菌ATCC13124标准株菌液200 μL/只灌胃攻菌5 d。
乳酸菌菌液的制备:将pSIP409-plc重组乳酸菌和pSIP-409空载体乳酸菌分别接种于MRS液体培养基(含红霉素终浓度为10 μg/mL),30 ℃厌氧培养至OD600值=0.2-0.3 h加入SppIP诱导肽,终浓度为50 ng/mL,培养30 h后,5 000 r/min离心10 min,PBS重悬洗涤3次后,在菌体沉淀中加入适量PBS,调整菌液浓度大约为5.0×109CFU/mL;产气荚膜梭菌ATCC13124标准株菌液的制备:A型产气荚膜梭菌ATCC13124标准株按1∶100(v/v)接种于庖肉培养基,37 ℃培养24 h。PBS调整菌液浓度大约为5.0×108CFU/mL。
1.3 免疫鸡肠道中分离plc阳性重组乳酸菌 于35 d剖杀3只鸡/组,载玻片刮取小肠、盲肠段靠近黏膜的内容物生理盐水冲洗,离心管中震荡,混匀后涂含2%碳酸钙的10 μg/mL Em+抗性MRS平板,厌氧培养48 h,挑取“溶钙圈”明显的菌落革兰染色鉴定后进行纯培养。菌液PCR方法对纯化后的plc阳性重组乳酸菌进行鉴定。
1.4 间接免疫荧光法对免疫鸡肠道中plc阳性重组乳酸菌的表达进行定位 于35 d剖杀3只鸡/组,无菌分离十二指肠、空肠和盲肠段,制作冰冻切片,3% BSA中4 ℃封闭过夜,PBS洗片,兔抗产气荚膜梭菌plc多抗血清用PBS进行1∶100倍稀释后作为一抗,37 ℃孵育1 h;洗片,FITC标记羊抗兔IgG荧光抗体PBS 1∶200倍稀释作为二抗,37 ℃孵育1 h;洗片,自然干燥后荧光显微镜观察。
1.5 间接ELISA检测免疫鸡血清及多种体液中抗plc特异性抗体IgG/sIgA效价 纯化后的plc蛋白0.1 μg/孔,收集免疫期间每7 d和攻菌后1、3、5、7、14、21 d的血清、粪便裂解液、支气管肺泡冲洗液、小肠洗液和胆汁稀释后作为一抗,同时加入PBS阴性对照,HRP标记的山羊抗鸡IgG/IgA稀释作为二抗,按常规ELISA步骤进行操作,测定OD490值吸光度。
1.6 攻菌后各组鸡小肠内细菌定植检测 攻菌后的1、3、5、7 d,每组剖杀3只鸡分别对十二指肠、空肠的卵黄憩室和回盲肠接口处进行TSC卵黄琼脂平板细菌分离并计数,检测免疫组和对照组肠道的梭菌数评价其免疫保护水平。
1.7 病理组织学检查与肠道病变评分
1.7.1临床症状观察 在免疫与攻菌期间密切观察各组的采食、饮水、排便情况以及鸡群的精神状态,进行记录。
1.7.2 病理切片制备 免疫组在免疫前及14、28、35、42、56 d,攻菌组在攻菌后1、3、5、7、14、21 d,每组随机取3只鸡进行病理剖检。取胸腺、脾脏和腔上囊、回肠、空肠、十二指肠、肝脏、心脏、肾脏和肺脏等组织器官固定后H.E.染色制作病理切片。
1.7.3 攻菌组肠道病变评分 攻菌后1、3、5、7、14、21 d,每组随机取3只鸡病理剖检。检测攻菌后各组鸡十二指肠至回肠部的可见病变。小肠病变指数按照1979年Prescott的病变指数标准进行评定[3],0:无大体病变;1+:小肠管壁变薄变脆;2+:局灶性坏死或溃疡;3+:大面积坏死;4+:严重或大范围的典型坏死。计算肠道病变指数平均分。
1.8 免疫及攻菌对雏鸡体重和免疫器官发育的影响 于免疫前、免疫期间每7 d及连续攻菌后每7 d记录各组鸡体重,计算各组鸡体重变化。免疫组分别于免疫后每7 d,攻菌组分别于攻菌后1、3、5、7、14 d和21 d,各剖检3只鸡,分离出胸腺、脾脏和腔上囊,吸干水分,称重。免疫器官指数(%)=免疫器官重(g)/鸡只活体重(g)×100 %。
1.9 数据分析 采用GraphPad Prism 5软件对数据进行双因素方差分析和Duncan′s多重比较。
2 结果
2.1 重组植物乳杆菌在免疫鸡肠道定植情况
2.1.1 免疫雏鸡肠道分离乳酸菌,厌氧培养48 h后,与对照组不同的是plc组和空载体组平板上有更多白色不透明的小圆形菌落,且菌落四周可见碳酸钙溶解产生的透明圆圈,镜检为革兰阳性杆菌,将纯培养的菌液进行PCR,plc组分离的乳酸菌在预计位置1 134 bp处出现目的条带。所以,结果显示在免疫鸡肠道分离到了我们的重组乳酸菌,说明重组乳酸菌可以在鸡肠道存在一段时间。
2.1.2 间接免疫荧光法对鸡肠道中重组乳酸菌的表达进行定位,plc免疫组鸡肠道多数肠段肠绒毛周围均显示出黄绿色荧光(见中插彩版图1-A、B和C),其中盲肠和空肠处荧光信号最强,十二指肠荧光信号较弱;而免疫含有空载体的植物乳杆菌和PBS对照组肠道绒毛没有显示出绿色荧光(见中插彩版图1-D、E和F)。
2.2 雏鸡免疫后抗产气荚膜梭菌plc抗体动态变化 免疫后IgG(图2-A)和sIgA(图3)抗体效价水平。免疫前抗体水平基本一致(P>0.05),免疫后plc组显著持续上升,空载体组略有上升,而PBS组无变化,免疫后7d开始plc组与其他组差异极显著(P<0.01)。
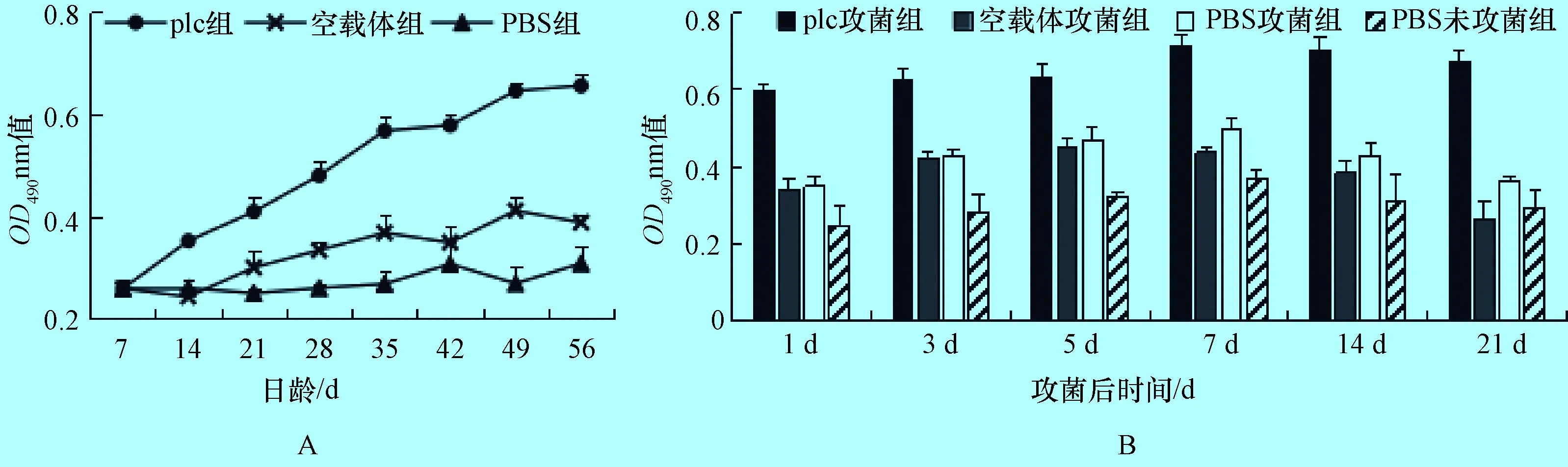
图2 免疫组(A)和攻菌组(B)雏鸡血清中抗C.Perfringens plc IgG抗体动态变化

图3 免疫组雏鸡各体液中抗C.Perfringens plc sIgA抗体动态变化
2.3 雏鸡攻菌后抗产气荚膜梭菌plc抗体动态变化 plc攻菌组在攻菌后7 d IgG抗体水平达到最高(图2-B);各体液中PBS攻菌组的sIgA抗体水平都明显低于plc攻菌组(P<0.01)。粪便裂解液、支气管肺泡液中plc攻菌组在攻菌后5 d达到最高,小肠洗液中plc攻菌组在攻菌后7 d达到最高,胆汁中plc攻菌组在攻菌后初期稍有下降,但后期重新升高(图4)。
2.4 攻菌后细菌分离、计数结果 分离到长出带有透明圆环的黑色圆菌落。镜检为革兰阳性杆菌,菌体两端钝圆,单个或成双排列,偶见链状。总的来看(图5),plc攻菌组检出水平最低(P<0.01)。回盲肠接口处空载体和PBS攻菌组细菌数量持续上升,在攻菌后5 d达到最多(P<0.01)且比其他几处都多,而此时plc攻菌组细菌数量开始下降,说明重组菌的免疫可减少其在肠道定植;卵黄憩室处攻菌后5 d时细菌数最多,在攻菌后7 d时空载体和PBS攻菌组细菌数仍然很多(P<0.01),而此时plc攻菌组细菌数开始减少;所有组别细菌数在十二指肠处最少。

图4 攻菌组雏鸡各体液中抗C.Perfringens plc sIgA抗体动态变化

图5 攻菌后产气荚膜梭菌分离计数结果(log10)
2.5 攻菌后各组病理剖检变化 攻菌3 d时PBS攻菌组开始排黄褐色稀便,随攻菌的持续,出现精神沉郁、嗜睡、食欲减退等现象。整体看,各组攻菌后1 d和3 d剖检病变轻微,5 d时最重,7 d后逐渐减轻。
2.6 病理组织学变化
2.6.1 免疫组雏鸡组织器官的病理组织学变化 病理组织学检查显示,免疫前后各组织器官健康状况良好,乳酸菌的免疫并没有对组织器官造成损害(见中插彩版图6)。21 d前各组无明显差异,28 d见plc组肠绒毛排列整齐致密,且绒毛长于其他组,隐窝深度略有下降,固有层淋巴细胞增多,十二指肠和空肠孤立淋巴小结及回肠集合淋巴小结增多。
2.6.2 攻菌组雏鸡组织器官的病理组织学变化 心脏:PBS和空载体攻菌组攻菌后5~7 d心肌颗粒变性明显,可见毛细血管扩张、充血,内皮细胞肿胀,心肌纤维变性坏死,弥散性出血,核淡染,肌纤维间距变大,肌束断裂或溶解(见中插彩版图7-A/B);14~21 d心外膜内淋巴细胞和巨噬细胞增多。plc攻菌组5~7 d心肌纤维肿胀,淋巴细胞和巨噬细胞增多,心肌纤维间散在红细胞;14~21 d心脏组织结构基本恢复。
肝脏:PBS和空载体攻菌组攻菌后5~7 d胞浆空泡化,核裂解,淋巴细胞和巨噬细胞显著增多,中央静脉和小叶间静脉扩张、充血,内皮肿胀,多量红细胞弥散于组织间隙(见中插彩版图7-C)。14~21 d病变减轻。plc攻菌组5~7 d窦状隙扩张,淋巴、巨噬、红细胞增多,核淡染(见中插彩版图7-D);14~21 d无明显病变。
肾脏:PBS和空载体攻菌组攻菌后5~7 d肾小球、肾小管上皮肿胀,间质内出血、水肿(见中插彩版图8-A);14~21 d间质内淋巴细胞和巨噬细胞增多。plc攻菌组5~7 d间质内大量炎性细胞浸润(见中插彩版图8-B);14~21 d病变减轻,仅肾小球肾小管轻度肿胀。
脾脏:PBS和空载体攻菌组攻菌后5~7 d病变加重,核浓缩或崩解,红髓血量减少,嗜酸性粒细胞浸润,白髓内淋巴细胞排列疏松,组织间见大量红细胞(见中插彩版图8-C);14~21 d淋巴细胞增多。plc攻菌组5~7 d少量嗜酸性粒细胞浸润,淋巴细胞略少;14~21 d红髓血量增多,淋巴生发中心明显。
腔上囊:PBS和空载体攻菌组攻菌后5~7 d淋巴细胞数量显著减少,核浓缩或碎裂,局部现小坏死灶,间质内见大量红细胞(见中插彩版图8-D);14~21 d间质内少量淋巴细胞、巨噬细胞和嗜酸性粒细胞浸润。plc攻菌组5~7 d间质内有少量淋巴细胞浸润和散在的红细胞,核深染;14~21 d无明显可见病理变化。
空肠:PBS和空载体攻菌组攻菌后5~7 d肠绒毛溶解断裂,黏膜上皮变性坏死、脱落,黏膜层变薄,杯细胞增多,固有层水肿,黏膜上皮与固有层间隙增宽,黏膜下层出血严重(见中插彩版图9-A);14~21 d绒毛溶解减轻,黏膜上皮细胞增生,杯细胞增多。plc攻菌组5~7 d黏膜上皮细胞增生,杯细胞增多,偶见肠绒毛上皮细胞溶解(见中插彩版图9-B);14~21 d杯细胞稍多。
回肠:PBS和空载体组攻菌后5~7 d肠绒毛结构不完整,固有层明显的出血或瘀血,柱状细胞排列紊乱,绒毛严重断裂、脱落、自溶,杯细胞增多、破裂,黏液量增多(见中插彩版图9-C);14~21 d绒毛组织结构模糊,仍可见黏膜上皮细胞增生。plc攻菌组5~7 d固有层中淋巴细胞大量增殖,淋巴小结数量增多,可见少量肠绒毛上皮细胞脱落,固有层轻微出血,杯细胞增多但少于PBS和空载体攻菌组;14~21 d绒毛形态较完整,固有层中淋巴细胞增多(见中插彩版图9-D)。
十二指肠:PBS和空载体组攻菌后5~7 d绒毛结构不完整,排列紊乱,核浓缩、结构模糊或溶解消失,部分绒毛脱落,黏膜下层淋巴细胞、巨噬细胞增多,组织间见多量红细胞,杯细胞增多(见中插彩版图9-E);14~21 d浆膜层内淋巴细胞和巨噬细胞浸润,黏膜上皮细胞增生。plc攻菌组5~7 d杯细胞增多,偶见绒毛顶端溶解;14~21 d十二指肠结构基本完整(见中插彩版图9-F)。
PBS未攻菌组在各组织器官中均未见病变。
2.7 重组植物乳酸杆菌免疫雏鸡攻菌后肠道病变评分 plc攻菌组(1.00±0.91Bb)<空载体攻菌组(2.06±0.87Aa) 2.8 重组植物乳酸杆菌免疫及攻菌对雏鸡体重的影响 免疫组体重变化规律(图10-A):plc组的体重和平均日增重量在各个监测点均高于其他组,且在35 d开始与其他组差异极显著(P<0.01);空载体组增长虽不如plc组明显,但仍比PBS组明显,且在49 d时与PBS组差异极显著(P<0.01)。攻菌组(图10-B)总趋势还是plc攻菌组体重最高,从攻菌后7 d开始PBS攻菌组明显下降(P<0.01);plc攻菌组日增重量初期略有下降,比PBS未攻菌组还低,但是在攻菌后14 d又再一次高于其他组,且一直保持到最后一个监测点。 图10 免疫组(A)及攻菌组(B)雏鸡体重的动态变化 2.9 重组植物乳酸杆菌免疫及攻菌对雏鸡免疫器官发育的影响 免疫开始前各免疫器官指数分别没有差别(P>0.05),胸腺指数在免疫结束时才明显上升;脾脏和腔上囊指数在49 d达最高。综合来看,plc组各指数最高,与其他组差异极显著(P<0.01)(图11)。 图11 免疫后雏鸡各免疫器官指数 总体看攻菌后各指数上升趋势变缓,plc攻菌组各免疫器官指数与其他各组差异极显著(P<0.01)。plc攻菌组胸腺指数在攻菌后7 d时恢复上升;plc攻菌组脾脏指数在攻菌后14 d降至最低,随后又上升(图12)。 图12 攻菌后雏鸡各免疫器官指数 雏鸡免疫保护试验检测结果可以看出重组菌对肠道产气荚膜梭菌的攻击起到了较好的保护作用,而空载体乳酸杆菌和PBS免疫组没有起到保护作用。 攻菌保护试验病理组织学检查表明,各器官病理组织学变化与产气荚膜梭菌感染的病变特点相符,病变较明显的是在小肠段,结果显示,plc攻菌组的病变程度比PBS和空载体组轻,这可以说明我们的重组菌对雏鸡的肠道起到了一定的保护作用。另外,试验结果显示,乳酸杆菌免疫组肠道组织切片中绒毛高度增加,隐窝深度降低。原因可能是乳酸杆菌能增强肠道中有机成分的溶解和吸收,避免其对肠道的直接刺激作用,进而降低肠道的损伤。增加了肠道中有益菌群可以减少有害菌群的繁殖,从而保障雏鸡肠道健康发育,增强雏鸡肠道对营养物质的消化、吸收能力。肠道病变评分结果显示,重组菌免疫后攻菌组鸡肠道损伤较轻,PBS攻菌组肠道损伤最严重;而PBS未攻菌组鸡肠道未见损伤。小肠产气荚膜梭菌分离结果表明,plc攻菌组与空载体和PBS攻菌组相比,小肠中产气荚膜梭菌检出水平较低,与肠道病变评分结果相呼应。plc攻菌组产气荚膜梭菌检出量比PBS攻菌组低的原因可能是重组菌在鸡肠道中的定植构成产气荚膜梭菌的空间位阻。 体重监测结果表明,免疫期间plc组的增重最高,其次是空载体组,最低的是PBS组。攻菌后体重差异总体趋势与免疫组基本一致,区别是PBS未攻菌组高于攻菌后的PBS组和空载体组,但是重组菌免疫后攻菌组体重还是明显高于PBS未攻菌组。攻菌后与攻菌前各组的平均日增重量相比有所下降,可能是因为产气荚膜梭菌对肠道的攻击影响了动物的食欲和肠道对营养的吸收。免疫器官指数计算结果表明,乳酸杆菌组的免疫器官指数都高于PBS组,且攻菌后重组菌的免疫器官指数还能高于PBS未攻菌组。胸腺、脾脏和腔上囊是禽类最主要的免疫器官,不仅参与机体的体液免疫和细胞免疫,而且它们的发育状态决定着机体的免疫水平。 整体评价重组菌的免疫效果,表明其能够在鸡肠道良好定植并减少产气荚膜梭菌的定植,诱导机体免疫应答,从而减轻肠道损伤,减缓腹泻症状,提高饲料利用率,提高鸡只的增重,对产气荚膜梭菌感染有良好保护作用。

3 讨论

