microRNA-199a-3p靶向CDK7对膀胱肿瘤细胞增殖的影响
邵长山 徐深秋 余淦 肖俊
目前,对于膀胱肿瘤的治疗,手段多样,但疗效还有待提高,迫切需要新的治疗方式来补充,深入研究膀胱肿瘤的发生、发展及复发机制具有重要临床意义。已经有大量研究报道microRNA参与肿瘤的发生、发展,miR-199a-3p作为microRNAs的一种多通过直接作用于靶基因调节其表达进而影响不同病理生理进程[1-2]。 CDK7作为依赖于细胞周期蛋白的激酶成员之一,在调节细胞周期方面有重要作用,且有研究报道其与肿瘤细胞的药物敏感性相关。有研究认为miR-199a-3p可以作为膀胱肿瘤的预后因子[3-5],至于miR-199a-3p及其与CDK7的相互作用如何影响膀胱肿瘤的发生、发展,暂未见系统研究报道。有研究报道miR-199a-3p可以通过靶向DDR1影响卵巢肿瘤的药物敏感性[6];并发现miR-199a-3p可以通过与长链非编码RNA相互作用影响CDK7的表达;还可通过调节Smad1的表达水平从而调节前列腺癌的生物学行为[7-8]。此外还有关于miR-199a-3p在人类其他肿瘤中的研究报道,包括肝癌[9]及乳腺癌[10]等;并发现其可能还参与乙肝病毒感染导致疾病的进程以及肿瘤干细胞的形成和发展[11-12]。本研究对CDK7是否可以作为miR-199a-3p的靶标基因以及两者共同调节膀胱肿瘤发生、发展的可能机制进行了探讨。
材料与方法
一、材料、试剂
11对膀胱肿瘤组织及其肿瘤旁正常组织来自湖北省京山县人民医院泌尿外科以及华中科技大学同济医学院附属同济医院泌尿外科,手术切除后15 min内收集标本并置于液氮或者-80 ℃冰箱中保存。膀胱肿瘤细胞系T24及EJ细胞(购自中科院上海细胞库),CDK7及内参抗体(购自ORGENTEC公司),细胞培养液及胎牛血清(购自hyclone公司),质粒构建及miR-199a-3p抑制剂和类似物(购自上海吉码制药技术有限公司),引物合成(湖北晶茂公司)。PCR仪及RNA浓度测量仪(购自美国Thermo公司及NanoDrop公司),PCR相关器材(购自上海拜力生物科技有限公司),其他相关器材(购自湖北晶茂公司等)。
二、细胞培养及细胞转染
T24及EJ细胞均采用10%的胎牛血清培养,待细胞融合度达到90%传代,培养条件为37 ℃含5% CO2,传代换液必要时可予以离心。待细胞生长至融合度为70%左右进行转染,本项目转染体系以6孔板的转染体系举例说明,其他转染体系根据这个体系酌情增减。用opti-MEM 100 μl 培养液稀释miR-199a-3p抑制剂或类似物和转染试剂脂质体8 μl,移液枪充分混匀后全部组合到1个EP管中静置15 min,后加入到细胞培养板中,整个培养体系容积为2 ml,转染48~72 h后进行后续实验。
三、逆转录实时定量PCR
Trizol提取细胞总RNA。实验所用组织碾磨器具用DEPC水浸泡过夜后高压灭菌烘干,准备好无RNA酶枪头、无RNA酶离心管、异丙醇、三氯甲烷以及乙醇和低温离心机等。加入1 ml Trizol裂解细胞或组织,15 min后于上述无RNA酶EP管中加入三氯甲烷0.2 ml,用振荡器震荡15 s后室温状态下静置5 min,于4 ℃离心机12 000 g离心10 min;取出EP管并仔细转移出上清至新的无RNA酶 EP管中,再加入0.5 ml异丙醇并轻轻混匀,常温下放置10 min后于4 ℃离心机12 000 g离心10 min;弃上清,加入1 ml 0 ℃的75%乙醇洗涤沉淀后于4 ℃离心机7 500 g离心5 min,弃上清;常温放置约5~10 min挥发多余水和酒精,注意避免完全干燥,加入30 μl 无RNA酶纯水溶解RNA;最后将RNA样品于55 ℃水浴锅中变性10 min,待冷却至室温后测RNA样品额纯度及浓度备用。实时定量PCR体系根据Fermantas试剂盒提供的说明进行操作,反应条件根据引物退火温度适当调整。
四、荧光素酶报告实验
分别将T24及EJ细胞种植于24孔板中,待细胞生长至70%左右的细胞融合度,根据上述转染体系调整24孔板所需要的转染体系,转染48 h后Dual-LuciferaseTMReporter Assay System检测萤火虫荧光素酶活性,记录并分析。
五、增殖实验
MTS试剂与细胞培养液按照10∶1比例添加,预混合,细胞转染结束48 h后消化细胞,将细胞种植于96孔板中,每孔2 000个细胞,体系为200 μl,种植96孔板设计6个复孔,并在种植细胞孔周围覆盖PBS溶液以防培养液挥发而影响实验结果。根据实验设计的时间点分别在加入了MTS无血清培养液孵育2 h后酶标仪检测吸光度,记录并分析数据。
六、统计学方法
应用SPSS 18.0软件进行实验数据分析。两组之间的比较整体数据符合正态分布的选用t检验,P<0.05为差异有统计学意义。
结 果
一、miR-199a-3p、CDK7在膀胱肿瘤组织中的表达及其相关性
实时定量PCR检测结果显示,11对新鲜膀胱肿瘤组织中有10对miR-199a-3p的表达较相应正常对照组织显著下降,且绝大部分表达减少达80%以上,1对肿瘤组织和对照组织表达水平无明显差异,但是总体数据统计分析比较,差异有统计学意义(P<0.01)。见图1A。除了1对组织中CDK7表达无明显差异外,其余10对膀胱肿瘤组织中CDK7的表达均较正常对照组织显著升高,绝大部分升高了4倍以上,总体数据统计分析比较,差异有统计学意义(P<0.01)。见图1B。miR-199a-3p和CDK7表达无明显差异者并非同1对膀胱肿瘤组织,相关性分析发现,11对膀胱肿瘤组织中miR-199a-3p和CDK7的表达呈负性相关(P=0.040 4,R2=0.338 7)。见图1C。
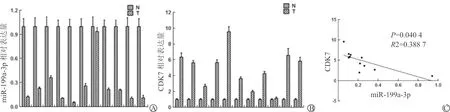
A:11对新鲜膀胱肿瘤组织与对照组织中miR-199a-3p的基础表达水平;B:11对新鲜膀胱肿瘤组织与对照组织中CDK7的基础表达水平;C:miR-199a-3p和CDK7在膀胱肿瘤组织中表达的相关性
图1 膀胱肿瘤组织中miR-199a-3p和CDK7的表达及其相关性分析
二、miR-199a-3p对肿瘤细胞增殖作用的影响
逆转录实时定量PCR检测结果显示,T24和EJ细胞中转染miR-199a-3p 类似物(miR-199a-3p mimics) 3 d后,miR-199a-3p的表达较对照组(mimics NC)显著上升,均达10倍以上,差异有统计学意义(P<0.01)。见图2A。T24和EJ细胞中转染miR-199a-3p 抑制剂(miR-199a-3p inhibitor)后,miR-199a-3p的表达较对照组(inhibitor NC)则出现了明显下降,差异有统计学意义(P<0.01)。见图2B。验证转染系统有效。转染miR-199a-3p 类似物后T24和EJ细胞的增殖均受到了明显的抑制,在实验结束时间点的抑制率分别为33.65%和39.12%;同时,转染miR-199a-3p 抑制剂后T24和EJ细胞的增殖得到明显增强,细胞增殖能力在实验结束时间点分别提高了13.94%和11.69%,差异均有统计学意义(P<0.01)。见图2C、2D。

A:T24和EJ细胞中转染miR-199a-3p 类似物后,miR-199a-3p的表达;B:T24和EJ细胞中转染miR-199a-3p 抑制剂后, miR-199a-3p的表达;C:T24细胞中转染miR-199a-3p 类似物后,细胞增殖能力下降,转染miR-199a-3p 抑制剂后,细胞增殖能力增强;D:EJ细胞中转染miR-199a-3p 类似物后,细胞增殖能力下降,转染miR-199a-3p 抑制剂后,细胞增殖能力增强
图2 转染效率验证及膀胱肿瘤细胞增殖能力检测
三、miR-199a-3p对CDK7蛋白水平的影响
在T24细胞中,共转染CDK7野生型3′UTR(WT 3′UTR )后miR-199a-3p 类似物荧光素酶活性下降了27.55%,而在共转染CDK7突变型3′UTR (MUT 3′UTR )后荧光素酶活性无明显改变;共转染CDK7 WT 3′UTR后miR-199a-3p 抑制剂荧光素酶活性上升了16.57%,而在共转染CDK7 MUT 3′UTR后荧光素酶活性无明显改变,差异有统计学意义(P<0.01)。见图3A。荧光素酶报告系统证实CDK7可以作为miR-199a-3p的靶标基因。在EJ细胞中,共转染CDK7 WT 3′UTR后miR-199a-3p 类似物荧光素酶活性下降了15.68%,而在共转染CDK7 MUT 3′UTR后荧光素酶活性无明显改变;共转染CDK7 WT 3′UTR后miR-199a-3p 抑制剂荧光素酶活性上升了24.53%,而在共转染CDK7 MUT 3′UTR后荧光素酶活性无明显改变,差异有统计学意义(P<0.01)。见图3B。miR-199a-3p种子序列可以与CDK7 3′端非翻译区以碱基互补配对相结合。见图3C。免疫印迹实验提示在EJ和T24细胞中转染miR-199a-3p 类似物后, CDK7的表达显著下降。见图3D。

A:在T24细胞中转染 WT 3′UTR后荧光素酶活性下降,转染MUT 3′UTR后荧光素酶活性无明显改变;B:在EJ细胞中转染 WT 3′UTR后荧光素酶活性下降,转染MUT 3′UTR后荧光素酶活性无明显改变;C:种子序列碱基互补配对位点;D:T24和EJ细胞中转染miR-199a-3p 类似物后CDK7的翻译水平的变化
图3 荧光素酶报告实验、配对位点及免疫印迹实验
四、CDK7可以回复或者部分回复miR-199a-3p对膀胱肿瘤细胞增殖的抑制作用
相对于单独转染miR-199a-3p类似物,在T24细胞中共转染miR-199a-3p类似物和CDK7后,膀胱肿瘤细胞增殖能力提高了42.11%,差异有统计学意义(P<0.01)。见图4A。在EJ中重复同样的实验,发现共转染miR-199a-3p类似物和CDK7后,相对于单独转染miR-199a-3p类似物,膀胱肿瘤细胞增殖能力提高了45.49%,差异有统计学意义(P<0.01)。见图4B。
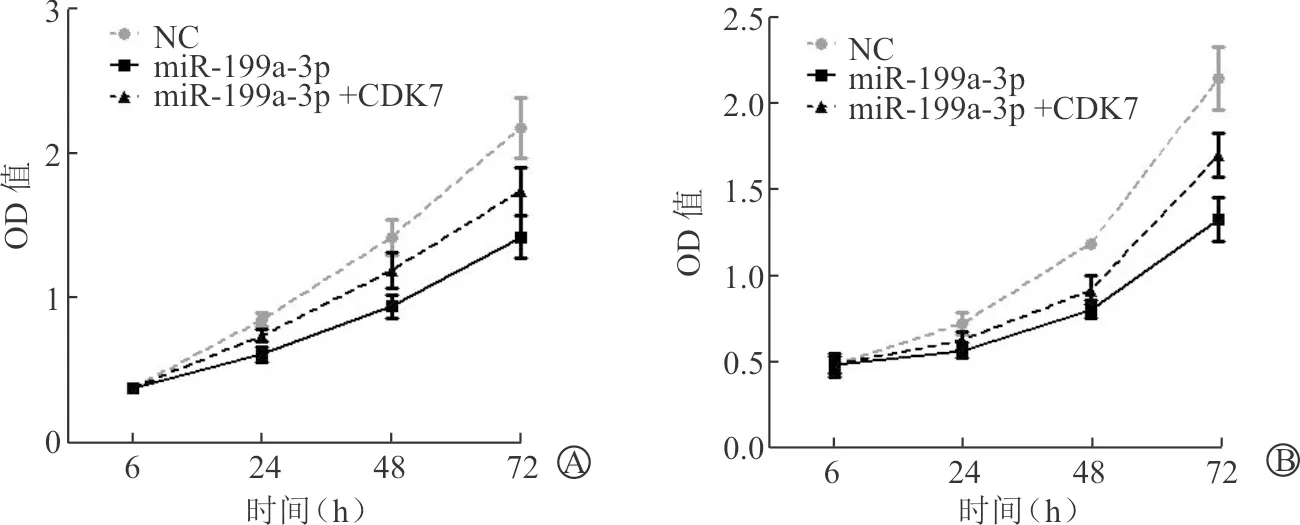
A:T24;B:EJ
图4 功能回复实验
讨 论
膀胱肿瘤是我国人群中泌尿系肿瘤发病率第一位的肿瘤,对其发病机制进行系统详细的研究尤为重要。近些年,虽然推出了多种新的膀胱肿瘤的治疗方式,但是很多病例的治疗效果并不十分理想。microRNA作为体内重要的非编码RNA,大量研究证明其在人类肿瘤中有重要的调节功能,其经典作用机制是通过与靶标基因相结合降解靶标基因的信使RNA或者影响信使RNA的翻译,从而影响靶标基因的表达,进而影响病理生理进程。本研究首先在膀胱肿瘤组织中分别检测了miR-199a-3p和CDK7的表达,发现miR-199a-3p的表达减低,同时CDK7的表达升高,且二者的表达呈负相关关系,部分肿瘤组织中miR-199a-3p和CDK7的表达无明显变化,说明其在膀胱肿瘤中的表达存在一定的变异性。了解了miR-199a-3p的表达模式后我们进一步研究了miR-199a-3p在膀胱肿瘤中的功能作用,通过过表达和降低miR-199a-3p的表达后发现其可以明显抑制膀胱肿瘤细胞的增殖,说明miR-199a-3p在膀胱肿瘤中起着抑癌基因样作用。接着通过荧光素酶报告系统证实miR-199a-3p可以直接靶向CDK7的3′端非翻译区,同时免疫印迹实验证实miR-199a-3p可以在翻译水平降低CDK7的表达,说明miR-199a-3p抑制膀胱肿瘤细胞的增殖可能是通过靶向CDK7实现的。最后通过功能回复实验得到验证。
综上所述,miR-199a-3p通过直接靶向CDK7,实现其在膀胱肿瘤中的肿瘤抑制基因样作用,抑制膀胱肿瘤细胞的增殖。本研究进一步丰富了膀胱肿瘤的生物学理论。

